M.hydrocarbonoclasticus NY4中N2OR的酶活测定及环境因素对酶活力的影响
2016-04-26王鹏胤高浩峰
王鹏胤,高 远,高浩峰,胡 南
(南京工业大学生物与制药工程学院,江苏南京211800)
M.hydrocarbonoclasticusNY4中N2OR的酶活测定及环境因素对酶活力的影响
王鹏胤,高远,高浩峰,胡南
(南京工业大学生物与制药工程学院,江苏南京211800)
摘要:氧化亚氮(N2O)是一种主要的温室气体,其生物学减量控制已经成为研究热点。在自然环境中,氧化亚氮还原酶(N2OR)是唯一能将N2O还原成N2的酶。以1株能在高盐条件下进行厌氧及好氧反硝化作用的海杆菌Marinobacter hydrocarbonoclasticus NY4为研究对象,建立了一种稳定的N2OR酶活检测方法,考察了pH、盐质量分数以及碳氮比(C/N)等环境因素对N2OR酶活力的影响。结果发现:当pH为7时、盐质量分数为6%~8%、C/N为8时,N2OR呈现出了最高的酶活。本实验结果丰富了对N2OR酶学特征的了解,为N2O生物减量控制提供了部分参考。
关键词:pH;盐浓度;C/N;N2OR
氧化亚氮(N2O)是6种主要的温室气体之一,由它产生的温室效应为CO2的320倍[1]。超过2/3的N2O源于土壤生态圈的氮素循环过程[2-3],
氧化亚氮还原酶(N2OR)是唯一能将N2O还原成N2的生物酶,在很多具有反硝化功能的微生物中都证实了它的存在[4-6]。关于氧化亚氮还原酶的酶学性质,目前研究甚少,其中Ferrettl等[7]和Dell′Acqua等[8-9]分别从Alcaligenesxylosoxidans和Marinobacterh ̄y ̄d ̄r ̄o ̄c ̄a ̄r ̄b ̄o ̄n ̄o ̄c ̄l ̄a ̄s ̄t ̄i ̄c ̄u ̄s617的细胞培养物中直接分离出了N2OR,并对其生化性质进行了研究,他们提出反应体系中铜离子的存在及铜离子价态差异对酶活性有重大影响;Liu等[10]将源于GeobacillusthermodenitrificansNG80-2的N2OR编码基因在大肠杆菌中实现了外源表达,但酶活较低;Shen等[11]将PseudomonasstutzeriZoBellATCC 14405中的N2OR编码基因导入了烟草植物,发现植入N2OR编码基因的植株具有更好的N2O还原能力。
笔者所在实验室成员从盐城市新滩盐场分离到了1株高效的反硝化细菌海杆菌M.h ̄y ̄d ̄r ̄o ̄c ̄a ̄r ̄b ̄o ̄nocla ̄s ̄t ̄i ̄c ̄u ̄sNY4,发现其能在厌氧及好氧条件下完成快速的反硝化反应,反硝化终端产物均为N2,而其底物生长范围广泛,能在1%~15%的盐浓度条件下生长,因此该菌具有重要的理论研究价值和应用前景[12]。拟考虑到环境中影响N2O排放的主要因素是C/N和pH[13-14]以及M.hydrocarbonoclasticusNY4是一种耐盐的海洋微生物,因此,本实验考察了碳氮比(C/N)、pH以及盐浓度对N2OR酶活力的影响,并建立以细胞裂解液测定N2OR酶活的方法。
1材料与方法
1.1材料
菌株M.hydrocarbonoclasticusNY4筛选自江苏省盐城市的新滩盐场。
活化培养基(g/L):牛肉膏 5,蛋白胨 10,NaCl 80,KCl 5,MgSO4·7H2O 2.5。
发酵培养基(g/L):蛋白胨 10,酵母提取物 5,NaCl 10,CuSO4·5H2O 0.2。
1.2N2OR粗酶液制备
将NY4菌种从冻存管中取出,在活化培养基中过夜培养,然后按1%的接种量(体积分数)转接到100 mL的发酵培养基,30 ℃培养12 h,将获得的M.h ̄y ̄d ̄r ̄o ̄c ̄a ̄r ̄b ̄o ̄n ̄o ̄c ̄l ̄a ̄s ̄t ̄i ̄c ̄u ̄sNY4菌液静置24 h,离心收集菌体,重悬于5 mL浓度为20 mmol/L Tris-HCl缓冲液中,超声波法进行细胞破碎(振幅25%、频率10 Hz、10 min),高速离心后取上清,即得粗酶液5 mL。粗酶液用0.45 μm的水系过滤后,保存在充满气体He的西林瓶中。
1.3N2OR酶活的测定
酶活测定方法在文献[9]的基础上进行改进,向容量为3.5 mL的比色皿中加入20 mmol/L的Tris-HCl缓冲液(pH 7.0)1.5 mL、10 mmol/L的甲基紫精溶液0.2 mL,酶液0.1 mL,比色皿密封后反复进行抽真空和充He处理,用少量的704硅胶封住针孔,以确保比色皿在测定过程中维持厌氧状态。用微量注射器向比色皿中注入适量现配浓度为50 mmol/L的连二亚硫酸钠溶液,后者与甲基紫精形成蓝色中间体,使得混合反应液在600 nm处的吸光值(A600值)保持在1.0~1.2,相对稳定。向比色皿中注入0.1 mL的N2O饱和溶液,启动酶催化反应,在N2OR的催化作用下,甲基紫精与连二亚硫酸钠的蓝色中间体作为电子供体向N2O提供还原性电子,同时褪去蓝色,混合反应液的A600值也随之降低,A600斜率降低幅度反映了N2OR酶催化反应的速率。分光光度计记录5 min内每隔10 sA600的变化(加入前1 min与加入后4 min),绘制A600值的变化曲线,并计算斜率,前1 min内的曲线斜率在-0.02~0.01之间为有效数据,后4 min的斜率为这段时间的平均斜率,在数值上,酶活力=(-斜率)/11.4。N2O饱和溶液采用N2O气体向双蒸水中持续鼓泡0.5 h的方法获得[15]。甲基紫精的消光系数为11.4 mmol/(L·cm)[16]。
1.4环境因素对N2OR酶活的影响
配制不同环境条件下的发酵培养基,按1%的接种量将活化后的菌株NY4分别接入其中,在30 ℃转速为200 r/min的条件下过夜培养。然后,分别取1 mL菌液,在波长为600 nm处测定吸光值A600,作为细菌生长量的参考。剩余的菌液按照酶活测定方法,测定N2OR酶活。
1.4.1pH对N2OR酶活的影响
配制5份100 mL发酵培养基,用HCl和NaOH调节其pH分别为6、7、8、9和10。此时,盐质量分数为2%,C/N为10。
1.4.2盐质量分数对N2OR酶活的影响
配制6份NaCl质量分数分别为0、2%、4%、6%、8%和10%的发酵培养基各100 mL。此时pH为7,C/N为10。
1.4.3C/N对N2OR酶活的影响
发酵培养基中的总氮为3 000 mg/L,化学需氧量(COD)为30 g/L,C/N为10,通过添加NaNO3作为无机氮调节培养基的C/N分别至3、4、5、6、7、8、9和10,每份配制100 mL。此时的pH为7,盐质量分数为2%。
2结果与讨论
2.1海杆菌NY4的N2OR酶活测定
根据实验方法制取菌株 NY4的粗酶液,以不具有N2OR酶活的大肠杆菌作为阴性对照。反应过程中的A600值变化曲线如图1所示。由图1可知:在5 min的测定过程中,含有N2OR酶活的NY4粗酶液使甲基紫精与连二亚硫酸钠形成的蓝色中间体褪色明显,在反应的第1~2 min内尤为剧烈,表明此时大量的还原性电子从蓝色中间体传递至N2O并将后者还原成N2,而不含有N2OR酶的大肠杆菌细胞裂解液几乎不能催化N2O的还原反应。根据拟合直线的斜率计算出酶活:0.1 mL粗酶液的酶活为0.05 U,依此推算,5 mL粗酶液(100 mL菌液)中N2OR的总酶活为2.50 U。
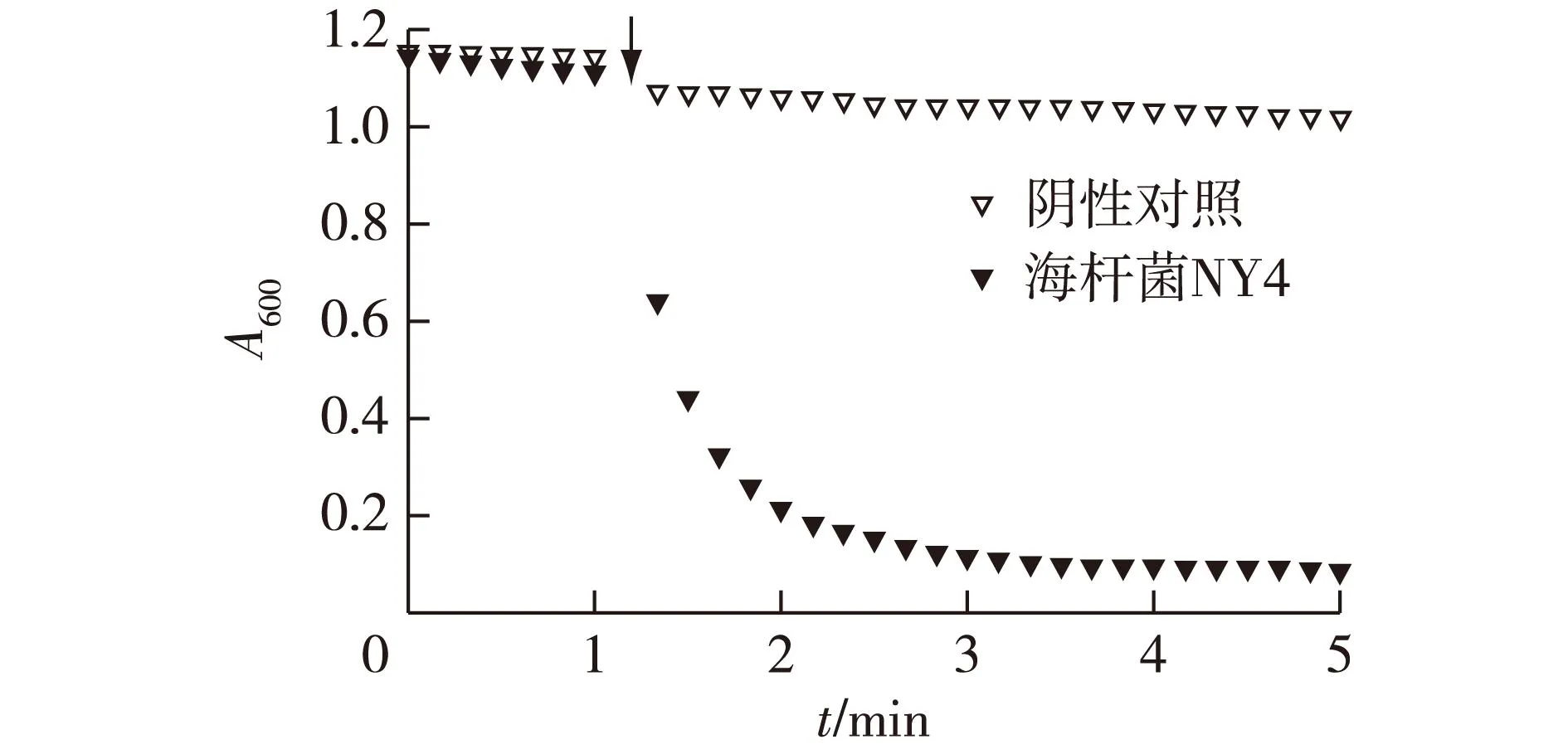
图1 测定N2OR酶活时A600的变化Fig.1 Changes of A600 in the assaying of N2OR activity
N2OR对O2极为敏感,反应体系在整个测定过程中均要求维持厌氧状态,包括混合溶液中的溶解氧也要去除干净,因此,N2OR的酶活测定相对困难,Dell′acquq等[9]采用厌氧手套箱完成整个测定过程,由于常规分光光度计难以放置在实验室小型厌氧手套箱内,因此笔者改进了测定方法,采用向封闭比色皿中混合溶液反复冲加气体He的策略,有效地维持了其厌氧状态,从而对N2OR的酶活进行了准确测定。
2.2pH对N2OR酶活性的影响结果
实验设置了5个pH梯度,但当pH为6时,M.hydrocarbonoclasticusNY4生长状况极差,因此没有进行后续的酶活测定及分析。从图2可以看出,菌体生长量及N2OR酶活在pH为7时均为最大,并随着pH值的上升呈现同步下降现象,相对于菌体生长,酶活下降则更为明显,尤其当pH为10时,N2OR酶活急剧下降。Dell′acquqa等[9]在研究中指出,N2OR对pH变化是敏感的,在碱性条件下能获得更高的酶活。而在实验结果中,酶活在pH为7的中性条件下达到最高,随着碱性提高,N2OR酶活损失明显,这与土壤环境中N2O的释放规律是一致的,研究表明自然环境中N2O的排放通常与环境pH呈正相关关系[17]。
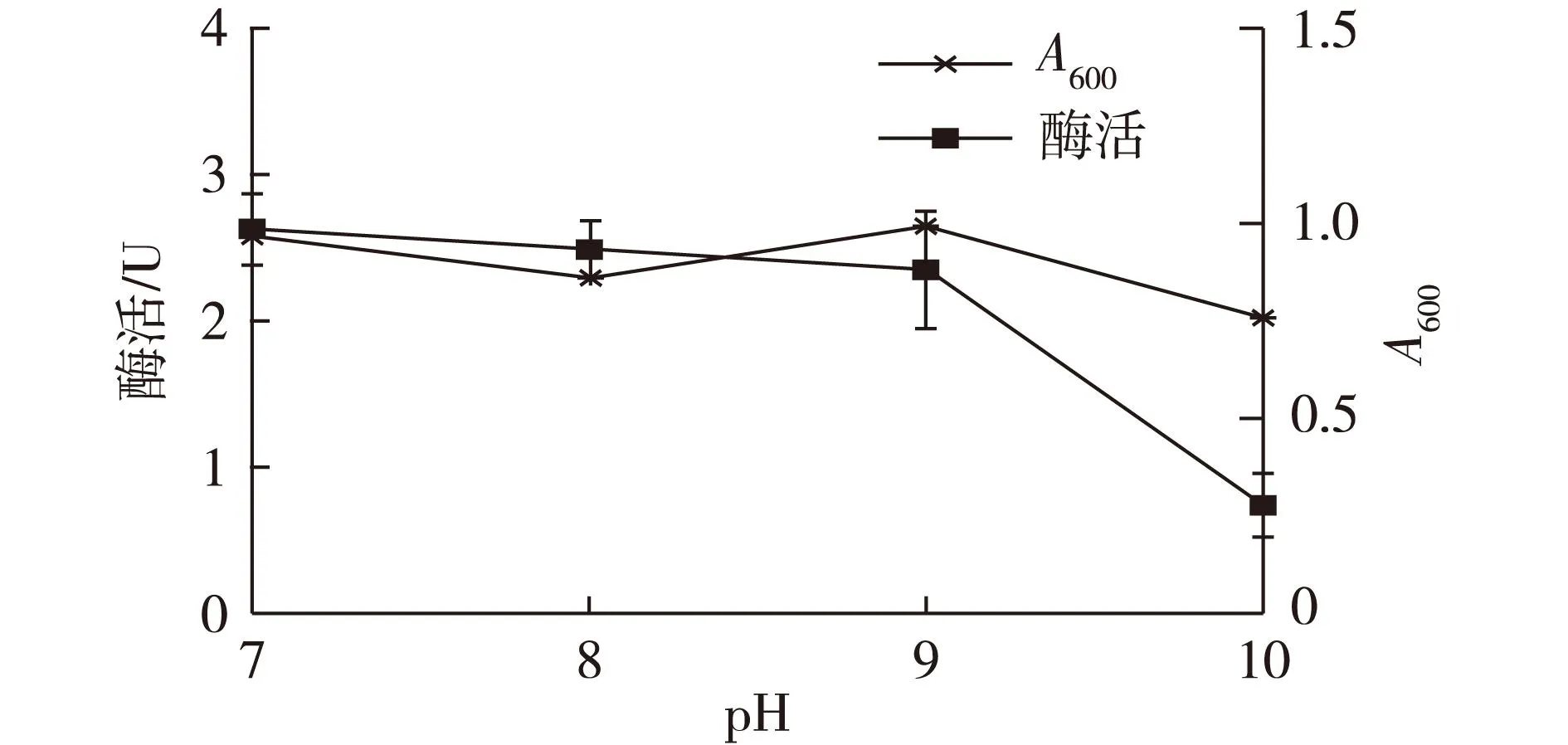
图2 pH对菌体生长及N2OR酶活的影响Fig.2 Effects of pH on the cell growth and N2OR activity
2.3盐质量分数对N2OR酶活性的影响结果
M.hydrocarbonoclasticusNY4是一种海洋微生物,盐质量分数对其生长代谢及反硝化能力都有影响[12],结果如图3所示,由图3可知:菌体的最适生长盐质量分数为2%,当盐质量分数为8%时,菌体表现出最高的总氮去除能力。随着盐质量分数的增加,N2OR的酶活呈现上升趋势。当盐质量分数大于6%时,即使细胞生长受到抑制,但N2OR酶活稳定在2.50 U左右,而当盐质量分数低于4%时,酶活显著降低,这个结果也部分解释了前期实验中发现的高盐条件下获得更高总氮去除率的现象。推测的原因有二:一是较高盐条件下,N2OR编码基因的转录表达量增加;二是高盐条件下, N2OR具有更高的底物催化效率。具体原因有待后续实验证实。
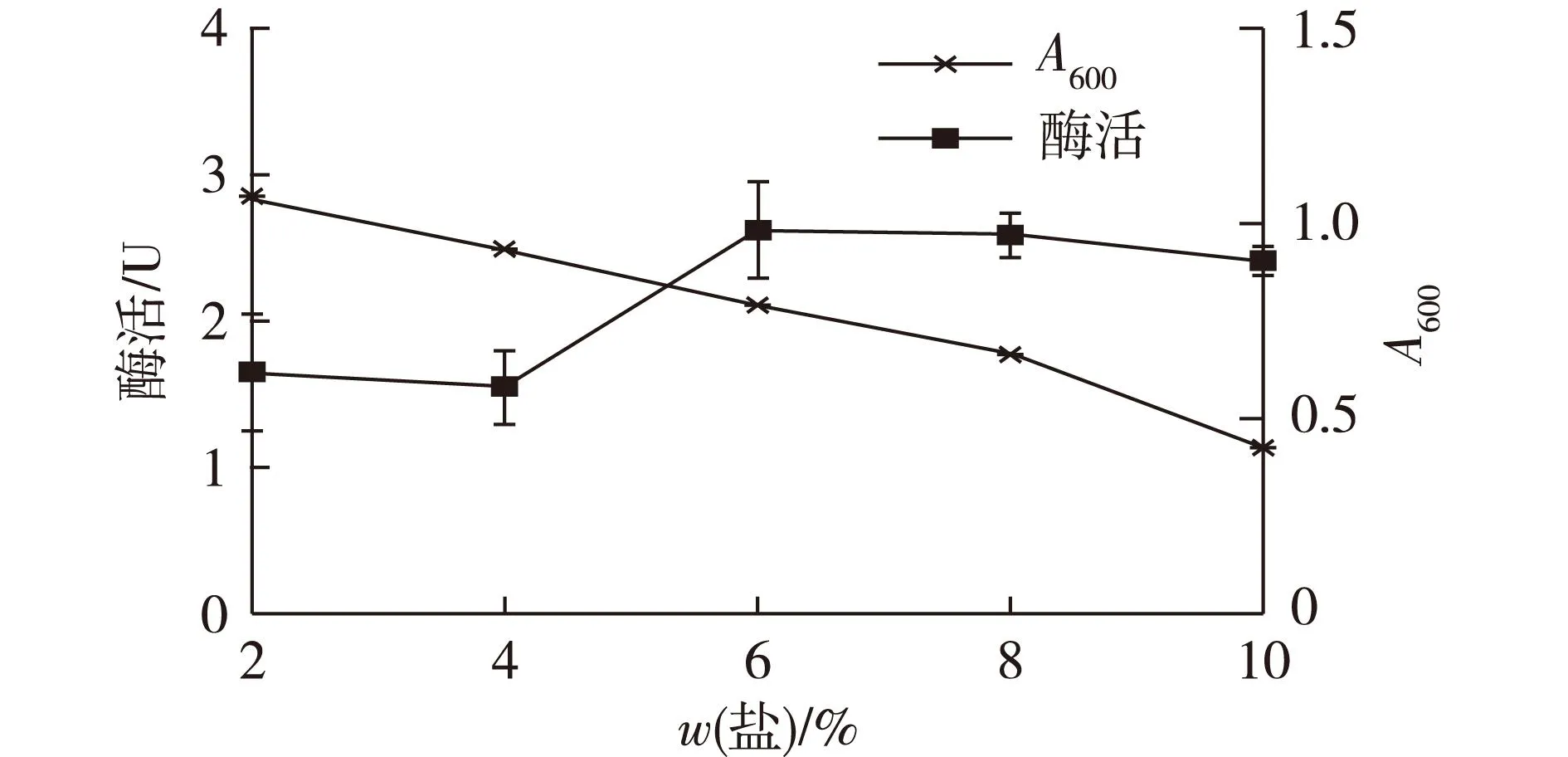
图3 盐质量分数对菌体生长及N2OR酶活的影响Fig.3 Effects of salinity on the cell growth and N2OR activity
2.4C/N对N2OR酶活性的影响结果
N2OR的电子竞争力较弱,足够的还原性电子有利于N2O的还原,而还原力是由碳源提供的,因此,C/N对N2OR的活性及N2O的排放有较大影响[13]。本实验采用固定碳源改变氮源的方式研究C/N对N2OR酶活的影响,结果如图4所示。由图4可知:C/N对菌体生长影响较小,尤其是当C/N为4~9时,菌体生长平稳;但C/N的变化对N2OR酶活影响明显,当C/N小于8时,N2OR酶活随着C/N的升高而增加,当C/N为8时酶活力达到峰值。
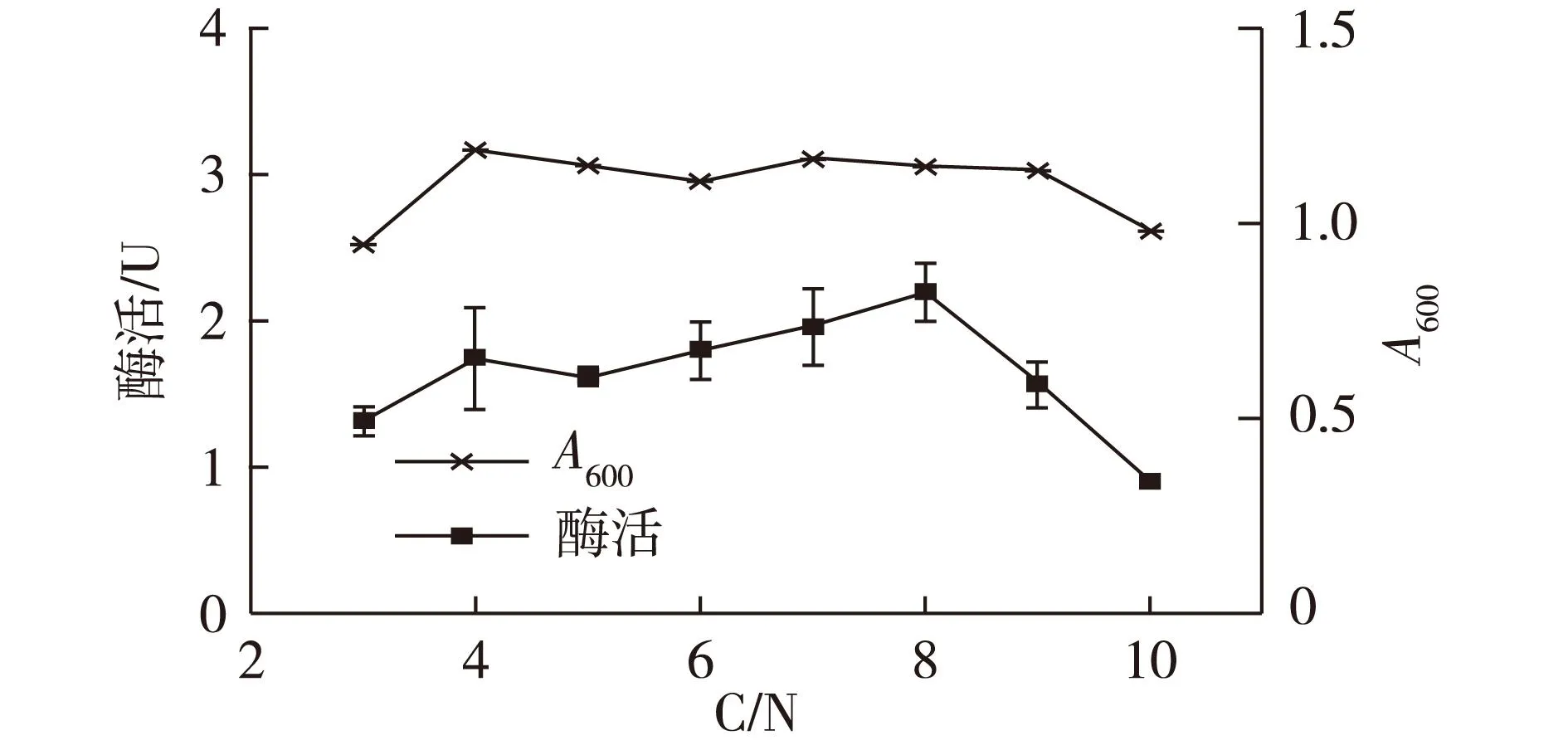
图4 C/N对菌体生长及N2OR酶活的影响Fig.4 Effects of C/N on the cell growth and N2OR activity
3结论
N2O的排放及减量控制受到了环境工作者越来越多的关注,而氧化亚氮还原酶是自然环境中唯一能直接将N2O还原为N2的生物酶。本实验以一株源自海洋具备处理含盐含氮废水能力的细菌M.h ̄y ̄d ̄r ̄o ̄c ̄a ̄r ̄b ̄o ̄n ̄o ̄c ̄l ̄a ̄s ̄t ̄i ̄c ̄u ̄sNY4为研究对象,建立了氧化亚氮还原酶的酶活测试方法,考察了几种主要的环境因素对N2OR酶活力的影响,结果表明,当pH 7时、盐质量分数为6%~8%以及 C/N为8时,菌体细胞表现出了最大的N2OR活力。研究结果对M.hydrocarbonoclasticusNY4中N2OR的酶活及影响因素进行了真实的评价,也为这一类型反硝化细菌的后续应用提供了有力参考。
参考文献:
[1]王洪君,王为东,卢金伟,等.湖滨带温室气体氧化氮(N2O)排放研究[J].生态环境,2006,15(2):270-275.
[2]LASSEY K,HARVEY M.Nitrous oxide:the serious side of laughing gas[J].Water Atmosphere,2007,2(15):10-11.
[3]KIMOCHI Y,INAMORI Y,MIZUOCHI M,et al.Nitrogen removal and N2O emission in a full-scale domestic wastewater treatment plant with intermittent aeration[J].J Ferment Bioeng,1998,86(2):202-206.
[4]ZHANG X,HE L,ZHANG F,et al.The different potential of sponge bacterial symbionts in N2release indicated by the phylogenetic diversity and abundance analyses of denitrification genes,nirK andnosZ[J].PLoS One,2013,6(8):e65142.
[5]PRIEME A,BRAKER G,TIEDJE J M.Diversity of nitrite reductase (nirK andnirS) gene fragments in forested upland and wetland soils[J].Appl Environ Microbiol,2002,68(4):1893-1900.
[6]AUCLAIR J,PARENT S,VILLEMUR R.Functional diversity in the denitrifying biofilm of the methanol-fed marine denitrification system at the montreal biodome[J].Microb Ecol,2012,63(4):726-735.
[7]FERRETTI S,GROSSMANN J G,HASNAIN S S,et al.Biochemical characterization and solution structure of nitrous oxide reductase fromAlcaligenesxylosoxidans(NCIMB 11015)[J].FEBS J,1999,259(3):651-659.
[8]DELL′ACQUA S,PAULETA S R,MOURA J J,et al.Biochemical characterization of the purple form ofMarinobacterhydrocarbonoclasticusnitrous oxide reductase[J].Philos Trans R Soc Lond B Biol Sci,2012,367:1204-1212.
[9]DELL′ACQUA S,PAULETA S R,MONZANI E,et al.Electron transfer complex between nitrous oxide reductase and cytochrome[J].Biochemistry,2008,47(41):10852-10862.
[10]LIU X,GAO C,ZHANG A,et al.Thenosgene cluster from gram-positive bacteriumGeobacillusthermodenitrificansNG80-2 and functional characterization of the recombinant NosZ[J].FEMS Microbiol Lett,2008(289):46-52
[11]WAN S,MOTTIAR Y,JOHNSON A M,et al.Expression of thenosoperon proteins fromPseudomonasstutzeriin transgenic plants to assemble nitrous oxide reductase[J].Transgenic Res,2012,21(3):593-603.
[12]LI R P,ZI X L,WANG X F,et al.MarinobacterhydrocarbonoclasticusNY-4,a novel denitrifying,moderately halophilic marine bacterium[J].SpringerPlus,2013,2:346.
[13]李鹏章,王淑莹,彭永臻,等.COD/N与pH值对短程硝化反硝化过程中N2O产生的影响[J].中国环境科学,2014(8):2003-2009.
[14]CUHEL J,SIMEK M,LAUGHLIN R J,et al.Insights into the effect of soil pH on N2O and N2emissions and denitrifier community size and activity[J].Appl Environ Microbiol,2010,76(6):1870-1878.
[15]ZEGOTA H.The effect ofγ-irradiation on citrus pectin in N2O and N2O/O2saturated aqueous solutions[J].Food Hydrocolloids,1999(1):51-58.
[16]KRISTJANSSON J K,HOLLOCHER T C.First practical assay for soluble nitrous oxide reductase of denitrifying bacteria and a partial kinetic characterization[J].J Biol Chem,1980,255(2):704-707.
[17]靳红梅,常志州.追施沼液对不同pH土壤CH4和N2O排放的影响[J].农业环境科学学报,2013(8):1648-1655.
(责任编辑周晓薇)
Determination and characterization of nitrous oxide reductase inMourinobacterhydrocarbonoclasticusNY4
WANG Pengyin,GAO Yuan,GAO Haofeng,HU Nan
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
Abstract:Nitrous oxide (N2O) is a major greenhouse gas,and its biological reduction has become a hot topic. Nitrous oxide reductase (N2OR) is the only enzyme that can reduce N2O to N2 in natural environments. Marinobacter hydrocarbonoclasticus NY4,a halophilic bacterium with the ability of anaerobic and aerobic denitrification,was used in this study.We established a stable method to determine the activity of N2OR,and studied the influence of key environment factors on the activity of N2OR including pH value,salt concentration and carbon/nitrogen ratio (C/N). When pH was at 7,the salinity was 6% and C/N was 8,strain NY-4 exhibited the highest N2OR activity. The experimental data enriched the knowledge of the characteristics of N2OR,and provided some references for the biological reduction of N2O.
Keywords:pH; salinity; C/N; N2OR
中图分类号:X701
文献标志码:A
文章编号:1672-3678(2016)02-0047-04
作者简介:王鹏胤(1989—),女,江苏常州人,研究方向:分子微生物学;胡南(联系人),副教授,E-mail:hunan@njtech.edu.cn
基金项目:国家自然科学基金(31270162)
收稿日期:2015-04-13
doi:10.3969/j.issn.1672-3678.2016.02.009
