不同盐浓度下硅对高羊茅苗期生长及光合特征的影响
2017-08-11林丽果林选栋蒋勇斌刘慧霞
林丽果,宋 锐,林选栋,蒋勇斌,刘慧霞
(西北民族大学生命科学与工程学院,甘肃 兰州 730030)
不同盐浓度下硅对高羊茅苗期生长及光合特征的影响
林丽果,宋 锐,林选栋,蒋勇斌,刘慧霞
(西北民族大学生命科学与工程学院,甘肃 兰州 730030)
坪用高羊茅(Festucaarundinacea)因长期多频灌溉往往生长在土壤盐渍化或潜在盐渍化的生境中,本研究采用盆栽试验分析了不同盐浓度下硅对两个高羊茅品种(抗性强的XD和抗性弱的K31)种子发芽、苗期生物量及光合特征的影响。结果表明,盐浓度、硅、品种、盐浓度×品种以及硅×盐浓度互作均显著影响了高羊茅种子发芽及苗期光合特征(P<0.05)。两个品种XD和K31的出苗率、保苗率、生物量以及光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、气孔限制值(Ls)均随盐浓度增加呈整体下降趋势,而胞间CO2浓度(Ci)随盐浓度增加整体呈上升趋势。硅在一定盐浓度范围内显著提高了XD和K31的出苗率、保苗率、生物量、Pn、Gs和Ls,而降低了Ci、Tr(P<0.05),且同一盐浓度下K31对硅响应的敏感性大于XD,这说明添加硅对盐生境下高羊茅生长的影响与品种自身抗性密切相关。
高羊茅;盐浓度;硅;种子发芽;生物量;光合特性
草坪绿地是现代城市的重要组成部分[1],其观赏性和良好的生态功能需要合理的管理和维护,但草坪绿地的管理策略因地域不同而具有一定差异性[2]。我国北方地区,特别是干旱半干旱地区草坪绿地管理的核心策略是灌溉[3],然而长期多频灌溉,往往会在土壤蒸发和草坪草蒸散作用的驱动下,促进土壤深层盐分向表层聚集,导致土壤表层盐分逐渐积累[4],因此,我国北方地区的草坪草往往生长在不同的盐生环境中,当土壤盐分浓度较低时,草坪草可通过调节自身的生理机制来维持草坪绿地的美观和生态功能,而当土壤盐分浓度过高时,草坪草则往往遭遇渗透胁迫和离子胁迫,从而影响草坪绿地的美观和生态功能[5]。所以,完善管理策略,是提高北方地区草坪草在盐生境下生长状态的重要科学问题。施肥能够提高植物在盐生境下的生长潜势[6],其中硅肥因其不污染环境[7],成为目前提高植物在盐生境下生长潜势的研究热点[8]。研究表明,添加硅能够提高玉米(Zeamays)[9]、黄瓜(Cucumissativus)[10]、黑果枸杞(Lyciumruthenicum)[11]等植物的耐盐性,从而增强植物在盐生境下的生长能力,主要原因是添加硅改进了植物的光合过程,譬如硅增加了小麦(Triticumaestivum)[12]、黄瓜[13]、黑麦草(Loliumperenne)[14]等植物的光合速率。
坪用高羊茅(Festucaarundinacea)是我国北方地区常用来建造草坪绿地的主要物种[15]。已有研究证实,硅能够增加坪用高羊茅品种红象在盐生境下的出苗率和保留率[8],主要是硅提高了该品种在盐生境下的抗氧化能力,增强了高羊茅品种红象的耐盐性[16]。高羊茅苗期对盐生境的反应要比成年植株敏感的多[17],因此,高羊茅幼苗对盐生环境的响应更能反映草坪绿地的建植成功与否[18]。高羊茅种子发芽高低是盐生境下建植高羊茅草坪绿地的关键节点,光合作用是幼苗积累干物质的主要途径,分析高羊茅在不同盐生境下种子发芽和光合特征,有助于解析高羊茅适应盐生环境的过程。然而,不同高羊茅品种其抗性存在差异[19],不同高羊茅品种适应盐生境的能力可能不同,虽然硅能够提高高羊茅品种红象的耐盐性,但硅对不同抗性的高羊茅品种是否具有同样的积极效应,仍需要科学实验提供证据。本研究以两种耐盐性不同的高羊茅品种为对象,采用盆栽试验研究硅对不同盐生境下两种高羊茅品种出苗率和幼苗光合特性的影响,以期为我国北方地区高羊茅草坪绿地的建植和管理提供科学依据。
1 材料与方法
1.1 试验设计
试验采用盆栽试验,三因素处理,分别为K31和XD高羊茅品种两个(XD抗性较强,K31抗性较弱)、盐浓度和硅。针对每个高羊茅品种,盐浓度分别设置为0、50、100、150、200、250、300 mmol·L-1,每个盐浓度下设置添加硅(+Si)和不添加硅(-Si)两个处理,每个品种共计有14个处理,整个试验为28个处理,每处理重复4次。试验于2015年5月20日在兰州大学智能日光温室内进行,采用高15 cm,盆口直径20 cm的塑料盆,每个花盆内播种饱满的高羊茅种子200粒,基质为珍珠岩和蛭石(体积比为1∶1)的混合基质。硅源采用硅酸钠。已有研究表明,盐生境下硅浓度为2 mmol·L-1时高羊茅种子发芽率和保苗率最高[1],因此,本研究中硅离子浓度设置为2 mmol·L-1。盐分采用氯化钠,计算盐分浓度时主要为硅酸钠内的钠离子。根据试验设计,在Hoagland营养液中添加相应的硅酸钠和氯化钠,配置成为处理溶液。隔日浇灌一次,盆底托盘有处理液渗出时为止。自播种当天开始,每天19:00时观察记录每个盆中的出苗情况,并将每株幼苗用彩色橡皮圈套住标记,记录出苗数,计数至每盆苗数连续7 d内出苗率变化不超过1株时,出苗调查结束,统计实际存活的幼苗数量。为避免植株过密的影响,21 d完全出苗后间苗,每盆保留长势一致、适中的幼苗30株继续培养,60 d时测定光合参数和生物量。
1.2 测定方法
1.2.1 出苗率和保苗率
出苗率=(盆内出苗数)/播种数×100%。
保苗率=(出苗结束时盆中的实际存活的幼苗数量)/(盆内出苗数)×100%。
1.2.2 光合特征的测定 光合特征采用Li-6400(美国)便携式光合作用测定仪,测定时间为09:00-11:00,每个处理随机选取具有代表性植株10株进行测量,测定其完全展开的倒数第二叶的光合参数。测定使光强约为400 μmol·(m2·s)-1,大气温度(25±1) ℃,大气CO2浓度变化范围为(430±10) μmol·L-1。
气孔限制百分率(Ls)=(1-Ci/Ca)×100%。
式中:Ca为环境CO2浓度(即仪器进气口的CO2浓度),Ci为胞间CO2浓度。
1.2.3 植物生物量的测定 光合特征测完后,收获每个塑料盆内的幼苗,用去离子水冲洗干净,将其置于105 ℃的烘箱杀青15 min,然后在75 ℃下烘干至恒量,称其干质量。
1.3 数据分析
数据采用SPSS19.0 软件进行三因素方差分析,采用LSD法检验不同数据组间的差异显著性,Duncan法进行多重差异性比较,结果用均值±标准差(Mean±SD)表示,数据制图采用Excel 2010软件。
2 结果与分析
2.1 出苗率和保苗率
盐浓度、硅添加、品种、盐浓度与品种互作和硅与盐浓度互作均显著影响了高羊茅种子的出苗率(P<0.05),但品种与硅互作以及盐浓度、硅和品种三者间互作的影响则不显著(P>0.05)(图1)。随盐浓度增加出苗率呈下降的趋势,其中盐浓度150 mmol·L-1时XD出苗率较不加盐处理显著降低,盐浓度100 mmol·L-1时K31出苗率显著降低(P<0.05)。在同一盐浓度下,当盐浓度介于50-200 mmol·L-1时,硅显著提高了XD的出苗率(P<0.05),增幅在7.68%~14.34%,其中在盐浓度200 mmol·L-1时,XD的出苗率从55.75%增至63.75%,提高了8个百分点;当盐浓度介于50-100 mmol·L-1时,硅显著提高了K31的出苗率(P<0.05),增幅在7.75%~11.84%。当盐浓度≤50 mmol·L-1和≥250 mmol·L-1时,XD出苗率与K31出苗率差异不显著,而盐浓度为100-200 mmol·L-1时,XD出苗率显著大于K31出苗率(P<0.05)。
盐浓度、硅添加、品种、盐浓度与品种互作和硅与盐浓度互作显著影响了高羊茅幼苗的保苗率(P<0.05),但品种与硅互作以及盐浓度、硅和品种三者间互作的影响则不显著(P>0.05)(图2)。保苗率随盐浓度增加呈降低趋势,其中盐浓度150 mmol·L-1时,XD保苗率较0、50和100 mmol·L-1盐浓度处理的显著降低;盐浓度100 mmol·L-1时,K31保苗率较0、50和100 mmol·L-1盐浓度处理的显著降低(P<0.05)。当盐浓度介于100-200 mmol·L-1时,硅添加显著提高了XD幼苗的保苗率(P<0.05),增幅在9.08%~13.39%。当盐浓度介于100-150 mmol·L-1时,硅添加显著提高了K31的保苗率(P<0.05),增幅在11.06%~13.31%。盐浓度≤50 mmol·L-1和≥250 mmol·L-1时,XD保苗率与K31保苗率无显著差异(P>0.05),而盐浓度为100-200 mmol·L-1时,XD保苗率显著大于K31保苗率(P<0.05)。
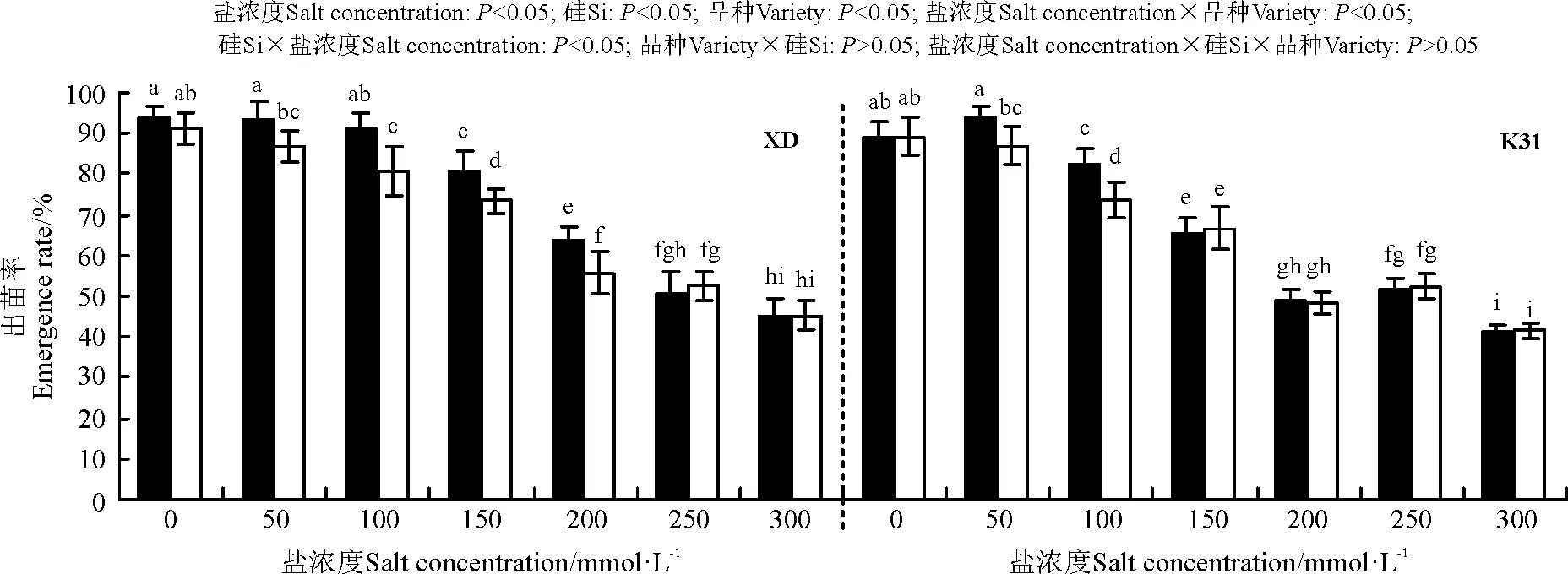
图1 不同盐浓度下硅添加对高羊茅出苗率的影响Fig. 1 Effect of the addition of silicon on the seedling rates of tall fescueunder different salt concentrations
注:不同小写字母表示不同处理间差异显著(P<0.05),下同。
Note: Different lowercase letters indicate significant difference among treatments at the 0.05 level; similarly for the following figures.
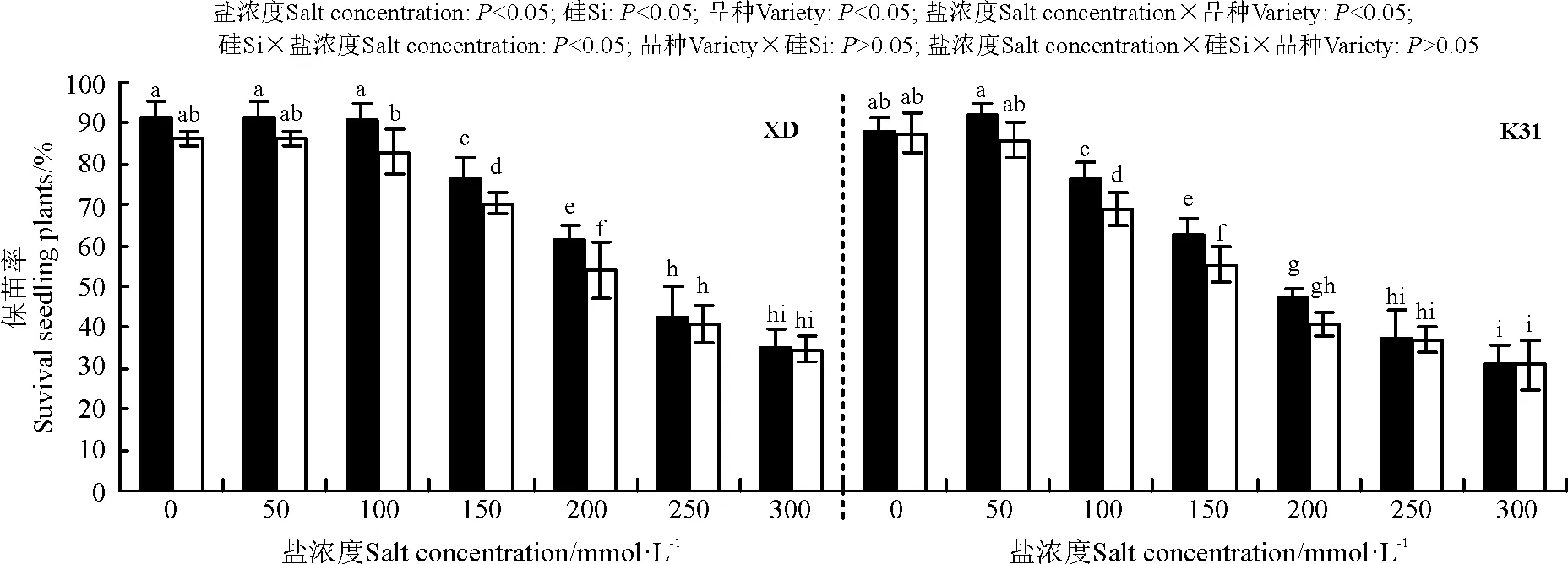
图2 不同盐浓度下硅对高羊茅保苗率的影响Fig. 2 Effect of the addition of silicon on survival seedling rate of tall fescue seedlings under different salt concentrations
2.2 不同盐浓度生境下硅对高羊茅幼苗生物量的影响
盐浓度、硅添加、品种、盐浓度与品种互作和硅与盐浓度互作均显著影响了高羊茅幼苗生物量(P<0.05),但品种与硅互作以及盐浓度、硅和品种三者间互作的影响则不显著(P>0.05)(图3)。无论添加硅与否,XD和K31的幼苗生物量均随盐浓度增加整体表现为降低趋势,其中盐浓度100 mmol·L-1时,XD和K31幼苗生物量较未加盐浓度均显著降低(P<0.05)。在同一浓度下,当盐浓度≤100 mmol·L-1时,硅显著增加了XD幼苗生物量(P<0.05),增幅在22.67%~30.08%;当盐浓度≤50 mmol·L-1时,硅显著增加了K31幼苗生物量(P<0.05),增幅在17.86%~28.43%。盐浓度≤50 mmol·L-1时,K31生物量显著大于XD,盐浓度在150-250 mmol·L-1范围内时,XD生物量显著大于K31(P<0.05),而盐浓度在100和300 mmol·L-1时添加Si处理XD和 K31的生物量无显著差异。
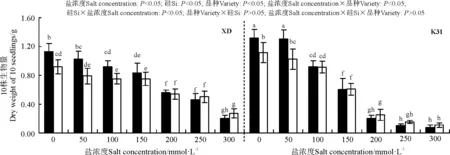
图3 不同盐浓度下硅对高羊茅幼苗生物量的影响Fig. 3 Effect of the addition of silicon on biomass of tall fescue seedlings under different salt concentrations
2.3 不同盐浓度下硅添加对高羊茅幼苗光合特性的影响
盐浓度、硅添加、品种、盐浓度与品种互作和硅与盐浓度互作均显著影响了两个高羊茅幼苗的净光合速率(Pn)、胞间CO2浓度(Ci)、气孔限制值(Ls)、气孔导度(Gs)和蒸腾速率(Tr)(P<0.05),但品种与硅互作以及盐浓度、硅和品种三者间互作的影响则不显著(P>0.05)(图4-8)。无论硅添加与否,XD和K31幼苗的Pn、Gs和Tr随着盐浓度的增加整体呈降低趋势,XD的Ci在盐浓度50 mmol·L-1时较未添加盐处理显著降低(P<0.05),之后随着盐浓度的增加而增加,整个过程呈先减小后增加的趋势;相反,XD的Ls在盐浓度50 mmol·L-1时较未添加盐处理显著增加(P<0.05),之后随着盐浓度的增加而降低,整个过程呈先增加后降低的趋势,而K31的Ls随着盐浓度的增加整体呈降低趋势。其中盐浓度为200 mmol·L-1时,XD的Pn、Gs显著降低;盐浓度为250 mmol·L-1时,XD的Tr显著降低;盐浓度为150 mmol·L-1时,K31的Pn、Gs显著降低(P<0.05),盐浓度为100 mmol·L-1时,K31的Tr显著降低(P<0.05)。当盐浓度≤100 mmol·L-1时,硅显著提高了XD的Pn(P<0.05),当盐浓度≤150 mmol·L-1时,硅添加显著提高了XD的Gs、Ls,降低Ci、Tr(P<0.05)。当盐浓度<50 mmol·L-1时,添加硅显著提高了K31的 Pn、Gs、Ls,降低了Ci、Tr(P<0.05)。当盐浓度<50 mmol·L-1时,K31幼苗的Pn、Gs、Tr显著大于XD(P<0.05),而盐浓度在100和300 mmol·L-1时,XD和K31的Pn、Gs、Tr差异不显著(P>0.05)。盐浓度150-250 mmol·L-1时,XD幼苗的Pn、Gs、Tr显著大于K31(P<0.05)。当盐浓度≤150 mmol·L-1时,K31的Ci显著大于XD(P<0.05),而盐浓度>150 mmol·L-1时,XD和K31的Ci无显著差异(P>0.05)。相反,当盐浓度≤150 mmol·L-1时,XD的Ls显著大于K31(P<0.05),而盐浓度>150 mmol·L-1时,XD和K31的Ls差异亦不显著。

图4 不同盐浓度下硅对高羊茅幼苗光合速率的影响Fig. 4 Effect of the addition of silicon on photosynthetic rate of tall fescue seedlings under different salt concentrations
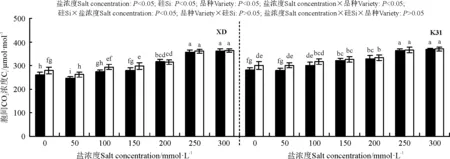
图5 不同盐浓度下硅对高羊茅幼苗胞间CO2浓度的影响Fig. 5 Effect of the addition of silicon on intercellular CO2 concentration of tall fescue seedlings under different salt concentrations
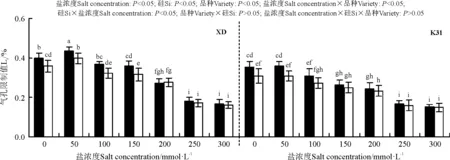
图6 不同盐浓度下硅对高羊茅幼苗气孔限制值的影响Fig. 6 Effect of the addition of silicon on stomatal limitation percentage of tall fescue seedlings under different salt concentrations

图7 不同盐浓度下硅对高羊茅幼苗气孔导度的影响Fig. 7 Effect of the addition of silicon on stomatal conductance of tall fescue seedlings under different salt concentrations
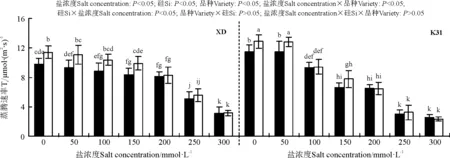
图8 不同盐浓度下硅对高羊茅幼苗蒸腾速率的影响Fig. 8 Effect of the addition of silicon on transpiration rate of tall fescue seedlings under different salt concentrations
3 讨论
3.1 不同盐浓度下硅添加对两个品种高羊茅种子出苗率和保苗率的影响
土壤次生盐渍化已成为严重影响我国北方地区植物生长的重要环境因素[20],草坪绿地长期灌溉势必造成土壤的次生盐渍化[21],而土壤盐渍化对草坪草苗期的伤害较成坪时更严重。本研究表明,XD和K31的出苗率和保苗率均随盐浓度增加整体呈降低趋势,主要是渗透效应和离子效应所致[22]。且其对相同盐浓度处理下的适应能力存在差异,盐浓度分别为150和100 mmol·L-1时,XD和K31出苗率和保苗率显著降低,说明XD和K31种子发芽过程和成活过程对相同盐浓度敏感性存在差异,以及盐浓度对植物种子的抑制程度与盐的浓度、种类及植物抗盐能力有关,这与对不同羊茅属种子对不同盐浓度的萌发研究结果趋同,不同种间存在的这种耐盐性差异,可能是羊茅属不同品种生物学习性差异所致[19]。但XD的出苗率和保苗率分别在盐浓度为150-200和100-200 mmol·L-1时大于K31,说明盐浓度较高时抗性强品种XD种子发芽以及幼苗成活率较大。然而,硅对不同耐盐性高羊茅品种出苗率和保苗率的影响并不一致,硅添加分别在盐浓度为50-200和50-100 mmol·L-1时显著增加了XD和K31出苗率,说明添加硅后抗盐性强的品种XD硅强化忍受盐浓度的范围要比抗盐性弱K31忍受盐浓度范围要大。硅添加在一定盐浓度范围内提高高羊茅种子出芽率,这在冰草(Agropyroncristatum)[23]、 甘草(Glycyrrhizauralensis)[24]、水稻(Oryzasativa)[25]等植物上得到了佐证。而且在相同盐浓度处理下,硅增加XD和K31出苗率的幅度存在差异,说明硅与不同抗性高羊茅品种的亲和力不同,这与对水稻[25]种子的研究结果是一致的。在盐浓度为200 mmol·L-1时,硅添加处理使XD的出苗率大于60%,则认为此处理有助于XD有效建植草坪绿地[26]。盐生境下加硅提高高羊茅的出苗率,就其原因可能是在盐胁迫下,硅对两品种种子起到了活化作用,通过促进种子吸水,使种子内部贮藏的α-淀粉酶的活性来促进种子萌发,缓解盐对种子萌发的抑制作用[27]。
在不同盐浓度处理下加硅显著增加了XD和K31保苗率,但盐浓度范围存在差异,对应浓度范围分别为100-200和100-150 mmol·L-1,而且各自的增加幅度也不同,说明硅添加能够提高高羊茅的保苗率,这与刘慧霞等[8]对高羊茅的研究趋同。可能原因是盐胁迫下,硅显著改善其幼苗细胞壁水解酶的活性平衡,组分含量的均衡及细胞壁内外溶质的适应性分配,从而为幼苗的较好生长提供了一个较适宜生长的环境[28]。而两个高羊茅品种种子和幼苗对硅的敏感性差异,可能是二者对盐浓度的承受能力存在一定的分异所致。
3.2 不同盐浓度下硅添加对两个高羊茅品种生物量的影响
植物生物量是综合响应盐胁迫的直观体现[29],本研究表明,XD和K31幼苗生物量对盐的响应具有一致性,表现为随盐浓度增加整体呈降低趋势,这与樊瑞苹等[30]对在不同盐浓度处理下的高羊茅生物量对盐的响应趋同。然而在不同盐生境下,两个高羊茅品种幼苗对硅的敏感性存在差异,在盐浓度0-100 mmol·L-1和0-50 mmol·L-1范围内,硅分别显著提高了XD和K31幼苗生物量,说明添加硅能够提高两个高羊茅幼苗生物量,增强两个高羊茅品种幼苗适应盐生境的能力,这趋同于玉米[9]、草地早熟禾(Poapratensis)[31]、金丝小枣(Zizyphusjujuba)[32]等在盐胁迫下对硅的响应,也说明了添加硅XD耐盐浓度范围大于K31,而且添加硅XD生物量大于K31,XD和K31对不同盐浓度下对硅的这种差异,在不同品种的甜瓜(Cucumismelo)[26]、水稻[33]、小麦[12]上也得到了佐证。盐胁迫下,硅能提高高羊茅生物量可能是硅添加能促进植物根系生长、增加根系活力、改善通气组织和根部的氧化能力,提高了高羊茅对水分和养分的吸收量,进而有助于植株挺拔,促进了叶片伸长,减少了叶片间的相互遮阴,提高了植株的光合效率,从而提高了高羊茅的生物量[33]。
3.3 不同盐浓度下硅添加对两个品种高羊茅光合特征的影响
光合作用是植物自身合成有机物质的主要途径,而影响因素却是多方面的。植物在盐胁迫下,生长会受到抑制,通常这与光合效率的下降密切相关[34],并且光合作用的变化取决于盐害的胁迫程度以及植物品种的差异[35]。盐胁迫大多会引起叶片水势及气孔导度的降低,限制CO2到达光合机构,从而抑制光合作用[36]。本研究表明,盐浓度在0-50 mmol·L-1范围内,XD的Gs和Ci同时减小,且Ls增大,说明此范围内XD光合作用的降低主要是由气孔限制所致,盐浓度>50 mmol·L-1时,XD的Gs和Ls同时减小,Ci增大,这与K31在不同盐浓度下的Gs、Ls、Ci趋势相同,说明此范围内非气孔限制是导致光合作用下降的主要原因[37]。而硅添加在一定盐浓度范围内显著提高了XD和K31叶片光合速率,改善了气孔导度,降低蒸腾速率和胞间CO2浓度,缓解了盐害对光合作用的抑制。这与盐胁迫下硅对小麦[12]、黄瓜[13]和黑麦草[14]的研究结果趋同。硅添加均能缓解气孔因素和非气孔因素对两个高羊茅品种光合能力的限制。究其原因可能分别是促进了叶片气孔的张开,促进了CO2向叶绿体的运输,进而提高植物光合作用[38]和叶肉细胞对气孔扩散的阻抗减小、增加CO2溶解度以及Rubisco酶对CO2的亲和力,提高了RuBP再生能力,以及增加了光合机构关键成分的稳定性[39];在同一盐生境下,0-100 mmol·L-1时,硅添加提高了XD的Pn、Gs和Ls,降低Ci和Tr,而盐浓度为0-50 mmol·L-1时,硅添加提高了K31的Pn和Gs以,降低了Tr,说明两个高羊茅品种在盐生境下对硅的敏感性存在一定的差异,这种差异可能与高羊茅本身的耐盐性强弱有关。综上所述,硅对高羊茅在盐生境下的影响既表现在建制方面,又表现在光合调节方面,这说明添加硅对高羊茅生长的影响不仅与盐浓度密切相关,而且与品种自身抗性密切相关。
References:
[1] 刘慧霞,王康英,郭兴华.不同土壤水分条件下硅对坪用高羊茅种子出苗及生物学特性的影响.草业学报,2012,21(1):199-205. Liu H X,Wang K Y,Guo X H.Effect of addition of silicon on seed emergence and growth of tall fescue (Festucaarundinacea) under the different soil moistures.Acta Prataculturae Sinica,2012,21(1):199-205.(in Chinese)
[2] 余高镜,林奇田,柯庆明,吴福荣,林文雄.草坪型高羊茅的研究进展与展望.草业科学,2005,22(7):77-82. Yu G J,Lin Q T,Ke Q M,Wu F R,Lin W X.Progress and prospects of tall fescue turfgrass.Pratacultural Science,2005,22(7):77-82.(in Chinese)
[3] 杨景辉,王艳荣,苏敏,赵文丽,刘子夜.三种草坪草对土壤水分利用特征的比较研究.中国草地学报,2012,34(6):44-48. Yang J H,Wang Y R,Su M,Zhao W L,Liu Z Y.Comprehensive research of soil moisture utilization characteristics ofFestucaovinaL.,KoeleriacristataL. andPoapratensisunder long-term soil drought.Chinese Journal of Grassland,2012,34(6):44-48.(in Chinese)
[4] Flowers T J.Improving crop salt tolerance.Journal of Experimental Botany,2004,55:307-319.
[5] 徐海鹏,李慧萍,金小煜,金宁,牛奎举,马晖玲.草地早熟禾愈伤组织对NaCl胁迫的生理响应.草业科学,2016,33(1):86-92. Xu H P,Li H P,Jin X Y,Jin N,Niu K J,Ma H L.Physiological response of Kentucky bluegrass calli under NaCl treatment.Pratacultural Science,2016,33(1):86-92.(in Chinese)
[6] 张永亮,王学愿,刘杨,程铭.盐胁迫下氮磷钾肥对虉草离子吸收与分布的影响.草地学报,2014,22(6):1318-1323. Zhang Y L,Wang X Y,Liu Y,Cheng M.Effects of different NPK fertilizer rates on the ion absorption and distribution of reed canarygrass (Phalarisarundinacea) under salt stress.Acta Agrestia Sinica,2014,22(6):1318-1323.(in Chinese)
[7] 郭正刚,田福平,王锁民,张自和.硅对紫花苜蓿生物学特性的影响.生态学报,2006,26(10):3303-3307. Guo Z G,Tian F P,Wang S M,Zhang Z H.Effect of silicon supply on alfalfa growth.Acta Ecologica Sinica,2006,26(10):3303-3307.(in Chinese)
[8] 刘慧霞,郭兴华,郭正刚.盐生境下硅对坪用高羊茅生物学特性的影响.生态学报,2011,31(23):7039-7046. Liu H X,Guo X H,Guo Z G.Effect of silicon supply on tall fescue (Festucaarundinacea) growth under the salinization conditions.Acta Ecologica Sinica,2011,31(23):7039-7046.(in Chinese)
[9] 李佐同,高聚林,王玉凤,杨克军.硅对NaCl胁迫下玉米幼苗生理特性的影响.玉米科学,2011,19(2):73-76. Li Z T,Gao J L,Wang Y F,Yang K J.Effect of silicon on protective enzymes actives physiological characteristics of maize seedling under salt stress.Journal of Maize Sciences,2011,19(2):73-76.(in Chinese)
[10] 王喜艳,张玉龙,张恒明,冯燕,佟倩,虞娜.盐胁迫下硅对黄瓜保护酶活性和膜质过氧化物的影响.西北农业学报,2009,18(1):221-224. Wang X Y,Zhang Y L,Zhang H M,Feng Y,Tong Q,Yu N.Influence of silicon on activities of protective enzymes and MDA content in cucumber under salt stress soil.Acta Agriculturae Boreali-occidentalis Sinica,2009,18(1):221-224.(in Chinese)
[11] 沈慧,米永伟,王龙强.外源硅对盐胁迫下黑果枸杞幼苗生理特性的影响.草地学报,2012,20(3):553-558. Shen H,Mi Y W,Wang L Q.Effect of exogenous silicon on physiological characteristics ofLyciumruthenicumseedling under salt stress.Acta Agrestia Sinica,2012,20(3):553-558.(in Chinese)
[12] 郑世英,郑芳,徐建,潘恩敬,耿建芬,李东臣.外源硅对NaCl胁迫下小麦幼苗生长及光合特性的影响.麦类作物学报,2015,35(1):111-115. Zheng S Y,Zheng F,Xu J,Pan E J,Geng J F,Li D C.Effect of silicon on the biomass and photosynthetic characteristics of wheat seedlings under NaCl stress.Journal of Triticeae Crops,2015,35(1):111-115.(in Chinese)
[13] 陈罡,樊平声,冯伟民,管安琴,卢昱宇,万云龙.外源硅对盐胁迫下黄瓜幼苗生长和光合荧光特性的影响.江苏农业学报,2014,30(6):1402-1409. Chen G,Fan P S,Feng W M,Guan A Q,Lu Y Y,Wan Y L.Effects of exogenous silicon on growth and characteristics of photosynthesis and chlorophyll fluorescence in cucumber seedlings under salt stress.Jiangsu Journal of Agricultural Sciences,2014,30(6):1402-1409.(in Chinese)
[14] 刘建新,胡浩斌,王鑫.硅对盐胁迫下黑麦草幼苗活性氧代谢和光合参数的影响.中国草地学报,2008,30(5):25-31. Liu J X,Hu H B,Wang X.Effects of exogenous silicon on active oxygen metabolism and photosynthetic parameters ofLoliumperenneL. seedlings under salt stress.Chinese Journal of Grassland,2008,30(5):25-31.(in Chinese)
[15] 彭燕,张新全,周寿荣.草坪草利用及引种适应性研究.草原与草坪,2004(4):12-16. Peng Y,Zhang X Q,Zhou S R.Review of research work on application and adaptability of introduced turfgrass.Grassland and Turf,2004(4):12-16.(in Chinese)
[16] 宋锐,林丽果,王康英,宋浩然,蒋勇斌,刘慧霞.不同盐生境下硅对高羊茅生物量及生理生化特征的影响.草业科学,2016,25(8):91-97. Song R,Lin L G,Wang K Y,Song H R,Jiang Y B,Liu H X.Effect of silicon supply on biomass and physiochemical features of tall fescue seedlings under the different salinization conditions.Pratacultural Science,2016,25(8):91-97.(in Chinese)
[17] Chai Q,Guo Z G,Ren J Z,Nan Z B.Assessment of drought resistance of Kentucky bluegrass (Poapratensis) varieties at seedling stage.New Zealand Journal of Crop and Horticultural Science,2006,34:319-328.
[18] Beard J B.Easy steps in turfgrass establishment and care for aesthetic and recreational purposes including sports fields.How to Have A Beautiful Lawn.5th edition.Beard Books,Texas,1993:3-27.
[19] 刘欣,柴琦,刘照辉.高羊茅属4个品种萌发期耐盐能力的研究.草业科学,2012,29(5):694-698. Liu X,Chai Q,Liu Z H.Evaluation of salt tolerance of fourFestucaarundinaceavarieties during seed germination stage.Pratacultural Science,2012,29(5):694-698.(in Chinese)
[20] 杨劲松.中国盐渍土研究的发展历程与展望.土壤学报,2008,45(5):834-845. Yang J S.Development and prospect of the research on salt-affected soils in China.Acta Pedologica Sinica,2008,45(5):834-845.(in Chinese)
[21] 缑倩倩,韩致文,王国华.中国西北干旱区灌区土壤盐渍化问题研究进展.中国农学通报,2011,27(29):246-250. Gou Q Q,Han Z W,Wang G H.Research progress on soil salinization in arid irrigated area of northwestern China.Chinese Agricultural Science Bulletin,2011,27(29):246-250.(in Chinese)
[22] 朱义,谭贵娥,何池全,崔心红,张群.盐胁迫对高羊茅幼苗生长和离子分布的影响.生态学报,2007,27(12):5447-5454. Zhu Y,Tan G E,He C Q,Cui X H,Zhang Q.Effect of salinization on growth and ion homeostasis in seedlings ofFestucaarundinacea.Acta Ecologica Sinica,2007,27(12):5447-5454.(in Chinese)
[23] 张一弓,王玉,刘梦,杨淑君,张荟荟.碱胁迫下硅促进冰草种子萌发.草业科学,2015,32(7):1093-1098. Zhang Y G,Wang Y,Liu M,Yang S J,Zhang H H.Effect of silicon onAgropyroncristatumseed germination under alkaline stress.Pratacultural Science,2015,32(7):1093-1098.(in Chinese)
[24] 张新慧,郎多勇,白长财,周丽,高晓娟,董琳,李明.外源硅对不同程度盐胁迫下甘草种子萌发和幼苗生长发育的影响.中草药,2014,45(14):2075-2079. Zhang X H,Lang D Y,Bai C C,Zhou L,Gao X J,Dong L,Li M.Effects of silicon addition on seed germination and seedling growth ofGlvarrhizauralensisunder salt stress.Chinese Traditonal Drug,2014,45(14):2075-2079.(in Chinese)
[25] 张文强,黄益宗,招礼军,曹慧明.盐胁迫下外源硅对硅突变体与野生型水稻种子萌发的影响.生态毒理学报,2009,4(6):867-873. Zhang W Q,Huang Y Z,Zhao L J,Cao H M.Effects of silicon on the germination of Si mutant rice and wild rice seeds under salt stress.Asian Journal of Ecotoxicology,2009,4(6):867-873.(in Chinese)
[26] 周鑫,张树宝.草坪建植与养护.郑州:黄河水利出版社,2010. Zhou X,Zhang S B.Planting and Maintenance of Lawn.Zhengzhou:The Yellow River Water Conservancy Press,2010.(in Chinese)
[27] 王玉萍,王映霞,白向利,王小青,张峰.硅对NaCl胁迫下甜瓜种子萌发及幼苗生长的影响.草业学报,2015,24(5):108-116. Wang Y P,Wang Y X,Bai X L,Wang X Q,Zhang F.Effects of exogenous silicon on melon seed germination and the growth of seedlings under NaCl stress.Acta Prataculturae Sinica,2015,24(5):108-116.(in Chinese)
[28] 徐呈祥,徐锡增,马艳萍,尚旭岚.硅对盐胁迫下枣树组织培养苗细胞壁形成和相关酶活性的影响.植物生理学报,2011,47(11):1096-1102. Xu C X,Xu X Z,Ma Y P,Shang X L.Effects of silicon on cell wall formation and related enzyme activity of tissue cultured plantlets of Chinese jujube (ZiziphusjujubaMill.) under salt stress.Acta Phytophysiologica Sinica,2011,47(11):1096-1102.(in Chinese)
[29] Sairam R K,Rao K V,Srivastava G C.Differential response of wheat genotypes to long term salinity stress in relation to oxidative stress,antioxidant activity and osmolyte concentration.Plant Science,2002,163(5):1037-1046.
[30] 樊瑞苹,周琴,周波,江海东.盐胁迫对高羊茅生长及抗氧化系统的影响.草业学报,2012,21(1):112-117. Fan R P,Zhao Q,Zhou B,Jiang H D.Ffects of salinization stress on growth and the antioxidant system of tall fescue.Acta Prataculturae Sinica,2012,21(1):112-117.(in Chinese)
[31] 王耀晶,王厚鑫,刘鸣达.盐胁迫下硅对草地早熟禾生理特性的影响.中国草地学报,2012,34(6):13-17. Wang Y J,Wang H X,Liu M D.Effect of silicon on physiological characteristics of Kentucky bluegrass under salt stress.Chinese Journal of Grassland,2012,34(6):13-17.(in Chinese)
[32] 徐呈祥,马艳萍,胡恒康,徐锡增.硅对盐胁迫下金丝小枣生长与生理的效应.西北农林科技大学学报:自然科学版,2005,33(5):142-146. Xu C X,Ma Y P,Hu H K,Xu X Z.Effects of silicon on growth and physiological status ofZizyphusjujubacv. Jinsi-xiaozao under salt stress.Journal of Northwest A & F University:Natural Science Edition,2005,33(5):142-146.(in Chinese)
[33] 黄益宗,张文强,招礼军,曹慧明.Si对盐胁迫下水稻根系活力、丙二醛和营养元素含量的影响.生态毒理学报,2009,4(6):860-866. Huang Y Z,Zhang W Q,Zhao L J,Cao H M.Effects of Si on the index of root activity,MDA content and nutritional elements uptake of rice under salt stress.Asian Journal of Ecotoxicology,2009,4(6):860-866.(in Chinese)
[34] Subrahmanyam D.Effects of chromium toxicity on leaf photosynthetic characteristics and oxidative changes in wheat (TriticumaestivumL.).Photosynthetica,2008,46(3):339-345.
[35] Megdiche W,Hessini K,Gharbi F,Jaleel C A,Ksouri R,Abdelly C.Photosynthesis and photosystem 2 efficiency of two salt-adapted halophytic seashore Cakile maritima ecotypes.Photosynthetica,2008,46(3):410-419.
[36] Delfine S,Alvino A,Concet T,Avillani M,Loreto F.Restrictions to carbon dioxide conductance and photosynthesis in spinach leaves recovering from salt stress.Plant Physiology,1999,119:1101-1106.
[37] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis.Annual Review of Plant Physiology,1982,33:317-345.
[38] 王伟华,张希明,闫海龙,梁少民,马建兵,杨小林.盐水处理对沙拐枣气体交换特征 、光合色素和可溶性糖含量的影响.干旱区地理,2009,32(4):598-603. Wang W H,Zhang X M,Yan H L,Liang S M,Ma J B,Yang X L.Effects of salt water treatments on gas exchance characteristics,photosynthetic pigment and soluble sugar content ofCalligonumspp. at different times.Arid Land Geography,2009,32(4):597-603.(in Chinese).
[39] 许大全.气孔的不均匀关闭与光合作用的非气孔限制.植物生理学通讯,1995,31(4):246-252. Xu D Q.Non-uniform stomatal closure and non-stomatal limitation of photosynthesis.Plant Physiology Communications,1995,31(4):246-252(in Chinese)
(责任编辑 武艳培)
Effect of silicon supply on growth and photosynthetic characteristics of tall fescue seedlings under different salt concentrations conditions
Lin Li-guo, Song Rui, Lin Xuan-dong, Jiang Yong-bin, Liu Hui-Xia
(College of Life Science and Engineering, Northwest University for Nationalities, Lanzhou 730030, China)
Tall fescue(Festucaarundinacea) frequently grows in saline soil, or in soil with a high potential for salinization due to long-term and frequent irrigation. A pot experiment was conducted to investigate the effect of Si on seed germination, biomass, and photosynthetic characteristics in stage two tall fescue seedlings under different salinization conditions. The results showed that seed germination, biomass, and photosynthetic characteristics of the seedlings was significantly affected by salt concentration, variety, silicon supply, interactions between salinization conditions and species, and interactions between silicon supply and salt concentrations. The seedling rate, the seedling survival rate, biomass, photosynthetic rate (Pn), transpiration rate (Tr), stomatal conductance (Gs), and stomatal limitation percentage (Ls) of K31 and XD tended to decrease with increase in salinity. Intercellular CO2concentration (Ci) tended to increase with increase in salinity. Silicon significantly increased the seedling rate of XD and K31 and seedling survival rate and seedling biomass. Pn, Gs, and Lsdecreased Ciand Trunder salinization conditions (P<0.05). The sensitivity of XD and K31 to silicon differed under the same salinization conditions. This indicated that the effects of silicon supply on tall fescue growth in saline conditions are closely related to resistance.
tall fescue; salinization conditions; silicon; seed germination; biomass; photosynthetic characteristics
Liu Hui-xia E-mail:liuhuixia2@aliyun.com
2016-08-08 接受日期:2016-09-01
国家自然科学基金项目——硅提高高羊茅耐盐性的生理生态机制研究(31360581);中央高校基本科研业务费项目(31920170031);西北民族大学研究生科研创新项目(Yxm2015204);西北民族大学本科生众创空间项目;西北民族大学创新团队计划项目
林丽果(1988-),男,甘肃岷县人,在读硕士生,研究方向为饲草料资源与生态修复的研究。E-mail:274414832@qq.com
刘慧霞(1974-),女,甘肃靖远人,教授,博士,研究方向为植物硅营养学的研究。E-mail:liuhuixia2@aliyun.com
10.11829/j.issn.1001-0629.2016-0411
S543+.903.4;Q945.11
A
1001-0629(2017)07-1442-10
林丽果,宋锐,林选栋,蒋勇斌,刘慧霞.不同盐浓度下硅对高羊茅苗期生长及光合特征的影响.草业科学,2017,34(7):1442-1451.
Lin L G,Song R,Lin X D,Jiang Y B,Liu H X.Effect of silicon supply on growth and photosynthetic characteristics of tall fescue seedlings under different salt concentrations conditions.Pratacultural Science,2017,34(7):1442-1451.
