汉黄芩素体外抗人喉癌Hep2细胞增殖、凋亡和侵袭的作用及机制研究
2016-04-26凌丹许磊杨光东庹红莲邓华燕胡振宇
凌丹 许磊 杨光东 庹红莲 邓华燕 胡振宇
442600 湖北省郧西县人民医院耳鼻咽喉科(凌丹、杨光东、庹红莲、邓华燕、胡振宇),神经内科(许磊)
·论著·
汉黄芩素体外抗人喉癌Hep2细胞增殖、凋亡和侵袭的作用及机制研究
凌丹许磊杨光东庹红莲邓华燕胡振宇
442600湖北省郧西县人民医院耳鼻咽喉科(凌丹、杨光东、庹红莲、邓华燕、胡振宇),神经内科(许磊)
【摘要】目的研究汉黄芩素对人喉癌Hep-2细胞增殖、凋亡及侵袭能力的影响,并探讨其作用机制。方法运用CCK-8检测汉黄芩素对人喉癌Hep-2细胞增殖活性的影响。运用流式细胞仪检测汉黄芩素对人喉癌Hep-2细胞凋亡的影响。运用Hoechst染色法检测汉黄芩素对人喉癌Hep-2细胞核形态变化的影响。运用transwell侵袭实验比较汉黄芩素对人喉癌Hep-2细胞侵袭能力的影响。运用Western blot检测汉黄芩素对人喉癌Hep-2细胞hTERT、Bcl-2、Bax蛋白表达水平的影响。结果CCK-8法发现汉黄芩素能抑制人喉癌Hep-2细胞增殖,其作用呈浓度依赖性。流式细胞术分析发现汉黄芩素能诱导人喉癌Hep-2细胞发生凋亡。Hoechst染色发现汉黄芩素能诱导人喉癌Hep-2细胞核形态变化。Transwell实验发现汉黄芩素能抑制人喉癌Hep-2细胞的体外侵袭能力。Western blot检测发现测汉黄芩素能有效降低人喉癌Hep-2细胞hTERT、Bcl-2蛋白表达水平以及增加Bax蛋白表达水平(P<0.05)。结论汉黄芩素在体外能够有效抑制人喉癌Hep-2细胞增殖,诱导细胞凋亡,同时抑制喉癌细胞的体外侵袭能力。其作用可能与调控Bcl-2蛋白家族及hTERT蛋白表达水平相关。
【关键词】汉黄芩素;喉癌;Hep-2细胞;抗肿瘤作用
喉癌是耳鼻喉科最常见的恶性肿瘤之一,发病率约占所有头颈部肿瘤的28%[1]。近年来我国喉癌的发病率呈现明显上升趋势[2]。目前针对喉癌患者的治疗,主要是手术为主、放化疗联合的综合治疗方案,尽管治疗方法不断改进,喉癌患者的五年生存率和生存质量仍然不容乐观。因此,探索新的治疗途径,对改善喉癌的治疗现状显得尤为重要。中草药提取物中的有效成分可在体内外发挥显著的抗肿瘤作用。汉黄芩素(wogonin)是从唇形科植物黄芩根部提取的一种单体成分,属于黄酮类化合物。既往研究报道汉黄芩素具有显著的抗肿瘤、免疫增强、抗氧化、抗病毒、保护心脑血管等广泛的药理作用[3,4]。汉黄芩素在肺癌、脑胶质瘤和胃肠道肿瘤等多种肿瘤中均能发挥良好的体内外抗癌作用,其抗肿瘤的机制主要包括抑制细胞核内基因转录、诱导细胞周期阻滞、抑制肿瘤新生血管生成等[5-7],但是关于其确切的机制尚未完全研究清楚。笔者目前尚未发现国内外关于汉黄芩素在喉癌中作用的报道。本研究旨在探讨汉黄芩素对人喉癌Hep-2细胞增殖、凋亡和侵袭能力的作用并探讨其作用机制,以期为汉黄芩素在喉癌治疗的研发应用提供实验室数据。
1材料与方法
1.1仪器与试剂酶标仪购自美国Perkin Elmer公司,流式细胞仪购自美国B.D公司,倒置显微镜购自日本Olympus公司,CCK-8试剂盒购自日本dojindo公司,AnnexinV-PI细胞凋亡检测试剂盒购自杭州联科生物技术公司,Hoechst 33258荧光染色试剂盒购自杭州碧云天生物技术公司,人工重组基底膜Matrigel胶和Tanswell Chamber、RPMI-1640 培养基、胎牛血清均购自美国Sigma 公司。汉黄芩素由上海融禾公司提供,纯度为99%,用磷酸盐缓冲液(PBS)溶解。
1.2方法
1.2.1细胞培养:人喉癌Hep-2细胞株来源于中国科学院典型培养物保藏委员会细胞库。Hep-2细胞常规培养于RPMI 1640+10%FBS的培养液中,置于37℃、5% CO2饱和湿度环境条件下进行培养。当Hep-2细胞处于对数生长期时,取出进行实验。
1.2.2Cck-8法检测细胞增殖能力变化:取对数生长期的Hep-2细胞接种于96孔板,接种量3 000个/孔,常规培养12 h待细胞贴壁后,吸去原培养液,加入含汉黄芩素培养液(各组对应浓度分别为0 μmol/L、20 μmol/L、50 μmol/L、100 μmol/L)。每组平行设4个复孔,另设空白对照组。在加入含药物培养基后的0、24、48、72 h,分别在待检测孔中加入CCK-8检测液10 μl/孔,37℃避光孵育1 h,使用酶标仪检测各组在450 nm波长的吸光度数值;以处理时间为横坐标,吸光度OD值为纵坐标,绘制各处理组的增殖曲线并计算各组的增殖抑制率。
1.2.3流式细胞仪检测细胞凋亡率:选择对数生长期的喉癌Hep-2细胞,将细胞随机分为4组:空白组(0 μmol/L组):于培养基中加入与药物处理组等体积的PBS;药物组:分别给予不同浓度的汉黄芩素(50 μmol/L、100 μmol/L)处理喉癌Hep-2细胞。待处理48 h后,将各组细胞用胰酶消化,PBS洗涤,以1×Binding Buffer 500 μl混悬制作单细胞悬液,各组细胞量约1×105个。所收集单细胞悬液经AnnexinV-PI染色后,采用流式细胞仪进行细胞凋亡率检测。
1.2.4Hoechst 33258染色:选择对数生长期的喉癌Hep-2细胞,同前实验分为3组。待处理48 h后,使用巴氏吸管吸去各孔内培养液,PBS冲洗,摇床上慢摇5 min,冲洗完毕后吸尽培养孔内液体,各孔内加入Hoechst 33342 荧光染料200 μl,室温孵育20 min。使用倒置荧光显微镜拍照观察,计数发生核固缩及核碎裂细胞核所占比率。
1.2.5Transwell法检测细胞侵袭能力变化:将终浓度为200 μg/ml的Matrigel胶,每孔50 μl铺在Transwell板上室,置于超净台过夜风干;取对数生长期的Hep-2细胞,以无血清培养液重悬,制作细胞浓度为5×104/L的细胞悬液。将上述细胞悬液按每孔100 μl加入transwell上室,各组细胞中分别加入不同浓度的药物至汉黄芩素终浓度为0 μmol/L、50 μmol/L、100 μmol/L;将含10%血清的培养液500 μl加入下室;48 h后,弃去培养液并取出小室,拭去粘附在上室的细胞;结晶紫染色,倒置显微镜计数穿膜细胞数,以穿膜的细胞平均数代表细胞的侵袭能力。
1.2.6Western Blot检测蛋白表达变化:将处于对数生长期的Hep-2细胞中加入0 μmol/L、50 μmol/L、100 μmol/L的汉黄芩素,处理48 h后,弃去培养液, PBS洗涤3次,用配好的蛋白裂解液冰上裂解细胞30 min。离心收集上清,用BCA法测定蛋白浓度。配置SDS-PAGE凝胶,根据蛋白浓度,计算30 μg蛋白的上样体积。使用电泳仪接通电源,经过浓缩胶和分离胶,直至样品和溴酚蓝到达分离胶底部;使用PVDF膜200 mA转膜2 h,5%的脱脂奶粉的封闭液封闭1 h;加入稀释好的一抗,4℃摇床孵育过夜;洗涤一抗后,在避光孵育盒中继续孵育二抗。孵育完毕后应用Odyssey激光成像系统扫描图像,软件半定量分析条带显影。
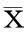
2结果
2.1汉黄芩素对Hep-2细胞增殖能力的影响通过CCK-8法检测不同浓度汉黄芩素(0 μmol/L、20 μmol/L、50 μmol/L、100 μmol/L)对Hep-2细胞增殖能力的影响,结果发现,随着汉黄芩素的浓度升高,Hep-2细胞的增殖能力显著降低,呈浓度依赖性。其中以100 μmol/L浓度时增殖抑制效果最为显著,生长抑制率接近50%。同时,随着药物作用时间增加,各药物组细胞生长抑制率显著下降;上述结果说明汉黄芩素抑制喉癌Hep-2细胞增殖能力,其作用具有一定的浓度和时间依赖性。见图1。
2.2汉黄芩素对Hep-2细胞凋亡率的影响采用流式细胞仪检测不同浓度汉黄芩素(0 μmol/L、50 μmol/L、100 μmol/L)作用后Hep-2细胞凋亡率变化,结果发现,随着汉黄芩素的浓度升高,Hep-2细胞的凋亡率显著升高,包括早期凋亡和晚期凋亡,其结果呈现出浓度依赖性。见图2。
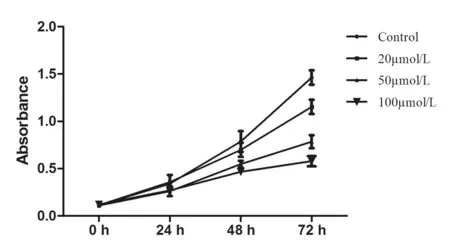
图1 CCK-8法检测不同浓度汉黄芩素对细胞增殖能力的影响
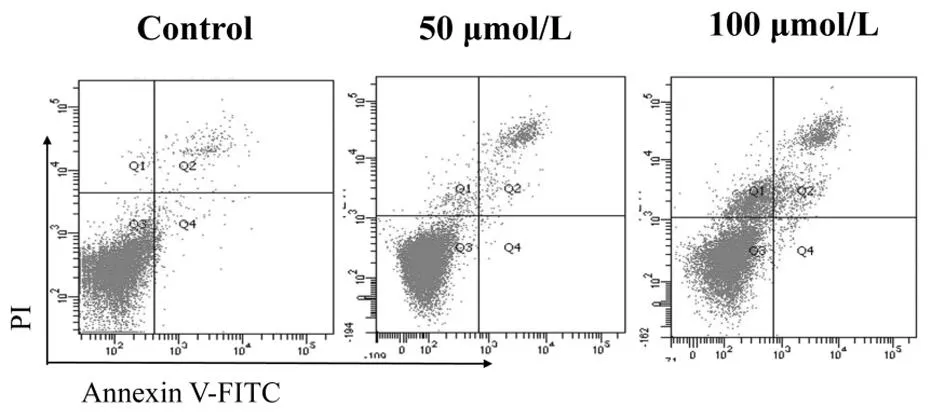
图2 流式细胞仪检测不同浓度汉黄芩素对细胞凋亡率的影响
2.3汉黄芩素对Hep-2细胞核形态学变化的影响采用Hoechst 33258 荧光染色法检测不同浓度汉黄芩素对Hep-2细胞核形态变化的影响。处理48 h后,实验结果发现,与阴性对照组比较,50 μmol/L和100 μmol/L 汉黄芩素处理组Hep-2细胞核细胞数减少,可见核固缩、核碎裂细胞核所占比例显著增加。应用单因素方差统计分析各组凋亡细胞所占比率,发现药物组相比对照组,差异有统计学意义(P<0.05),进一步证明了汉黄芩素的促凋亡作用。见图3。

图3Hoechst 33258染色法检测不同浓度汉黄芩素对细胞核形态学变化的影响(免疫组化×400)
2.4汉黄芩素对Hep-2细胞体外侵袭能力的影响Transwell侵袭实验通过模拟人体内基质膜结构的微环境,可系统评价肿瘤细胞的体外侵袭能力。该实验结果发现,随着汉黄芩素浓度的增加,穿过聚碳酸酯滤膜的细胞数量显著减少,与对照组比较,差异有统计学意义(P<0.05)。说明汉黄芩素可以显著降低Hep-2细胞的体外侵袭能力。见图4。
2.5汉黄芩素对hTERT、Bcl-2、Bax蛋白的表达水平的影响Western blot法检测不同浓度汉黄芩素(0 μmol/L、50 μmol/L、100 μmol/L)对Hep-2细胞hTERT、Bcl-2、Bax蛋白表达的影响,结果发现汉黄芩素可显著降低hTERT和Bcl-2蛋白的表达水平,且下降程度具有一定的浓度依赖性,同时,汉黄芩素可增加促凋亡蛋白Bax的表达水平。3组细胞hTERT、Bcl-2和Bax蛋白表达水平差异有统计意义(P<0.05)。说明汉黄芩素可抑制hTERT和Bcl-2蛋白的表达水平,同时增加Bax蛋白的表达水平。见图5。
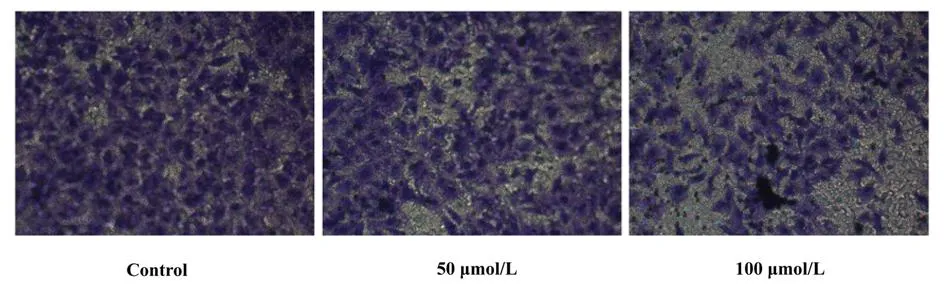
图4Transwell侵袭实验检测不同浓度汉黄芩素对细胞体外侵袭能力的影响(免疫组化×400)
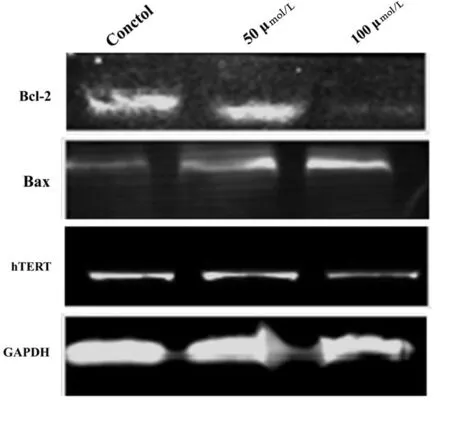
图5Western blot检测不同浓度汉黄芩素对hTERT、Bcl-2、Bax蛋白表达水平的影响
3讨论
随着中药抗肿瘤作用的实验和临床研究的深入开展,中药复方及单体有效成分的抗肿瘤潜力越来越受到国内外学者们的重视。黄芩属唇形科植物,是我国自古代以来常用的治温热病,抗炎抗氧化药物之一[8]。近年来多项研究表明,黄芩的主要活性成分汉黄芩素可发挥显著的抗肿瘤作用[9-11]。Lee等[12]研究报道,汉黄芩素能有效诱导人前列腺癌细胞株LNCaP凋亡,在这一过程中伴随着细胞内p53、p21和Bax表达水平的增高,以及线粒体内细胞色素C释放和caspases的级联激活。Yu等[13]研究表明,在肝癌细胞中,汉黄芩素可通过上调胞内ROS水平和抑制MMP蛋白表达水平,诱导肝癌细胞的凋亡并抑制其转移。本研究结果发现,一定浓度的汉黄芩素能有效抑制人喉癌Hep2细胞的增殖、凋亡及体外侵袭,与上述报道结果相一致。
本实验以不同浓度的汉黄芩素作用于人喉癌Hep-2细胞,CCK-8法发现汉黄芩素可以有效抑制Hep-2细胞的增殖能力,其抑制作用具有浓度和时间依赖性,同时,流式细胞仪检测及Hoechst染色发现,同等浓度范围的汉黄芩素能有效诱导喉癌Hep-2细胞的凋亡,包括早期和晚期凋亡。此外,Transwell体外侵袭实验发现汉黄芩素能够显著降低喉癌细胞的侵袭能力。上述结果说明,汉黄芩素可在体外有效抑制人喉癌Hep-2细胞的增殖,诱导Hep-2细胞凋亡,同时还能抑制喉癌细胞的体外侵袭能力。
对汉黄芩素的作用机制进行进一步研究,发现汉黄芩素的抗肿瘤作用可能与其下调抑制Bcl-2蛋白家族及hTERT蛋白表达水平相关。肿瘤发生的两大原因是肿瘤细胞过度增殖及凋亡相对不足。近年来,端粒酶与肿瘤凋亡的关系引起了国内外研究者极大的兴趣[14]。Del Bufalo等[15]研究表明,抗凋亡基因Bcl-2过度表达和凋亡基因Bax表达下降可导致端粒酶活性显著增加。张汉英等[16]研究表明汉黄芩素可通过抑制端粒酶逆转录酶hTERT的表达,从而抑制移植人卵巢癌SKOV3细胞裸鼠瘤体组织的生长,诱导肿瘤细胞凋亡。本实验发现, 汉黄芩素作用于Hep-2细胞后,随着药物浓度的增加,细胞增殖受到明显抑制,凋亡显著增加,端粒酶hTERT蛋白、Bcl-2蛋白表达逐渐下调,而Bax蛋白表达逐渐增强,说明汉黄芩素诱导喉癌细胞发生凋亡,与其对Bcl-2蛋白家族和端粒酶的调控密切相关。
目前对汉黄芩素的抗肿瘤作用尚未完全研究清楚,本研究首次探讨并发现了汉黄芩素能显著抑制喉癌细胞的增殖、诱导细胞凋亡以及抑制喉癌细胞体外侵袭能力,提示了其在喉癌中潜在的抗肿瘤作用;而进一步的机制研究表明,汉黄芩素可以在蛋白水平有效抑制Bcl-2及hTERT表达,增加Bax表达。因此,推测汉黄岑素可能通过调控Bcl-2蛋白家族及端粒酶的活性变化,从而实现抑制肿瘤的作用。此外,复发或远处转移是影响喉癌患者治疗和预后的主要因素之一[17]。汉黄芩素在杀伤喉癌细胞的同时,又能抑制肿瘤细胞的远处转移,具有相当可观的抗肿瘤潜能。关于汉黄芩素在喉癌中的研究,还需更深入的动物在体实验和Ⅰ期临床试验,以期为喉癌的防治提供新的方法和途径。
参考文献
1Siegel R,Naishadham D,Jemal A.Cancer statistics.CA Cancer J Clin,2013,63:11-30.
2Marinela R,Nikola K,Ivan M,et al.Epidemiology of Laryngeal Cancer in Osijek-Baranja County(Eastern Croatia).Coil Antropol,2012,36: 107- 110.
3Kaiserova H,Simunek T,Vander J,et al.Flavonoids as protectors against doxorubicin cardiotoxicity: role of iron chelation, antioxidant activity and inhibition of carbonyl reductase.Biochim Biophys Acta,2007,1772: 1065-1074.
4Chen L,Hung LY,Tsai KW,et al.Wogonin, a bioactive flavonoid in herbal tea, inhibits inflammatory cyclooxygenase-2 gene expression in human lung epithelial cancer cells.Mol Nutr Food Res,2008,52:1349-1357.
5Parajuli P,Joshee N,Rimando AM,et al.In vitro antitumor mechanisms of various Scutellaria extracts and constituent flavonoids.Planta Med,2009,75: 41-48.
6Lee DH,Kim C,Zhang L,et al.Role of p53,PUMA and Bax in wogonin- induced apoptosis in human cancer cells.Biochem Pharmacol,2008,75: 2020-2033.
7Wang W,Guo Q,You Q,et al.Involvement of bax/bcl-2 in wogonin-induced apoptosis of human hepatoma cell line SMMC-7721.Anticancer Drugs,2006,17: 797-805.
8Lan Y,Xue LZ,Hong S,et al.Catalase suppression-mediated H2O2accumulation in cancer cells by wogonin effectively blocks tumor necrosis factor-induced NF-κB activation and sensitizes apoptosis.Cancer Sci,2011,4:870-876.
9杨莉,尤启冬,杨勇,等.汉黄芩素抗肿瘤作用的研究进展.中国医科大学学报,2009,40:576 -579.
10魏国丽,周宇.汉黄芩素对肺腺癌A549细胞黏附和迁移能力的影响及其可能机制.肿瘤,2011,31:34-36.
11李美德,黎金浓,曹治云,等.应用基因芯片研究汉黄芩素对肝癌细胞的生长抑制作用机制.肿瘤学杂志,2013,19:193-198.
12Lee DH,Kim C,Zhang L,et al.Role of p53,PUMA and Bax in wogonin-induced apoptosis in human cancercells.Biochem Pharmacol,2008,75:2020-2033.
13Yu JQ,Liu HB,Tian DZ,et al.Changes in mitochondrial membrane potential and reactive oxygen species during wogonin-induced cell death in human hepatoma cells.Hepatol Res,2007,37:68-76.
14Zhang JF,Chen GH,Lu MQ,et al.Change of Bcl-2 expression and Telomerase during apoptosis induced by wogonin on human hepatocellular carcinoma cells.Zhongguo ZhongYao ZaZhi,2006,31:1811.
15Del Bufalo D,Rizzo A,Trisciuoglio D,et al.Involvement of hTERT in apoptosis induced by interference with Bcl-2 expression and function.Cell Death Differ,2005,12:1429-1438.
16张汉英,黎丹戎,李力. 汉黄芩素对移植人卵巢癌SKOV3细胞裸鼠组织端粒酶蛋白hTERT影响与凋亡相关性研究.时珍国医国药,2008,19:1987-1989.
17梁国祥,刘丽,蔡海燕.喉癌病因分析.临床医学,2011,31:98-101.
The effects and action mechanisms of wogonin on the proliferation,apoptosis and invasion of human laryngeal carcinoma cells (Hep-2) in vitro
LINGDan,XULei,YANGGuangdong,etal.
DepartmentofOtolaryngology,People’sHospitalofYunxiCounty,Hubei,Yunxi442600,China
【Abstract】ObjectiveTo investigate the effect and potential action mechanisms of wogonin on the proliferation,apoptosis and invasion in human laryngeal carcinoma cells (Hep-2) in vitro.MethodsAfter treated with different concentrations of wogonin , the effects of wogonin on proliferation activity of Hep-2 cells were detected by CCK-8,and its effects on cell apoptosis of Hep-2 were evaluated by flow cytometry.The effects of wogonin on nucleus morphologic change of Hep-2 were measured by Hoechst staining,and its effects on invasive ability of Hep-2 cells were detected by Transwell assay.Furthermore, the expression levels of hTERT,Bcl-2,Bax proteins were detected by Western Blot.ResultsThe results by CCK-8 showed that wogonin could obviously inhibit proliferation of Hep-2,with a concentration-dependent manner. The results by flow cytometry indicated that wogonin could induce apoptosis of Hep-2.Hoechst staining suggested that wogonin could results in nucleus morphologic change of Hep-2,and Transwell assay showed that wogonin could inhibit the invasive ability of Hep-2.Moreover,Western Blot indicated that wogonin could obviously decrease the expression levels of hTERT and Bcl-2 and increase the expression levels Bax (P<0.05).ConclusionWogonin can significantly inhibit cell proliferation, induced cell apoptosis and inhibit invasive ability of Hep-2 in vitro,and its action mechanism may be correlated to the regulation of expression levels of hTERT,Bcl-2 and Bax protein.
【Key words】wogonin;laryngeal carcinoma;Hep-2 cells;anti-tumor effects
(收稿日期:2015-06-18)
【中图分类号】R 739.65
【文献标识码】A
【文章编号】1002-7386(2016)07-0987-04
通讯作者:许磊,442600湖北省郧西县人民医院神经内科;
doi:10.3969/j.issn.1002-7386.2016.07.007
E-mail:12875710@qq.com
