饮用水有机提取物对L02细胞增殖及细胞周期的影响*
2016-04-25岑延利杨光红桂晓玲张爱华李传美
岑延利, 杨光红*, 桂晓玲, 张爱华, 李传美
(贵州医科大学 公共卫生学院, 贵州 贵阳 550025)
饮用水有机提取物对L02细胞增殖及细胞周期的影响*
岑延利**, 杨光红***, 桂晓玲, 张爱华, 李传美
(贵州医科大学 公共卫生学院, 贵州 贵阳550025)
[摘要]目的: 探讨饮用水有机提取物对人正常肝细胞(L02)的细胞增殖及细胞周期的影响。方法: 体外培养L02细胞,将其分别暴露于培养液(空白对照组)、0.1% DMSO(溶剂对照组)和0.312 5、0.625 0、1.250 0、2.500 0、5.000 0 L/mL固相萃取法提取的饮用水有机提取物(染毒组)中24、48及72 h, 采用MTT法观察L02细胞的增殖情况, 流式细胞仪检测细胞周期的构成比。结果: (1)与溶剂对照组比较,各染毒组细胞活力随着有机提取物浓度的增加及时间的延长而降低,差异有统计学意义(P<0.05);(2)随染毒剂量的增加,细胞周期中G0/G1期细胞比例逐渐下降,除24 h、48 h 0.312 5 L/mL染毒组外,其余剂量染毒组G0/G1期细胞比例均明显低于溶剂对照组(P<0.05);S期细胞比例则随有机提取物浓度的增加而上升,除24、48及72 h 0.312 5 L/mL的染毒组外,其余染毒组中S期细胞比例的增加与对照组比较,差异有统计学意义(P<0.05);染毒48 h、72 h后,L02细胞中G0/G1期细胞比例低于24 h染毒组(P<0.05);S期细胞比例则高于24 h染毒组(P<0.05)。结论: 在本研究条件下,饮用水有机提取物可以阻滞L02细胞于S期,抑制细胞的增殖,且呈时间、剂量依赖性。
[关键词]饮用水; 有机提取物; 肝细胞; 细胞增殖; 细胞周期
饮用水源中一般都含有一定浓度的天然有机物,工业废水及城镇生活污水[1]、废气和废渣大量排放到自然水环境中,加之农业生产中农药的大量使用,也会对水体造成了严重污染,影响饮水安全[2]。研究发现,水源有机物污染对人体有致畸、致癌、致突变、生殖毒性及细胞毒性等危害[3-5]。课题组前期的动物实验发现,当地饮用水有机提取物可诱导雄性大鼠精子畸形、雄性激素分泌水平异常,同时可导致染色体断裂、肝脏DNA损伤等[6-9]。本研究萃取G市某地饮用水的有机污染物,对人正常肝细胞系L02细胞进行染毒,观察有机提取物对L02肝细胞的细胞增殖和细胞周期的影响。
1材料与方法
1.1实验细胞、主要试剂及仪器
正常人肝L02细胞,来源于中科院昆明细胞库。MTT细胞增殖检测试剂盒(Solarbio 公司),细胞周期检测试剂盒(碧云天生物技术研究所),XAD-2大孔树脂(20-60目,美国Sigma公司),70%乙醇、甲醇、二氯甲烷(川东化工),胰蛋白酶(Beyotime 公司)。旋转蒸发仪(RE-3000,上海亚英生化仪器有限公司),超级酶标仪(Max200, 美国Bio-Tek公司 ),流式细胞仪(FC500,贝克曼库尔特商贸有限公司)。
1.2方法
1.2.1水样采集与有机物提取采集G市某地管网末梢水,采用固相萃取法[10]富集水中有机物,萃取剂为XAD-2树脂,洗脱剂为二氯甲烷和甲醇,水样过柱流速为4倍柱体积/min,过柱完后依次用3倍柱体积的二氧甲烷和甲醇先后洗柱,流速0.1倍柱体积/min,洗脱液经旋转蒸发仪25 ℃减压蒸馏挥干,将已挥干的浓缩提取物用DMSO定容,-20 ℃冰箱保存备用。
1.2.2L02细胞培养及染毒剂量确定细胞培养基采用含10%胎牛血清的DMEM,并加入青霉素和链霉素,使其终浓度分别为100 U/mL和100 mg/L。将人肝L02细胞置于37 ℃、5% CO2的细胞培养箱中培养。用0.25%胰酶消化液消化细胞并传代,取对数生长期细胞进行实验。根据文献[11]及预实验结果,确定最高染毒剂量为5.000 0 L/mL,向下以2倍组距另设4个染毒剂量组,分别为2.500 0 L/mL、1.250 0 L/mL、0.625 0 L/mL和0.312 5 L/mL,同时设溶剂对照组(0.1%DMSO)和空白对照组(培养液),处理时点为24 、48及72 h。
1.2.3MTT法检测细胞的增殖情况取对数期生长的细胞,从培养瓶(25 cm2)中移去旧培养液,用PBS缓冲液轻柔漂洗2~3次,加入0.25%的胰蛋白酶1 mL消化,弃消化液后用新鲜培养液重悬,细胞计数后接种于细胞培养板,细胞在37 ℃、5% CO2饱和湿度培养箱内贴壁培养24 h。每孔加入染毒培养基100 μL,每组设6个复孔,处理时点为24 h、48 h和72 h。细胞染毒结束后小心吸掉上清液,每孔中加入MTT溶液50 μL (5 g/L),继续培养4 h。弃去上清液,每孔加入DMSO 150 μL, 室温下平板摇床上摇晃10 min,测定光密度D(490 nm)值,并计算细胞存活率,细胞存活率(%)=实验组D/对照组D×100。重复实验3次。
1.2.4流式细胞仪检测细胞周期细胞染毒结束后,收集各组细胞悬液,2 000 r/min离心5 min,弃去上清液,磷酸盐缓冲液(PBS)洗涤1次,用4 ℃预冷的70%乙醇固定2 h,PBS再洗涤3次,加入RNase至终浓度50 mg/L及碘化丙碇(PI)染液至终浓度50 mg/L,37 ℃孵育30 min后,用FC500 型流式细胞仪在 488 nm 波长下检测 DNA 含量,分析细胞在增殖周期中 G 1期、 G 2 期和 S 期的分布。重复3次,计算细胞周期各时相的百分比。
1.3统计学方法
2结果
2.1L02细胞增殖活力
随染毒剂量的增加,L02细胞增殖活力逐渐降低,各染毒组与溶剂对照组比较,差异有统计学意义(P<0.05)。随染毒时间延长,L02细胞增殖活力亦逐渐下降,48及72 h染毒组均明显低于24 h染毒组(P<0.05)。见表1。
2.2L02细胞细胞周期
除24和48 h的0.312 5 L/mL染毒组外,其余染毒组L02细胞中G0/G1期细胞比例均随染毒剂量的增加而明显降低 (P<0.05);除24、48 及72 h的0.312 5 L/mL染毒组外,其余染毒组L02细胞中S期细胞比例均随染毒剂量的增加而明显升高 (P<0.05)。48 和72 h染毒组,L02细胞G0/G1期细胞比例均明显低于24 h染毒组(P<0.05),而S期细胞比例则明显高于24 h染毒组(P<0.05)。见表2、3、4。
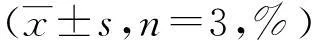
表1 饮用水有机提取物染毒对L02细胞
(1)与同时点溶剂对照组比较,P<0.05
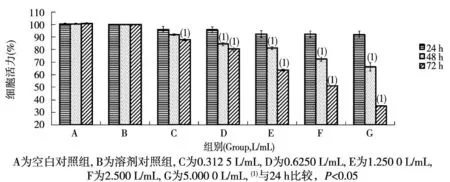
图1 饮用水有机提取物对L02细胞增殖活力的影响Fig.1 Influence of organic extracts from drinking water on L02 cell proliferation
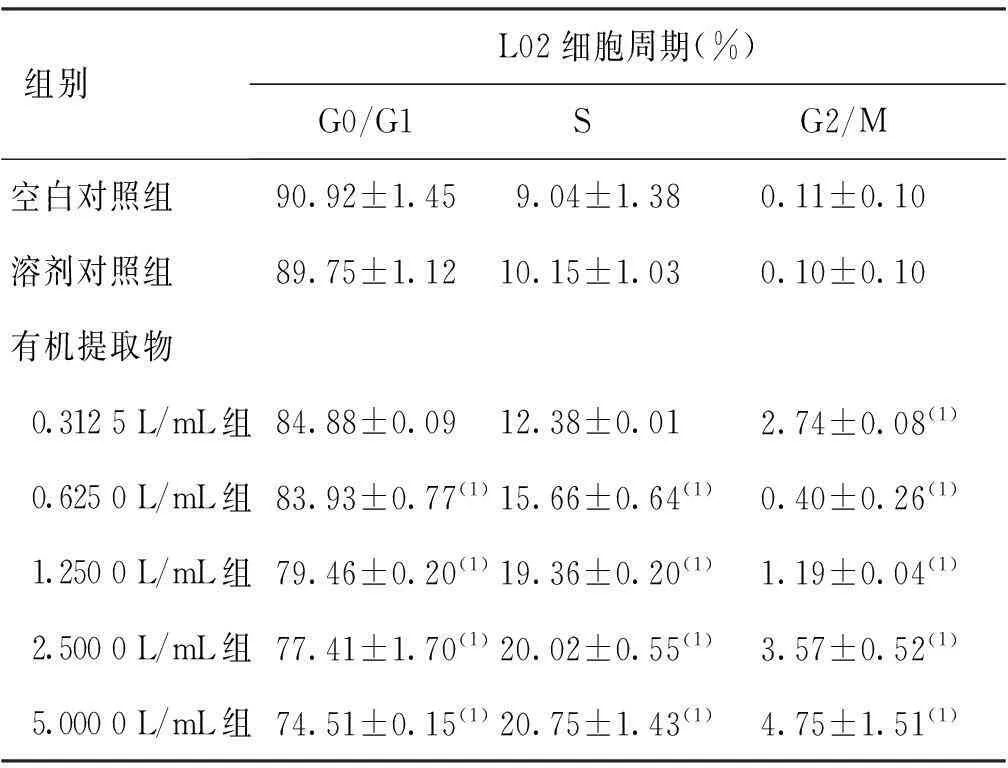
组别L02细胞周期(%)G0/G1SG2/M空白对照组 90.92±1.45 9.04±1.380.11±0.10溶剂对照组 89.75±1.1210.15±1.030.10±0.10有机提取物 0.3125L/mL组84.88±0.0912.38±0.012.74±0.08(1) 0.6250L/mL组83.93±0.77(1)15.66±0.64(1)0.40±0.26(1) 1.2500L/mL组79.46±0.20(1)19.36±0.20(1)1.19±0.04(1) 2.5000L/mL组77.41±1.70(1)20.02±0.55(1)3.57±0.52(1) 5.0000L/mL组74.51±0.15(1)20.75±1.43(1)4.75±1.51(1)
(1)与同细胞周期溶剂对照组比较,P<0.05
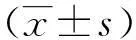
表3 饮用水有机提取物染毒48 h时
(1)与同细胞周期溶剂对照组比较,P<0.05
表4 饮用水有机提取物染毒72 h
(1)与溶剂对照组比较,P<0.05
3讨论
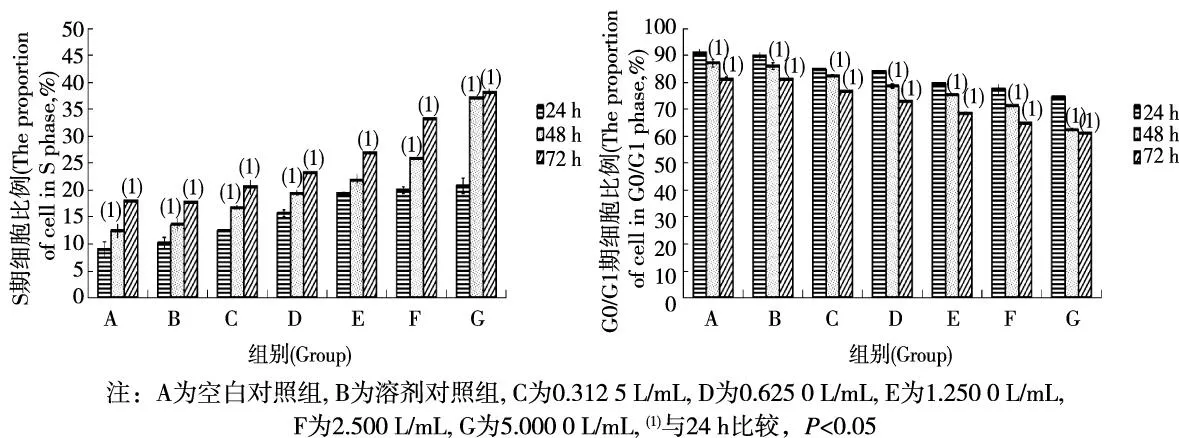
图2 饮用水有机提取物不同时间染毒对L02细胞周期变化的影响Fig.2 Changes of L02 cells cycle caused by organic extracts from drinking water during different time
生命体的重要特征是细胞通过分裂来增殖、分化,使个体发育、成熟并繁衍后代。由于MTT比色法可间接反映活细胞的多少,且使用酶标仪操作简便、快速。因此,本研究采用MTT比色法检测饮用水有机提取物对人肝L02细胞体外增殖的影响, 发现不同浓度饮用水有机提取物处理人肝L02细胞24、48及72 h后, 各染毒剂量均能显著降低其增殖水平;从量效关系来看,各个作用时间点L02细胞活力均随染毒剂量的增大而降低,具有剂量依赖性(P<0.05)。从时效关系看,有机提取物染毒48和72 h时L02细胞活力与染毒24 h时相比,差异均有统计学意义(P<0.05)。 该地饮用水有机提取物染毒浓度为0.312 5 L/mL,染毒时间为24 h时,即可抑制L02细胞的增殖。细胞增殖的抑制通常与细胞周期异常有关。一个细胞周期分为2个阶段:分裂期和间期。分裂期是物质准备和积累阶段,包括:G1期、S期及G2期[12-13]。赵淑华等[14]的研究显示某地饮用水有机提取物染毒后,HL-7702细胞的增殖受抑,且可能与S期阻滞有关。由于各地污染物构成不同,其健康危害效应及可能机制不尽相同。为保障本地方人群健康,本实验萃取饮用水有机污染物,观察其肝细胞毒性,为后续深入研究奠定基础。本地饮用水有机提取物染毒L02后,处理组的细胞周期出现异常, G0/G1期细胞比例明显降低,S期细胞比例则显著增加。S期是细胞周期的关键时点,DNA经过复制后,含量增加一倍,可顺利进入G2期。而本研究中,该地饮用水有机污染物可阻滞细胞周期于S期,从而影响了人肝L02细胞的DNA合成,使其不能顺利进入M期,结果导致细胞周期延长,不能正常分裂,从而抑制细胞增殖。目前,细胞周期调控的核心分子基础是Cyclin、CDK和细胞周期蛋白依赖性激酶抑制因子(CKI)[15]。本实验中细胞周期的阻滞、细胞增殖受抑是否与此有关,有待于进一步深入研究。
4参考文献
[1] 赵辉.水中污染物对人体的危害[J].科技信息, 2009(31):377.
[2] 王文忠.浅析水环境中有毒污染物的来源和危害[J].山西水土保持科技, 2013(3):30-31.
[3] 韩方岸,将兆峰,柯士呜,等.镇江农村肿瘤高发的病因学调查[J].预防医学情报杂志, 2011(1):1-4.
[4] 高红萍,王丽,白 钢,等.包头市黄河水与自来水有机提取物致突变性研究[J].包头医学院学报, 2007(6):588-589.
[5] 田怀军,吴德生,陶锐,等.氯化饮用水有机提取物对睾丸支持细胞的毒性效应[J].环境与健康杂志, 2001(3):146-147.
[6] 杨光红,王士然,张爱华,等.G市某区管网末梢水中有机提取物对雄性大鼠生殖激素分泌水平的影响[J].环境与职业医学, 2013(5):342-345.
[7] 杨光红,张爱华,王士然,等.常规处理工艺对地表水有机提取物遗传毒性的影响[J].环境与健康杂志, 2013(9):799-801.
[8] 徐文零,杨光红,王士然,等.G市某区管网末梢水有机污染物对大鼠精子形态的影响[J].贵阳医学院学报, 2013(2):134-137.
[9] 李骞,敖云霞,杨光红,等.饮用水有机提取物致大鼠肝脏DNA及蛋白质氧化损伤的研究[J].现代预防医学, 2014(22):4138-4140.
[10]孟凡生,王业耀,陈晶.我国水环境有机物分析前处理技术[J].环境监测管理与技术, 2010(4):15-18.
[11]陈曦.P53非依赖性信号通路在邻苯二甲酸二(2-乙基已基)酯致体外培养人肝细胞毒性中的调控作用[D].武汉:华中科技大学博士研究生论文, 2011.
[12]李春.细胞周期及其调控[J].福建医药杂志, 2013(5):146-147.
[13]高世勇,曲笑莹.细胞周期同步化研究进展[J].中国药理学通报, 2014(1):17-21.
[14]赵淑华,隋春生,王春华,等.饮用水有机提取物对正常人肝 HL-7702 细胞的毒性[J].环境与健康杂志, 2011(11):984-986.
[15]Xu L, Wang C, Wen Z, et,al. Selective up-regulation of CDK2 is critical for TLR9 signaling stimulated proliferation of human lung cancer cell[J].Immunol Lett, 2010(2):93-99.
(2015-12-22收稿,2016-02-23修回)
中文编辑: 周凌; 英文编辑: 赵毅
The Influence on Cell Proliferation and Cell Cycle of L02 Cells Exposed to Organic Extracts from Drinking Water
CEN Yanli, YANG Guanghong, GUI Xiaoling, ZHANG Aihua, LI Chuanmei
(SchoolofPublicHealth,GuizhouMedicalUniversity,Guiyang550025,Guizhou,China)
[Abstract]Objective: To investigate the influence of organic extracts from drinking water on liver cell (L02) proliferation and cell cycle. Methods: The L02 cells was cultivated in vitro: blank control group (culture solution), solvent control group (0.1%DMSO); organic extracts group (The dose of pollutants groups were 0.312 5, 0.625 0, 1.250 0, 2.500 0 and 5.000 0 L/mL samples were extracted by solid phase extraction method). Each group was treated for 24 h, 48 h and 72 h. Cell proliferation was measured by MTT assay. The constituent ratio of cell cycle was detected with flow cytometry. Results: (1) Compared with solvent control group, cell vitality of L02 cells decreased gradually with the increasing of exposure time and concentration of organic extracts. The differences were statistically significant (P<0.05). (2)The proportion of cells in G0/G1 phase decreased gradually with the increasing concentration of organic extracts. Except for 0.312 5 L/mL of pollutants group at 24 h and 48 h, significant differences were found in other exposure groups (P<0.05). The proportion of cell in S phase increased gradually with the increasing concentration of organic extracts. Except for 0.312 5 L/mL at 24 h, 48 h and 72 hr exposure, significant differences existed compared with solvent control group, differences were statistically significant (P<0.05). Compared with 24 h exposure group, exposed groups at 48 h-exposure and 72 h-exposure demonstrated significantly increase in G0/G1phase cell proportion and S phase cell proportion with increasing time (P<0.05). Conclusions: The results of the present paper showed that the organic extracts from drinking water can inhibit cell proliferation and change cell cycle of L02 cells.
[Key words]drinking water; organic extracts; hepatic cells; cell proliferation; cell cycle
[中图分类号]R114
[文献标识码]A
[文章编号]1000-2707(2016)03-0294-04
*[基金项目]贵州省科技厅基金[黔科合LH字(2014)7102]; 贵阳市科学技术计划项目[筑科合同(2013103)19号]
**贵州医科大学2013级硕士研究生
***通信作者 E-mail:280446859@qq.com
网络出版时间:2016-03-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160317.1029.024.html
