经宿主致倦库蚊幼虫复壮后灭蚊真菌贵阳腐霉的毒力观察*
2016-04-25苏晓庆
杨 虓, 苏晓庆
(1.珠海盈嘉行科技有限公司, 广东 珠海 519000; 2.贵州医科大学 生物学教研室, 贵州 贵阳 550004)
经宿主致倦库蚊幼虫复壮后灭蚊真菌贵阳腐霉的毒力观察*
杨虓, 苏晓庆**
(1.珠海盈嘉行科技有限公司, 广东 珠海519000; 2.贵州医科大学 生物学教研室, 贵州 贵阳550004)
[摘要]目的: 经宿主致倦库蚊幼虫复壮后灭蚊真菌贵阳腐霉(Pg)的毒力观察。方法: 向高压灭菌碗加入致倦库蚊幼虫和毒力减退的Pg菌丝,记录蚊虫死亡数和感染数,计算死亡率和感染率;取被感染的蚊虫用水琼脂平板、KPYG2平板和SFE平板分离Pg,用新分离的Pg感染致倦库蚊幼虫,记录复壮后最高组感染率、单碗的最高和最低蚊虫感染率,观察Pg感染蚊虫毒力的变化。结果: 复壮后最高组Pg对蚊虫平均感染率、单碗Pg对蚊虫最高感染率及单碗Pg对蚊虫最低感染率均达到40%或以上,单碗Pg最高感染率甚至达100%。结论: 采用宿主致倦库蚊幼虫复壮毒力减退的Pg菌丝,可提高Pg灭蚊的毒力。
[关键词]致倦库蚊; 幼虫; 复壮; 生物灭蚊; 贵阳腐霉; 毒力
蚊虫是重要的医学昆虫,不仅吸血骚扰人畜,而且传播疟疾、登革热、乙型脑炎等多种疾病。近年来,在广东、云南、广西、福建及台湾等多地出现登革热流行,消灭登革热媒介昆虫——蚊,变得迫在眉睫[1]。目前灭蚊多使用化学灭蚊剂,在导致严重的环境污染和破坏生态平衡的同时,还诱导了蚊虫的抗药性[1-3]。生物灭蚊是一种有利于环境保护和维持生态平衡的方法,但是,目前可用的生物灭蚊剂仅有灭蚊细菌苏云金杆菌以色列变种(Bacillusthuringiensisvar.israelensis,Bti)和球形芽孢杆菌(Bacillussphaericus, Bs)。Bti持效期太短,Bs灭登革热媒介的能力弱(内部交流),而灭蚊真菌(Pythiumguiyangense, Pg)则具有有较大优势。Pg具有繁殖速度快、易于人工培养、灭蚊谱广(3属14种)、对非靶生物相对安全等诸多优点[4],但亦存在毒力不稳定的缺点, 复壮是对已衰退的菌种(群体)进行纯种分离和选择性培养,使其中未衰退的个体获得大量繁殖,重新成为纯种群体的措施。2013年7月22日~12月14日,本研究采用经宿主复壮的方法提升Pg灭蚊毒力,报告如下。
1材料与方法
1.1材料
实验用Pg真菌为1994年从贵州医科大学(原贵阳医学院)土壤中分离并在本实验室保种、传代所得。培养用SFE培养基和KPYG2培养基[5],纯化用水琼脂培养基(1 000 mLddH2O中加入1.5 g琼脂,高压灭菌后铺制平板)。实验测试用蚊虫为本实验室驯养的2~3龄致倦库蚊幼虫。喂养条件:温度(25±1)℃,光照条件L∶D=14∶10,相对湿度70%。
1.2方法
1.2.1Pg生物测定将Pg接种于新鲜SFE培养基,25 ℃培养5~7 d。取耐高温塑料碗8只,高压灭菌后,每碗盛200 mL自来水,加25只致倦库蚊幼虫、4%鸡肝粉悬液8滴;均分为实验组和对照组,实验组加入带菌丝的琼脂块(面积约为113 m2)3块,对照组每碗加入3块空白SFE琼脂块。每天观察2次,取出死蚊,镜检感染情况;记录蚊虫死亡数和感染数,计算死亡率和感染率。死亡率或感染率=(蚊虫死亡数或感染数/蚊虫总只数)×100%,以对照组蚊虫不出现死亡和感染为实验可信。
1.2.2分离Pg取被感染的蚊虫,用75%酒精消毒,无菌ddH2O洗3次,无菌滤纸吸干残留水分,分别接种于水琼脂平板、KPYG2平板和SFE平板,25 ℃培养5~7 d,用以感染新的蚊虫。
1.2.3复壮用新分离的Pg感染致倦库蚊幼虫,从感染率高的实验组中挑选菌丝生长茂盛、虫体相对完好的虫尸,或挑选带菌还没有死亡的活虫来分离Pg。重复以上过程,通过计算感染率来反映Pg感染蚊虫毒力的变化。
1.2.4观察指标记录复壮后平均感染率最高组、蚊虫感染率最高和最低单碗的蚊虫感染率,记录被感染的活蚊数目,以最高组平均感染率为主要指标,其余指标作为辅助指标评价Pg感染蚊虫的毒力。
2结果
2.1最高组Pg平均感染率
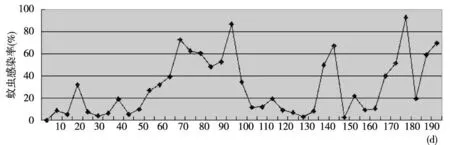
图1 最高组Pg对蚊虫平均感染率Fig.1 A curve showing changes of the highest group average infection rates in bio-assay of P. guiyangense during July through December 2013
因为长期在人工培养基上保种,Pg的灭蚊能力明显下降,所致蚊虫感染率经常在10%左右。经过复壮以后,最高组Pg对蚊虫平均感染率有明显的提升,从图1可看出,在复壮前,最高组平均感染率在40%以下,复壮后,感染率迅速升至40%以上,最高超过80%。虽然复壮后出现一个低谷,但纠正后,最高组平均感染率达40%以上。后面虽有反复,但感染率的提高趋于稳定。
2.2单碗Pg最高感染率
单碗Pg对蚊虫的最高感染率是Pg毒力上升的另一项指标。复壮后的单碗最高感染率高于复壮前, 复壮后的单碗最高感染率可达100%(图2)。
2.3单碗Pg最低感染率

图2 单碗Pg对蚊虫最高感染率Fig.2 A curve showing changes of the highest cup infection rates in bio-assay of P. guiyangense during July through December 2013
从图3可以看出Pg毒力呈提升的趋势,复壮前出现一定的0感染率单个实验碗,复壮后很少出现,最低单碗感染率可达80%。

图3 单碗Pg对蚊虫最低感染率Fig.3 A curve showing changes of the lowest cup infection rates in bio-assay of P. guiyangense during July through December 2013
3讨论
菌种退化是微生物培养和生产中普遍存在的问题。其表现形式多种多样,Pg菌种退化的主要表现就是灭蚊毒力下降。对于菌种退化的原因,学者们举出很多,涉及到生理、生化方面,也有病毒干扰以及培养条件等。但其中最重要的是遗传因素起的作用,或者说遗传因素通过前述的各因素导致了菌种的退化[6-7]。
引起菌种退化的遗传因素包括基因突变、基因重组、染色体突变、遗传平衡被打破等。对于Pg这种多核细胞真菌,异核体现象能更好地解释其退化的原因[7]。在其生长繁殖过程中,反复的有丝分裂和减数分裂必然形成具有不同基因组合,和不同表达基因的细胞核。其各种核的比例不断变化,表现为灭蚊毒力较大幅度的波动。长期在人工培养基上继代培养,使比较适应于腐生的基因表达的细胞核逐渐占优势,因此其对蚊虫的毒力明显下降。而在连续的经宿主复壮过程中,不断筛选毒力高的菌株,即增加适应于寄生的基因表达的细胞核所占比例。因此获得比较明显的灭蚊毒力增高的效果。实验中还观察到随着菌株毒力增高,带菌活虫数目明显增加。而低毒力的菌株感染的蚊幼虫被发现时已经是长满菌的虫尸。课题组推测原因可能为当Pg的毒力增强后,Pg就能快速地侵入虫体,在虫体明显发病前就生长繁殖。而当它毒力比较弱时,Pg的入侵和生长速度比较慢,蚊虫的感染和死亡发生得也比较缓慢而不明显。当采用被感染的活虫进行复壮,后代菌株的感染能力会比从感染蚊尸中分离得到的菌株高,可能是因为适应于寄生的基因表达所占比例增高,进一步验证了该假设。
Pg能否应用于灭蚊防病,提高和稳定Pg的毒力是关键的环节。虽然基因工程[8]和原生质体育种[9]是改良菌种的有力工具,但是相比之下,传统的经宿主复壮方法,更简单、易行,效果明显,不失为经济实用的手段。本实验结果显示Pg复壮后最高组Pg平均感染率、单碗Pg最高感染率及单碗Pg最低感染率均达到40%或以上,单碗Pg最高感染率甚至达100%,说明本复壮实验成功使毒力减退的Pg通过复壮恢复了毒力,虽然复壮过程中,不良的培养基材料导致了一次反复,证明了培养条件也是影响菌种毒力的因素。这对于实际生产也提供了有益的经验。长期在人工培养基上传代会导致菌种退化,提示在Pg的工业化生产中必须加强菌种的复壮工作。经宿主复壮是保持和提高Pg毒力的有效途径。
4参考文献
[1] 孟凤霞,王义冠,冯磊,等. 我国登革热疫情防控与媒介伊蚊的综合治理 [J].中国媒介生物学及控制杂志, 2015(1):4 -10.
[2] 赵明惠,冉鑫,李春晓,等 淡色库蚊和致倦库蚊对杀虫剂抗药性的调查研究[J].中国媒介生物学及控制杂志, 2014(2):116-118.
[3] 蔡蓉,邵宗贤,陈跃,等. 淮安市三带喙库蚊和白纹伊蚊对常用杀虫剂的抗药性测定 [J]. 中华卫生杀虫药械, 2015(1):23-25.
[4] 苏晓庆,刘萍,张传博,等.灭蚊真菌贵阳腐霉及其研究进展[J].中华卫生杀虫药械, 2010(2):141-143.
[5] 王荣新,雷大卫,苏晓庆. 贵阳腐霉Pr1蛋白酶的诱导条件研究[J]. 贵阳医学院学报, 2008(1):12-15.
[6] 刘新宇,祁玉良,熊在东,等.食用菌菌种退化的遗传学分析[J] .信阳农业高等专科学校学报, 2001(2):16-18.
[7] 唐晓庆,唐燕平,李增智. 球孢白僵菌菌种退化及其对马尾松毛虫防治的影响 [J]. 安徽农业大学学报, 1996(3):246-253.
[8] Zhao JN, Su XQ.The genetic transformation ofPythiumguiyangensemediated byAgrobacteriumtumefaciens[J] Mycosistema, 2008(4):594-600.
[9] 江梅,苏晓庆. 灭蚊真菌贵阳腐霉原生质体诱变育种实验研究[J].贵阳医学院学报, 2008(6):586-596.
(2015-12-03收稿,2016-02-25修回)
中文编辑: 吴昌学; 英文编辑: 周凌
An Observation on Virulence of Mosquito-killing Fungus,Pythiumguiyangenseafter Rejuvenated through Its Host,CulexquinquefaciatusLarvae
YANG Xiao1, SU Xiaoqing1,2
(1.YingjiahangS.T.Co.LTD,Zhuhai519060,Guangdong,China; 2.DepartmentofBiology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To observe the virulence of mosquito-killing fungus, Pythium guiyangense (Pg) after being rejuvenated through its host, Culex quinquefaciatus larvae. Methods: Bioassay was conducted by adding Pg mycelia with its host C. quinquefaciatus larvae into disinfected plastic containers, recording numbers of dead and infected larvae, and calculating mortality rates and infection rates. Pg was re-isolated from infected larvae using KPYG2, SFE and water agar plates, and used to infect C. quinquefaciatus larvae again. The mortality rates and infection rates, specially infection rates in groups and in individual containers were calculated and compared. Results: After several times of continuous rejuvenation, C. quinquefaciatus larvae infection rates by Pg increased markedly, including the highest group infection rates and the highest and lowest infection rates in individual containers, which were generally up to 40% or above, specially, an infection rate of 100% was achieved in individual container. Conclusion: Rejuvenation through host is an effective way to increase virulence of Pg to mosquitoes.
[Key words]Culex quinquefaciatus; larva; rejuvenation; mosquito biological control; Pythium guiyangense Su; virulence
[中图分类号]R184.31; R379; Q939.5
[文献标识码]A
[文章编号]1000-2707(2016)03-0261-04
*[基金项目]国家自然科学基金资助项目(No:30760140)
**通信作者 E-mail:su.xiaoqing@aliyun.com
网络出版时间:2016-03-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160317.1008.006.html
