大鼠PAX6基因真核表达载体构建及鉴定*
2016-04-25严会文廖文萍闫丽丽
严会文, 苏 敏, 高 杰, 廖文萍, 闫丽丽, 黄 悦*
(贵州医科大学 组织学与胚胎学教研室, 贵州 贵阳 550004)
大鼠PAX6基因真核表达载体构建及鉴定*
严会文**, 苏敏, 高杰, 廖文萍, 闫丽丽, 黄悦***
(贵州医科大学 组织学与胚胎学教研室, 贵州 贵阳550004)
[摘要]目的: 构建携带绿色荧光蛋白(GFP)报告基因及PAX6基因的重组真核表达载体,观察其在人胚肾细胞(293FT)细胞中的表达。方法: 采用聚合酶链式反应(PCR)从大鼠脑组织中获取PAX6基因,经连接T载体测序验证正确后,与真核表达载体pEF1α-IRES-AcGFP经SalI/BamHI双酶切后;经T4 DNA连接酶连接,获得重组质粒pEF1α-PAX6-IRES-AcGFP,用菌液PCR、SalI/BamHI双酶切及测序鉴定正确后,用脂质体法转染293FT细胞,采用倒置荧光显微镜观察GFP的表达、蛋白印迹(Western blot)法检测PAX6蛋白表达。结果: 重组质粒pEF1α-PAX6-IRES-AcGFP经RT-PCR和双酶切均得到大小为1 269 bp的目的条带,测序鉴定该序列与GenBank中大鼠PAX6基因序列的同源性达100%,插入基因的大小和方向正确;重组质粒转染293FT细胞后可见GFP绿色荧光,Western blot显示PAX6蛋白表达。结论: 成功构建了PAX6真核表达重组质粒pEF1α-PAX6-IRES-AcGFP,能在293FT细胞中表达PAX6蛋白。
[关键词]绿色荧光蛋白; PAX6基因; 表达载体,真核; 脂质体; 转染
角膜盲是最重要的致盲眼病之一,全球约有超过1 000万的角膜盲患者,我国现有角膜盲患者约300多万,每年新发的感染性角膜病致盲患者约10万人[1]。然而,角膜供体的极度匮乏,是造成角膜盲得不到及时治疗的主要原因之一。位于角巩膜交界处的角膜缘干细胞(limbal stem cells, LSCs)是角膜上皮细胞自我更新、修复及再生的基础,能够修复并替代衰老死亡的角膜上皮细胞,在角膜上皮的更新和角膜疾病的治疗中起着不可替代的作用[1-2]。有学者发现人类与啮齿类动物的PAX6基因整个编码区域相似性为100%, WNT7A和PAX6是LSCs分化的关键因子,p63和PAX6协同作用可促进角膜缘干细胞的定向分化[3]。为LSCs移植应用于治疗角膜盲等角膜疾病提供了研究方向。本课题通过构建真核表达载体pEF1α- PAX6-IRES-AcGFP的方法,观察PAX6在人胚肾细胞293FT中的表达,为PAX6在诱导鼠胚胎干细胞分化的作用机制奠定实验基础。
1材料与方法
1.1实验动物、试剂与仪器
体质量100~120 g的健康清洁级SD大鼠(贵州医科大学实验动物中心提供)。人胚肾细胞293FT细胞(贵州医科大学干细胞中心细胞库)、真核表达载体pEF1α-IRES-AcGFP(美国康涅狄格大学Lai Laijun教授惠赠), pUCm-T Vector(上海生工生物工程有限公司);Trizol®Reagent、脂质体Lipofectamine®2000(Invitrogen公司,美国);限制性内切酶SalI 和BamHI(New England Biolabs公司,美国),割胶回收试剂盒、质粒小抽试剂盒(天根生化科技有限公司,中国北京),T4 DNA Ligase(Takala,日本),氨苄霉素、卡那霉素、SDS-PAGE试剂盒、BCA法蛋白定量试剂盒(北京索莱宝生物科技有限公司,中国北京),高效感受态细胞制备试剂盒、内参β-actin(上海生工生物工程有限公司,中国上海),DMEM培养液、0.25%胰蛋白酶(Hyclone,美国),胎牛血清(杭州四季青生物制品有限公司,中国杭州),兔多克隆PAX6抗体、驴抗兔二抗(abcam,美国);其他试剂为国产分析纯。CO2培养箱(Thermo Fisher,美国),高速冷冻离心机、全自动数码凝胶成像分析系统、电泳仪(Eppendorf,德国),PCR仪(ABI,美国);荧光倒置相差显微镜(Nikon,日本)。
1.2方法
1.2.1PAX6基因的扩增和验证根据GenBank提供的已知序列(GeneID:18508),对PAX6基因全CDS区序列设计引物:上游引物5′-ATCAGAGTCGACATGCAGAACAGTCACAGCGGAG-3′,下游引物5′-ATCTGAGGATCCTTACTGTAATCGAGGCCAGTACTG-3′,引物由上海生工生物工程有限公司合成。取健康清洁级SD大鼠5只,无菌条件下由枕骨或第1颈椎处入路,用止血钳将颅顶向上撬开,暴露脑组织,将脑组织冰上匀浆,参照Trizol Total RNA说明书,采用一步法提取SD大鼠脑组织中的总RNA后再逆转录为cDNA,以cDNA为模板,进行PAX6基因PCR扩增。扩增体系为:2×Master Mix 10 μL,上游引物1 μL,下游引物1 μL,cDNA 2 μL,补双蒸馏水(ddH2O)至20 μL。循环条件为: 95 ℃预变性5 min,95℃变性30 s、64 ℃退火30 s、72 ℃延伸1 min(35个循环),最后72 ℃延伸7 min。反应结束后取PCR产物,采用0.7%琼脂凝胶电泳进行鉴定,并割胶回收目的片段。参照T载体试剂盒说明,将回收纯化的PCR产物连接于pUCm-T Vector中,取5 μL连接反应液转化DH5α感受态细菌,将转化的菌液涂在含100 mg/L氨苄青霉素的LB平板上培养16 h。待LB平板长出菌落,挑取单菌落接种到5 mL LB的液体培养基中,37 ℃振荡培养约12 h至对数生长后期,用质粒小量回收试剂盒抽提质粒DNA,经菌液PCR鉴定和限制性内切酶SalI 和BamHI进行双酶切鉴定正确后,将正确的细菌阳性克隆送上海生工生物工程有限公司测序并验证。
1.2.2真核表达质粒pEF1α-PAX6-IRES-AcGFP的构建将连有PAX6基因并测序正确的pUCm-PAX6-T Vector和真核质粒pEF1α-IRES-AcGFP分别用限制性内切酶SalI和BamHI对其进行双酶切,回收1 269 bp的纯化基因片段和酶切后线性化pEF1α-IRES-AcGFP质粒DNA,用T4 DNA连接酶将目的基因片段PAX6定向插入带绿色荧光蛋白(GFP)报告基因的哺乳动物真核表达载体pEF1α-IRES-AcGFP中。将5 μL连接产物转化至自制大肠杆菌DH5α感受态细胞,冰上放置30 min,42 ℃热冲击90 s,冰上放置5 min,加入200 μL无抗性LB液体培养基,37 ℃,250 r/min振荡培养45 min,取菌液200 μL涂布于含50 mg/L的卡那霉素的LB固体培养基中,37 ℃倒置培养过夜。菌液PCR筛选阳性克隆,限制性内切酶SalI /BamHI双酶切鉴定,将初步筛选的阳性克隆送上海生工生物工程有限公司测序。
1.2.3293FT细胞培养和重组质粒pEF1α-PAX6-IRES-AcGFP转染293FT细胞于37 ℃,5% CO2条件下,用含10%胎牛血清的高糖DMEM培养基培养,细胞长满传代,转染前24 h,以5×105个/孔的细胞密度接种于6孔板;待细胞融合>95%时,按Lipofectamine®2000说明书要求进行转染,设立未转染组和转染空质粒pEF1α-IRES-AcGFP的293FT细胞做阴性对照。转染4 h后更换普通培养基,常规培养24 h后于倒置荧光显微镜观察绿色荧光蛋白(GFP)表达(绿色荧光)并拍照。以上实验重复3次。
1.2.4PAX6蛋白表达采用Western blot 法,收集转染后24 h的各组293FT细胞,提取细胞蛋白并用BCA蛋白定量试剂盒进行定量;取蛋白20 μg,经SDS-PAGE凝胶电泳后,采用转移电泳装置,于500 mA恒流条件下电转60 min,将蛋白转移到PVDF膜上;用封闭液(含5%脱脂牛奶的TBST溶液)封闭PVDF膜4 ℃过夜,TBST洗膜3次, 10 min/次;用封闭液稀释的兔多克隆抗体PAX6(1∶1 000)与封闭好的PVDF膜室温孵育2 h;TBST洗膜3次,10 min/次。室温下用封闭液稀释的二抗抗体(1∶5 000)与封闭好的PVDF膜室温孵育2 h;TBST洗膜3次,10 min/次,用ECL试剂盒曝光获得显示条带的胶片,扫描图像保存,用β-actin(1∶8 000)作内参照验证蛋白含量。以上实验重复3次。
2结果
2.1大鼠PAX6基因cDNA的克隆
大鼠PAX6基因扩增产物经琼脂糖凝胶电泳在1 269 bp处可见特异性条带,结果见图1。目的片段克隆入pUCm-T Vector和测序结果经NCBI/BLAST进行序列比对,符合率为100%(见图2)。
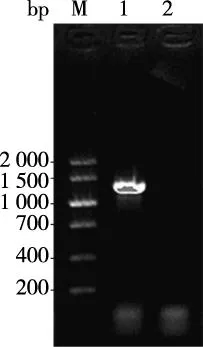
注:M为DNA Marker V,泳道1为PAX6基因片段,泳道2为阴性对照图1 大鼠PAX6基因扩增产物Fig.1 Agrose gel electrophoresis detection of PCR products of PAX6 gene
2.2重组质粒pEF1α-PAX6-IRES-AcGFP的鉴定
重组质粒pEF1α-PAX6-IRES-AcGFP克隆后的菌液PCR产物经琼脂糖凝胶电泳成像结果显示在1 269 bp处见目的条带(图3);提取纯化质粒,用限制性内切酶SalI 和BamHI对其进行双酶切鉴定,琼脂糖凝胶电泳成像结果显示在1 269 bp和6 000 bp处见目的条带和载体条带(图4)。
2.3重组质粒pEF1α- PAX6-IRES-AcGFP转染293FT细胞
将转染24 h后的293FT细胞置于荧光显微镜下观察,细胞呈上皮样成片生长,贴壁疏松,转染前后细胞形态学无明显变化,转染空质粒pEF1α-IRES-AcGFP和重组质粒pEF1α-PAX6-IRES-AcGFP组的293FT细胞胞质内可见明显的特异性绿色荧光,细胞未转染组未见绿色荧光表达(图5)。Western blot蛋白结果显示,未转染组和转染空质粒组均未见PAX6表达,转染重组质粒组在50.6 kDa处有特异性条带(图6)。
3讨论
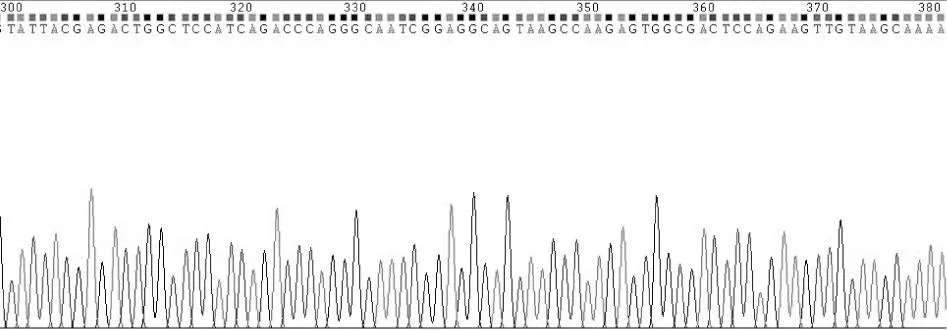
图2 质粒pEF1α-PAX6-IRES-AcGFP部分测序结果Fig.2 A part of sequencing map of pEF1α-PAX6-IRES-AcGFP plasmid
外源蛋白在哺乳动物细胞中的表达量一般是由载体在染色体上的整合位置、启动子的强度、转录产物的稳定性、mRNA的翻译效率、目的蛋白的折叠效率以及目的蛋白的稳定性等因素决定,其中前4个因素均与表达载体的选择有关[13]。所以表达载体的选择是决定外源蛋白在哺乳动物细胞中表达量的关键,而启动子的强度对于基因的表达起着决定性的作用。常用的启动子有巨细胞病毒即早期启动子 (PCMV- IE) 、 人延伸因子1α亚基启动子 (PEF-1α)和 Rous肉瘤长末端重复序列等。本实验选用含有人延伸因子1α亚基启动子(PEF1α)的哺乳动物表达载体pEF1α- IRES-AcGFP用于目的基因PAX6的表达。启动子PEF1α具有不受细胞周期影响,启动子强度高等优点,可使PEF1α启动子下游的蛋白实现高表达,也适用于难转的细胞,有利于转染和外源蛋白的大量扩增[12]。且该载体的多克隆位点中有一个IRES元件,可在PEF1α启动子驱动下转录为双顺反子,实现目的基因与绿色荧光报告基因(AcGFP)独立翻译[13]。此外,该载体能够在流式细胞仪中高效稳定检测或瞬时转染哺乳动物细胞表达目的基因与AcGFP,且可以用G418筛选稳定转染细胞株,有利于后续转染胚胎干细胞。
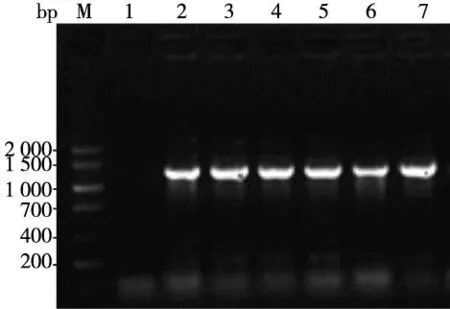
注:M为DNA Marker V,泳道1为阴性对照,泳道2~7为PAX6基因片段图3 菌液PCR鉴定重组质粒pEF1α-PAX6-IRES-AcGFP Fig.3 The electrophoresis of bacterial colony PCR product of plasmid pEF1α-PAX6-IRES-AcGFP

注:泳道M为DNA marker IV,泳道1为pEF1α-IRES-AcGFP双酶切结果,泳道2为重组质粒pEF1α-PAX6-IRES-AcGFP双酶切图4 SalI/BamHI双酶切鉴定真核质粒pEF1α-PAX6-IRES-AcGFPFig.4 The electrophoresis of plasmid pEF1α-IRES-PAX6-AcGFP digested product by SalI and BamHI

注:A1、B1和C1为显微镜(×200)明场下的293FT细胞;A2 、B2和C2为显微镜(×200)488 nm波长激发光下的293FT细胞图5 真核质粒pEF1α-PAX6-IRES-AcGFP转染293FT细胞24 h后镜下观察(200×)Fig.5 Transfected ppEF1α-PAX6-IRES-AcGFP into 293FT cells

图6 转染后293FT细胞中PAX6蛋白表达Fig.6 The protein expression after PAX6 transfection in 293FT cell by western blotting analysis
在克隆目的基因PAX6时,本研究先将PAX6连接于T载体,测序正确后,再经酶切定向插入到真核载体。T载体是TA克隆载体的简称,是一种能够直接克隆PCR产物的工具,本研究采用的pUCm-T载体是一种已经线性化的载体,载体每条链的3’端带有一个突出的T(脱氧胸苷),载体的两端可以和PCR产物的两端进行正确的AT配对,在连接酶的催化下,可以把PCR产物连接到pUCm-T载体中,形成含有目的片断的重组载体,能够满足基因保存和测序的需要[14-15],且能克服常规方法中载体自连、过程复杂、克隆效率低等不足,提高了连接效率和阳性率。293FT细胞是一种改装过的人胚肾细胞,由293细胞派生,FT的含义就是带有能复制(F)的SV40大T抗原,含有SV40复制起始点与启动子区的质粒可以复制,比较容易转染,被广泛应用于瞬时转染以过表达各种目标蛋白。脂质体转染法是利用脂质体脂质双分子层的融合及内吞作用使外源基因PAX6进入293FT细胞。
PAX6基因是PAX基因家族成员,是控制着眼球形态发生的一个重要调节基因[4-6],在眼、神经系统、鼻、胰腺和内分泌等组织器官的发育中起着重要作用,广泛参与细胞增殖迁移分化和黏附等生命活动[7-8]。在眼睛发育过程中,PAX6从胚胎第8天表达,时间早于任何形态学分化[9],表面外胚层中, PAX6表达于眼睛发育最原始的阶段,基板形成前PAX6就已经表达,一直持续表达到晶状体分化,最终存在于成人晶状体和角膜上皮,是眼发育的主控基因[3, 11]。Ouyang[3]的研究发现,将PAX6转到皮肤上皮干细胞(Skin epithelial stem cells, SECs)中时,发现其可以充分地将SECs转变为表达K5/K14的样细胞,再将此细胞移植应用于角膜上皮缺损的兔子模型中发现,移植的细胞最初位于角膜缘的地区,然后逐步向中央角膜与相应的区域移动,3个月后,成功修复缺损的角膜并维持正常的角膜透明度。而将敲除PAX6基因的兔LSCs移植到此模型并不能修复角膜损伤,提示PAX6在修复角膜损伤中起到决定性的作用。由于LSCs获得的局限性,本课题构建携带眼发育关键基因PAX6的真核表达载体,初步探究其在真核细胞的表达,再进一步探讨PAX6转染胚胎干细胞并进一步诱导胚胎干细胞定向分化为LSCs,以期建立稳定细胞株,为角膜损伤提供种子细胞。
本课题成功构建重组真核表达载体pEF1α-PAX6-IRES-AcGFP,并通过脂质体转染法将重组载体转入293FT细胞,转染24 h后荧光显微镜下观察到绿色荧光,Western blot结果显示转染重组质粒组PAX6蛋白高表达,未转染组和转染空质粒组没有PAX6蛋白表达,证明过表达质粒成功转染了293FT细胞并建立了PAX6过表达的293FT细胞瞬时转染模型,为后续研究中PAX6在真核细胞中的调节作用及PAX6转染胚胎干细胞诱导分化为角膜缘干细胞实验奠定了基础。
4参考文献
[1] Ordonez P, Girolamo ND. Limbal epithelial stem cells: role of the niche microenvironment[J]. Stem cells, 2012(2):100-107.
[2] Yoon JJ, Ismail S, Sherwin T. Limbal stem cells: Central concepts of corneal epithelial homeostasis[J]. World journal of stem cells, 2014(4):391.
[3] Ouyang H, Yuanchao X, Ying L, et al. WNT7A and PAX6 define corneal epithelium homeostasis and pathogenesis[J]. Nature, 2014(2):358-361.
[4] Shaham O, Menuchin Y, Farhy C, et al. Pax6: A multi-level regulator of ocular development[J]. Progress in Retinal and Eye Research, 2012(5):351-376.
[5] Ashery-Padan R ,Gruss P. Pax6 lights-up the way for eye development[J]. Current Opinion in Cell Biology, 2001(6):706-714.
[6] Xu S, Sunferland ME, Coles BLK, et al. The proliferation and expansion of retinal stem cells require functional Pax6[J]. Developmental Biology, 2007(2):713-721.
[7] Noll M. Evolution and role of Pax genes[J]. Current Opinion in Genetics & Development, 1993(4):595-605.
[9] Yao JG, Weasner BM, Wang LH, et al. Differential requirements for the Pax6(5a) genes eyegone and twin of eyegone during eye development in Drosophila[J]. Developmental Biology, 2008(2):535-551.
[10]Gehring WJ, Ikeo K. Pax6: mastering eye morphogenesis and eye evolution[J]. Trends in Genetics, 1999(9):371-377.
[11]Kozmik Z. The role of Pax genes in eye evolution[J]. Brain Research Bulletin, 2008(2-4):335-339.
[12]Novosylna O, Jurewicz E, Pydiura N, et al. Translation elongation factor eEF1A1 is a novel partner of a multifunctional protein Sgt1[J]. Biochimie, 2015(119):137-145.
[13]Abdul Mutalib NE, Matlsa N, Alitheen NB, et al. IRES-incorporated lactococcal bicistronic vector for target gene expression in a eukaryotic system[J]. Plasmid, 2014(73):26-33.
[14]Peng RH, Xiong AS, Liu J, et al. Adenosine added on the primer 5′ end improved TA cloning efficiency of polymerase chain reaction products[J]. Analytical Biochemistry, 2007(1):163-165.
[15]Adachi Y, Fukuhara C.TA strategy for rapid and efficient site-directed mutagenesis[J]. Analytical Biochemistry, 2012(1):66-68.
(2015-12-05收稿,2016-02-22修回)
中文编辑: 吴昌学; 英文编辑: 刘华
Construction and Authenticate of Eukaryotic Expression Vector with Rat PAX6
YAN Huiwen, SU Min, GAO Jie, LIAO Wenping, YAN Lili, HUANG Yue
(DepartmentofHistologyandEmbryology,GuizhouMedicalUniversity,Guiyang,Guizhou, 550004)
[Abstract]Objective: To construct a green fluorescence protein report gene (GFP) and an eukaryotic expression vector of rat PAX6 gene and, observe its expression in 293FT cells. Methods: The rat PAX6 gene was amplified by Polymerase Chain Reaction (PCR). After verified correctness of sequencing by connection with T vector, the recombinant products of the pEF1α-PAX6-IRES-AcGFP were gained by T4 ligase connecting pUCm-T-PAX6 and eukaryotic expression vector pEF1α-IRES-AcGFP with restriction enzymes SalⅠ/BamH. After identified by colony PCR and sequencing, pEF1α-PAX6-IRES-AcGFP was transfected into 293FT cells with Lipofectamine(®)2000 assay. The expression of PAX6 protein and GFP were detected by western blot and fluorescence microscope. Results: A specific band of 1269bp was detected from recombinant plasmid pEF1α-PAX6-IRES-AcGFP by digestion of SalⅠand BamHⅠand RT-PCR. Sequencing and identification showed that homology between this sequence and the rat PAX6 gene sequence from GenBank was 100%, and the size and the direction of the inserted gene were right. After transfection, 293FT cells showed green fluorescence under fluorescence microscope. A band of PAX6 protein from cells was detected by western blot assay. Conclusion: The eukaryotic expression vector of PAX6 is constructed successfully and can obtain high PAX6 protein expression in 293FT cells.
[Key words]green fluorescence protein; PAX6 gene; expression vector,eukaryotic; lipofectamine; transfection
[中图分类号]R329.2
[文献标识码]A
[文章编号]1000-2707(2016)03-0288-06
*[基金项目]贵州省科技厅基金[黔科合J字(2015)2011号]; 贵州省优秀科技教育人才省长专项资金项目[黔省专合字(2012)41号]
**贵州医科大学2013级硕士研究生
***通信作者 E-mail:huranggaigaiyu@sina.com
网络出版时间:2016-03-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160317.1106.058.html
