不同时机早期肠内营养对重症急性胰腺炎大鼠肠黏膜屏障的影响
2016-04-23李峰徐传博夏红星谢荣俊王辉南华大学附属南华医院普外科湖南衡阳421002
李峰,徐传博,夏红星,谢荣俊,王辉(南华大学附属南华医院 普外科,湖南 衡阳 421002)
不同时机早期肠内营养对重症急性胰腺炎大鼠肠黏膜屏障的影响
李峰,徐传博,夏红星,谢荣俊,王辉
(南华大学附属南华医院普外科,湖南衡阳421002)
[摘 要]目的 研究不同时机启动早期肠内营养(enteral nutrition,EN)对重症急性胰腺炎(severe acute pancreatitis,SAP)大鼠肠黏膜屏障功能和结构的影响。方法 将75只健康雄性大鼠随机分为空白组(S组,n=15)、实验组(EN组,又分为EN-1、EN-2和EN-3组,各n=15)和对照组(TPN组,n=15)。S组仅翻动内脏,余组建立SAP模型。造模后,S组正常喂食;TPN组采用肠外营养;EN-1、EN-2和EN-3组分别于建模后第1、2、4天启动EN。各组于建模后第2、3、5天分别处死5只大鼠,心脏采血检测淀粉酶(amylase,AMS)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-10(interleukin-10,IL-10)、血清内毒素(endotoxin,ET)的变化,取末端回肠作病理组织学检查并评分。结果 建模后第2天,空白组与EN组、对照组各指标差异有统计学意义(P<0.01),EN组和对照组四组之间差异均无统计学意义(P均>0.05);建模后第3、5天,EN组各指标低于对照组,随着治疗持续,四组指标水平均呈下降趋势(P<0.05),EN-1组下降最明显。结论 启动早期EN利于控制胰腺炎和保护肠道黏膜屏障,越早启动越有利。
[关键词]重症急性胰腺炎;肠内营养;肠黏膜屏障;大鼠
Effect of early enteral nutrition at different periods on intestinal mucosa barrier in rats with severe acute pancreatitis
LI Feng,XU Chuan-bo,XIA Hong-xing,XIE Rong-jun,WANG Hui.Department of General Surgery,Nanhua Hospital Affiliated to University of South China,Hengyang,Hunan 421002,China
Abstract objectiveTo investigate the effect of early enteral nutrition(EN)at different period on intestinal mucosa barrier and pathology in rats with severe acute pancreatitis(SAP).MethodsA total of 75 male rats were randomly allocated into following groups:blank group(S group,n=15),experimental group(EN group,45 rats were then randomly divided into EN-1,EN-2 and EN-3 sub group,each n=15)and control group(TPN group,n=15).Rats in S group only had their viscera turned,while rats in other two groups were used to establish severe acute pancreatitis model.After successful modeling,the S group received normal diet,the TPN group received support and treatment by total parenteral nutrition.EN-1,EN-2 and EN-3 subgroup respectively started enteral nutrition at day 1,day 2 and day 4 after modeling.At the day 2,day 3 and day 5 after modeling,5 rats in each group were sacrificed.Then the heart blood sampling were taken to detect serum levels of amylase(AMS),tumor necrosis factor-α(TNF-a),interleukin-10(IL-10)and endotoxin(ET),and the terminal ileum tissue was taken for histopathologic examination and evaluation.ResultsAt day 2,compared with EN subgroups and TPN group,indexes in S group were significantly different(P<0.01),and there was no significant difference between EN groups and TPN group(P>0.05).At day 3 and day 5,indexes in EN group were lower than those in TPN group,and these four groups showed a downward trend along with the treatment(P<0.05).The EN-1 group decreased most significantly.ConclusionStarting early enteral nutrition can control the progress of SAP in rats,and protect intestinal mucosal barrier,the sooner the better.
Key words severe acute pancreatitis; enteral nutrition; intestinal mucosa barrier; rats
重症急性胰腺炎(severe acute pancreatitis,SAP)是常见临床危重急症,发病机制复杂,病死率高,可达30%以上[1]。SAP病程早期可发生肠道黏膜屏障损伤,导致肠道细菌和内毒素移位,继发胰腺坏死组织及胰周积液感染,产生内毒素血症,随即介导发生全身炎症反应综合征(systemic-inflammatory response syndrome,SIRS),最后可致多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),危及患者生命[2-3]。EN可有效改善SAP时的肠黏膜屏障功能障碍,已广泛应用于临床。然而EN治疗SAP的启动时机存在争议,国外多主张入院2~3 d内启动EN支持治疗,国内普遍认为需在患者胃肠道各项指标恢复正常后再启动EN。本研究采用SAP大鼠模型,选择不同时机启动EN治疗,探讨其对肠黏膜屏障功能和结构的影响,为EEN治疗SAP提供理论基础及实验基础。
1 材料和方法
1.1实验材料
雄性SD大鼠75只,(300±20)g/只(南华大学实验动物室);牛磺胆酸钠(Sigma公司);鼠TNF-α、IL-10 ELISA试剂盒和内毒素检测鲎试剂盒(慧嘉生物科技有限公司);乙二胺四乙酸(南华大学心血管研究所);百普力(纽迪希亚制药有限公司);7%复方氨基酸、20%中长链脂肪乳剂、50%葡萄糖注射液、安达美、水乐维他、维他利匹特(均为华瑞制药有限公司产品)。
1.2方法
1.2.1动物分组:大鼠适应性喂养1周,随机分组:空白组(S组,15只)、实验组(EN组,45只)和对照组(TPN组,15只);按EN启动时机,EN组又分为3小组:EN1、EN2、EN3,各15只。
1.2.2模型制备:术前禁食12 h,不禁水;10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉;无菌条件下,剖腹,行逆行胰胆管造模[4]:细针刺穿胰腺对侧十二指肠,硬膜外导管(直径0.8~1.0 mm)沿肠壁进入通过壶腹部乳头逆行推进胰胆管,血管夹夹闭胆胰管近肝门处和胰胆管近壶腹部乳头开口处,以0.2 mL/min向胆胰管逆行灌注3.5%硫磺胆酸钠(0.01 mL/g),注射完毕后见胰腺组织充血、水肿和被膜下散在出血点,标志造模成功。S组只对胰腺轻轻翻动数次,不做SAP造模。各组均行空肠置管造瘘术和颈外静脉插管术:(1)空肠置管造瘘术:选取幽门处插入直径1.0~1.2 mm无菌硅胶管,远端到达屈氏韧带以下5 cm,固定、经皮下隧道引出至颈背部肩胛间引出。(2)颈外静脉插管术:钝性分离出右颈外静脉,置入直径0.8~1.0 mm硅胶管,皮下隧道潜行至颈背部引出。静脉营养管和空肠造瘘管一起经皮下隧道于从背部两耳间皮肤穿出并固定,导管外套细弹簧(直径1.5~2.0 mm)防止老鼠牙齿咬断,每天肝素生理盐水(25 U/mL)封管。
1.2.3营养支持方法:S组术后禁食6 h后逐渐恢复正常喂养;TPN组于术后8 h起给予TPN(PN营养液组成:每100 mL中含57 mL凡命、19.5 mL中长链脂肪乳剂、22 mL 50%葡萄糖注射液和安达美、水乐维他、维他利匹特各0.5 mL),速度由1 mL/h逐渐增加,至24 h总输液量为25 mL,能量达到125 kcal/(kg·d),之后每天输液50 mL,即250 kcal/(kg·d);EN-1组、EN-2组、EN-3组分别于术后第1天(EN-1)、第2天(EN-2)、第4天(EN-3)场内间歇注入EN营养液,EN组在启动EN前均用平衡液静脉营养支持,各组启动EN第1天,肠内营养液为百普力125 kcal/(kg·d),之后每天达到250 kcal/(kg·d),微量输液泵维持。两种营养液的热卡值和含氮量基本相同,TPN组和EN组的输液量及其提供热量基本相等。营养过程中,观察大鼠适应性,根据情况调整营养液速度。
1.2.4取材:于造模后第2、3、5天三个时间点采用心脏采血法处死实验大鼠,每个时间点每组取5只大鼠。血标本加入乙二胺四乙酸抗凝,后以2 000 r/min离心20 min取血清,分为两部分;同时取末端回肠组织。
1.3观察指标及测定
(1)观察各组一般情况、腹部症状及体征、感染发生率;(2)两部分血清,一部分送检血常规、淀粉酶;一部分-80 ℃冰箱保存,ELISA法检测血清中TNF-α、IL-10水平,采用改良新过氯酸法(improved new chlorate method,PCA)预处理血浆,利用鲎试剂基质显色来检测量化ET;(3)取末端回肠组织,经固定、包埋、切片、HE染色,常规光学显微镜下观察标本(×100倍),根据Chiu等制定的回肠组织损伤评分标准[5],从黏膜、绒毛损伤及炎症、出血等情况进行肠黏膜损伤的分级,并按相应级别进行计分。
1.4统计学分析
使用SPSS19.0统计软件进行统计学分析,计量资料采用(±s)表示,多组间两两比较采用单因素分差分析;P<0.05为差异有统计学意义。
2 结果
2.1一般情况
各组大鼠术后均出现反应迟钝,活动、饮水减少等,S组最轻,术后8 h逐渐恢复正常活动;EN组大鼠一般情况较TPN组明显好转。各组均无伤口感染。
2.2各组血清淀粉酶比较
同期比较:第2天时,空白组与EN组、对照组AMS差异有统计学意义(P<0.01),EN组和对照组四组之间差异无统计学意义(P>0.05);第3、5天,EN组水平低于对照组,且随着治疗时间,四组AMS水平均呈下降趋势(P<0.05),EN-1组下降最明显,其次为EN-2组(见表1)。
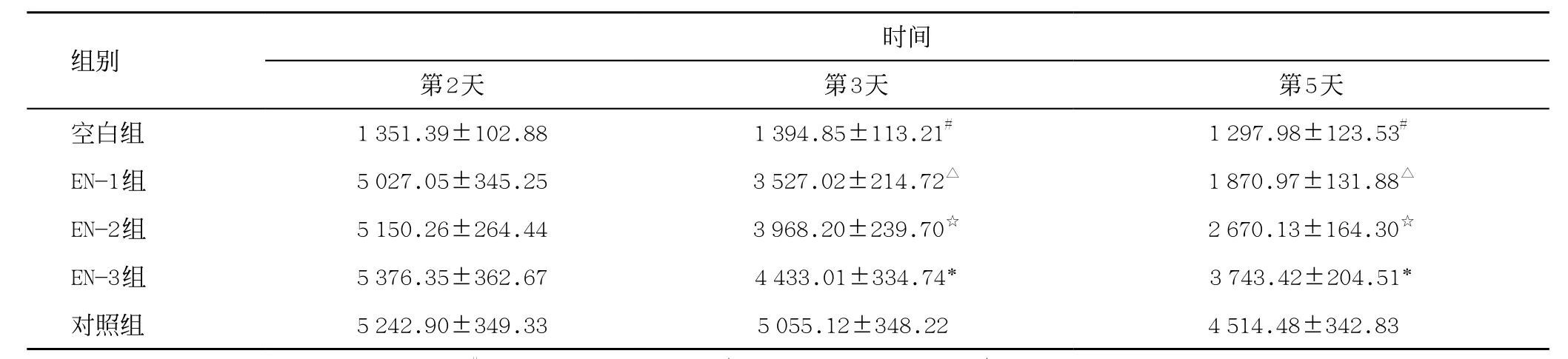
表1 各组血清淀粉酶含量比较(±s,U/L)
2.3各组炎症因子(TNF-α、IL-10、ET)比较
同期比较:第2天,空白组与EN组、对照组炎症因子(TNF-α、IL-10、ET)差异有统计学意义(P<0.01),EN组和对照组四组之间差异无统计学意义(P>0.05);第3、5天,EN组水平低于对照组,且随着治疗时间,四组炎症因子水平均呈下降趋势(P<0.05),EN-1组下降最明显,优于EN-2组(见表2)。
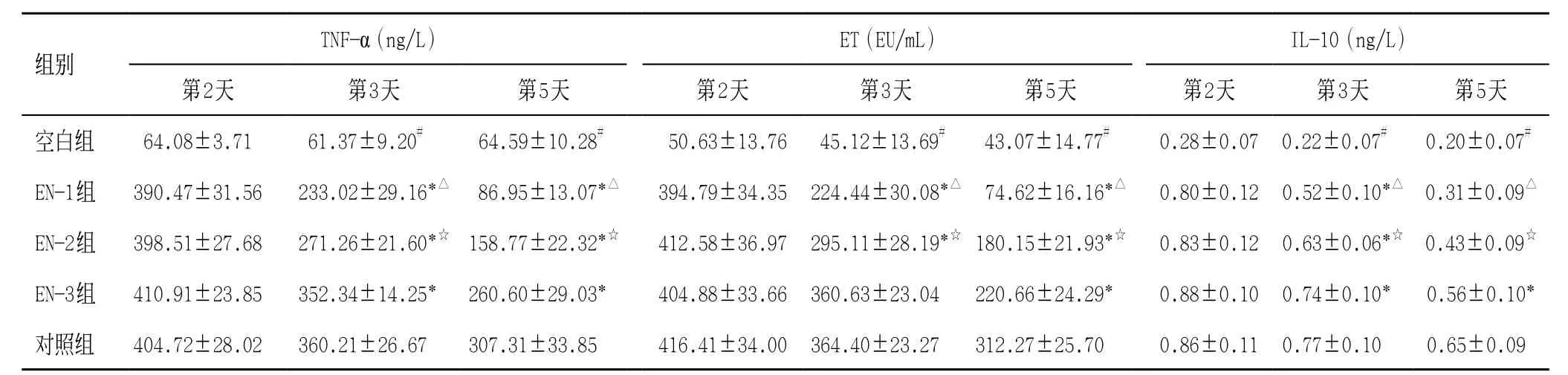
表2 各组炎症因子含量变化(±s)
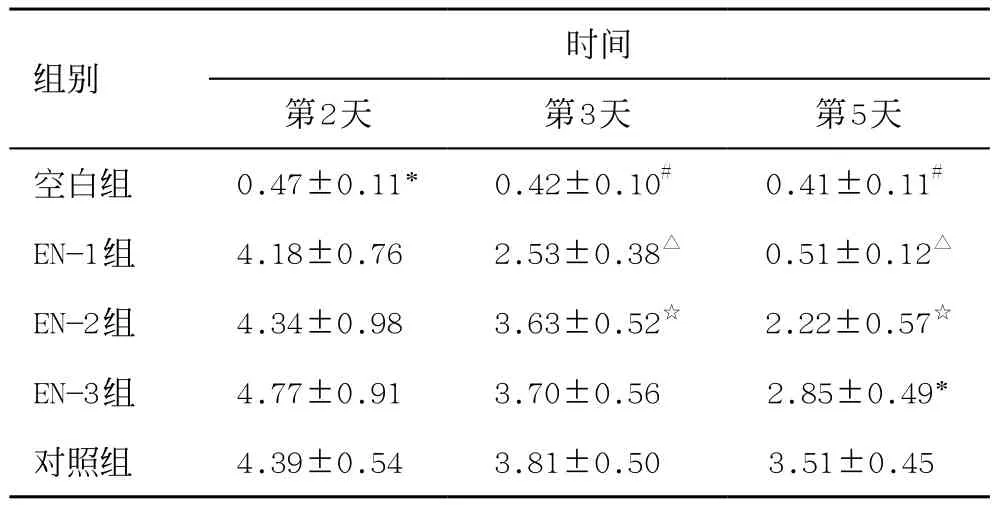
表3 各组大鼠不同时间末端回肠损伤病理评分(±s)
2.4病理学观察
各组回肠组织标本根据Chiu评分显示:同期比较:第2天,空白组与EN组、对照组评分差异有统计学意义(P<0.01),EN组和对照组四组之间差异无统计学意义(P>0.05);第3、5天,EN组评分低于对照组,且随着治疗时间,四组评分均呈下降趋势(P<0.05),EN-1组下降最明显,优于EN-2组(表3、图1)。
3 讨论
SAP是一种致死率极高的普外科急腹症,处于高代谢状态,易出现免疫功能障碍、代谢紊乱、营养恶化现象,进而发生感染甚至多器官功能衰竭,营养支持在SAP治疗过程中有重要作用[6]。过去基于“胰腺休息”观点,PN是SAP主要的营养支持方式[7]。经许多研究发现,PN虽满足高代谢需要且对胰腺分泌没有明显刺激,但长期PN使肠道失去食物刺激,导致肠黏膜萎缩和肠屏障受损,随之发生肠源性细菌或内毒素移位,诱发加重SIRS和MOD,成为胰腺及胰周组织继发感染的主要原因[8-9]。EN符合肠道生理需要,通过空肠营养不会导致胰腺分泌增加,不仅可以促进肠道恢复,并可维持肠道机械、生物及免疫屏障功能,减少肠源性感染及感染性并发症的发生[10]。目前许多文献关于EN的启动时机尚存在争议。目前国内一些学术研究认为,最好在基本恢复胃肠功能后,早期EN应该是发病2~3天之后,确认患者生命体征基本稳定,提倡谨慎使用[11]。然而也有学者认为,更早地启动EN可以显著降低感染、MODS发生率和病死率[12-13]。本研究从EN对大鼠肠黏膜屏障功能和结构影响的角度入手,对早期EN启动具体时机做出探讨。
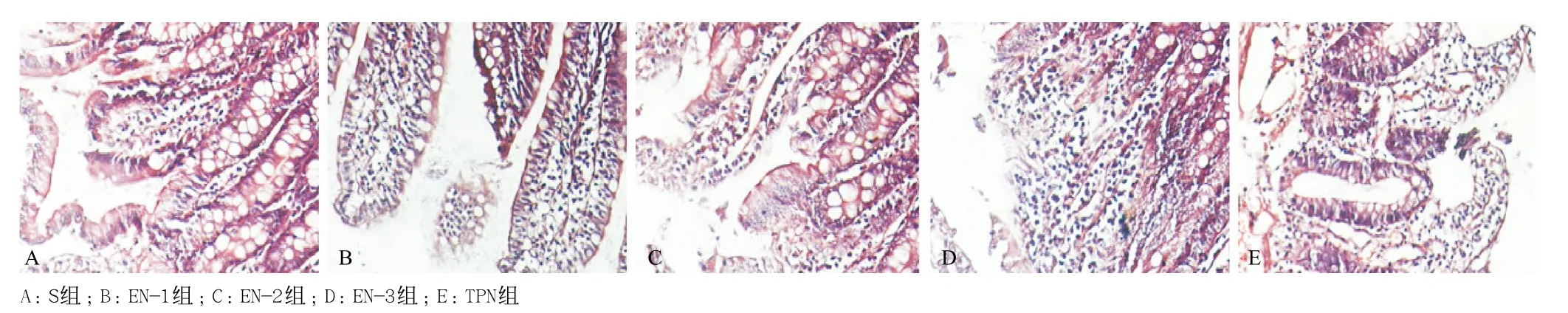
图1 各组SD大鼠回肠病理学变化(HE,×100)
在本实验中可以观察到,EN组和TPN组造模后AMS明显升高,结合造模时胰腺表现,说明大鼠SAP造模达到实验所需。
肠黏膜屏障分为机械屏障、微生物屏障、免疫屏障和化学屏障[14]。肠道的屏障功能在正常生理情况可有效防止肠道细菌和内毒素(ET)易位。但人体在创伤、疾病时,肠黏膜结构和屏障功能可以被严重损坏,然后二次肠道细菌和内毒素易位,肠外器官感染,造成机体致命的伤害。SAP时,肠道淋巴组织可释放大量全身性炎症反应因子,包括IL-1、IL-2、IL-6、IL-8、IL-10、TNF等[15],但无法通过功能正常的肠道黏膜屏障。当肠黏膜屏障功能受损引起肠黏膜通透性增加时,即可通过肠黏膜入血,可在外周血中检测到[16]。故临床上可用内毒素的变化判断肠黏膜通透性完整性,进而推测疾病是否损伤肠黏膜屏障功能。通过检测心脏血TNF-α、IL-10炎症指标间接反映肠黏膜损伤严重性。本实验SAP造模后,EN组在第2天时与TPN组ET和炎症因子水平无显著差异,第3、5天较TPN组治疗后降低,说明EN有利于减少肠道对内毒素的吸收和对TNF-α、IL-10的释放;第3、5天,EN组三组两两比较差异有统计学意义,而EN-1组下降幅度最大,在第5天时更接近S组水平,说明EN-1组大鼠肠道黏膜屏障恢复最快,其次EN-2组,提示越早启动EN,越能保护肠道膜屏障,有效控制ET升高,减轻炎症反应。
在肠道病理学改变和评分方面,S组改变最轻、评分最低,TPN组肠道黏膜和绒毛情况比EN组明显要差:固有层充血水肿,血管扩张,炎性细胞浸润,肠绒毛破坏脱落,肠道发现肠黏膜脱落。回肠病理学说明EN-1组在保护肠道屏障结构具有优越性。
参考文献:
[1]钱家鸣.再谈我国急性胰腺炎的病因与治疗[J ].中华内科杂志,2007,46(12):979 -980.
[2]芦波,钱家鸣.重症急性胰腺炎病因及发病机制研究进展[J].中华实用外科杂志,2012,32(7):590-592.
[3]TELLADO J M.Prevention of infection following severe acute panceatitis[J].Curr Opin Crit Care,2007,13(4):416-420.
[4]WIEST R,RATH H C.Bacterial translocation in the gut[J].Best Pract Res Clin Gastroenterol,2003,17(3):397-425.
[5]CHIU C J,MARDLE A H,BORWN R,et al.Intestinal mucosal lesion in low flow state[J].Arch Surg,1970,101(4):478-483.
[6]PA BANKS T L B,C DERVENIS H G G.Classification of acute pancreatitis—2012:revision of the atlanta classification and definitions by international consensus[J].Gut,2013,62(1):102-111.
[7]YI F,GE L,ZHAO J,ET AL.Meta-analysis:total parenteral nutrition versus total enteral nutrition in predicted severe acute pancreatitis[J].Intern Med,2012,51(6):523-530.
[8]KALFARENTZOS F E,KARAVIAS D D,KARATZAS T M,et al.Total parenteral nutrition in severe acute pancreatitis[J].J Am Coll Nut,1991,10(2):156-162.
[9]周晏林,杜蓉,肖光荣,等.全肠内营养支持对急性重症胰腺炎患者预后影响的临床观察[J].华西医学,2010,(12):2185-2188.
[10]李淑德.重症急性胰腺炎治疗研究进展[J ].世界华人消化杂志,2010,18(3):213 -216.
[11]中华医学会外科学分会胰腺外科学组.急性胰腺炎诊治指南[J].中华外科杂志,2015,53(1):50-53.
[12]WERESZCZYNSKA-SIEMIATKOWSKA U,SWIDNICKASIERGIEJKO A,SIEMIATKOWSKI A,et al.Early enteral
nutrition is superior to delayed enteral nutrition for the prevention of infected necrosis and mortality in acute pancreatitis[J].Pancreas,2013,42(4):640-646.
[13]杨尚柱,杨海清.肠内营养时机的选择对急性重症胰腺炎预后的影响[J].肝胆胰外科杂志,2013,25(4):330 -333.
[14]PURI Y,RAHMAN S H.Successful management of gastrointestinal haemorrhage associated with ischaemic colonic ulceration in acute pancreatitis with video assisted retroperitoneal debridement[J].J Pancreas,2011,12(3):271-273.
[15]CHEROUTRE H.Starting at the beginning:new perspectives on the biology of mucosal T cells[J].Annu Rev Immunol,2004,22:217-246.
[16]夏亮,陈江,苏宏领,等.细胞因子在急性坏死性胰腺炎大鼠肠黏膜中的表达和意义[J].中国现代医学杂志,2013,23(9):5-9.
(本文编辑:鲁翠涛)
·经验交流·
·论著 基础研究·
作者简介][第一李峰(1979-),男,湖南衡阳人,主任医师,副教授。
[基金项目]湖南省教育厅医学科研项目(09C848)。
[收稿日期]2015-09-01
[中图分类号]R576
[文献标识码]A
doi:10.11952/j.issn.1007-1954.2016.02.010
