CnIH侧脑室注射后大鼠下丘脑组织中神经肽Y mRNA及蛋白表达变化
2016-04-18苏玮魏萌冯超杨正江陈心悦程露阳杨松鹤乔跃兵
苏玮,魏萌,冯超,杨正江,陈心悦,程露阳,杨松鹤,乔跃兵,2
(1承德医学院,河北承德067000;2沧州医学高等专科学校)
·基础研究·
CnIH侧脑室注射后大鼠下丘脑组织中神经肽Y mRNA及蛋白表达变化
苏玮1,魏萌1,冯超1,杨正江1,陈心悦1,程露阳1,杨松鹤1,乔跃兵1,2
(1承德医学院,河北承德067000;2沧州医学高等专科学校)
摘要:目的观察促性腺激素抑制激素(GnIH)侧脑室注射后大鼠下丘脑组织中神经肽Y(NPY)mRNA及蛋白表达变化。方法 雄性SD大鼠60只,随机分为实验组和对照组各30只,分别给予侧脑室注射GnIH(1 μg/μL,5 μL)和生理盐水(5 μL),分别于注射1、2、4 h后各处死10只,取下丘脑组织。采用real-time PCR法检测NPY mRNA,免疫印迹法检测NPY蛋白。结果实验组注射后1、2、4 h下丘脑组织中NPY mRNA相对表达量分别为0.759±0.025、1.755±0.219、2.671±0.696,NPY蛋白相对表达量分别为0.225±0.015、0.244±0.015、0.264±0.009;对照组分别为0.633±0.021、0.568±0.006、0.631±0.015和0.113±0.004、0.125±0.007、0.128±0.011。两组注射后2、4 h NPY mRNA表达量相比,P均<0.05;两组注射后各时点NPY蛋白表达量比较,P均<0.05。结论 GnIH侧脑室注射后,大鼠下丘脑组织中NPY mRNA及蛋白表达上调。
关键词:促性腺激素抑制激素;神经肽Y;下丘脑;动物实验
促性腺激素抑制激素(GnIH)可通过一种新的G蛋白耦联受体(GPR147)直接作用于垂体和下丘脑的促进腺激素释放激素(GnRH)神经元,抑制促性腺激素释放和合成[1],减少黄体生成素(LH)和卵泡刺激素(FSH)生成。GnIH还可能通过其他神经元发挥调控生殖的作用,如神经肽Y(NPY)。NPY神经元主要位于下丘脑弓状核[2],在调控摄食和能量平衡及生殖神经内分泌方面起重要作用。GnIH能够抑制GnRH的释放与合成,对于GnIH是否可通过NPY神经元间接作用于GnRH尚不清楚。为此,我们观察了GnIH侧脑室注射后大鼠下丘脑组织中NPY mRNA及蛋白的表达变化。
1材料与方法
1.1动物与材料健康成年雄性SD大鼠60只(北京华阜康生物科技股份有限公司),分笼喂养,自由饮水,12 h/12 h循环光照。GnIH购自美国Peprotech公司;脑立体定位仪购自日本Narishige公司;微量注射器购自上海济成分析仪器有限公司。
1.2动物分组及GnIH侧脑室注射方法60只大鼠适应两周后,随机分为实验组和对照组各30只。两组大鼠固定于脑立体定位仪上,10%水合氯醛腹腔注射麻醉,头顶备皮,碘酒消毒,纵向正中切开头顶皮肤,暴露颅骨。根据《The Rat Brainin Stereotaxic Coordinates》第3版中的方法进行侧脑室定位。实验组注射GnIH(1 μg/μL,5 μL),对照组注射生理盐水(5 μL),于5 min内完成。分别于注射1、2、4 h 后,每小时组各取10只大鼠处死,迅速去除全脑,剥离下丘脑,用于后续实验。
1.3大鼠下丘脑组织中NPY mRNA检测取两组下丘脑组织,提取总RNA,紫外分光光度计测RNA浓度和纯度后逆转录为cDNA,进行PCR反应。NPY mRNA上游引物序列为5′-TCCGCTCTGCGACACTACATC-3′,下游引物序列为5′-AAGGGTCTTCAAGCCTTGTTCTG-3′,产物长度136 bp;内参GAPDH mRNA上游引物序列为5′-GGCACAGTCAAGGCTGAGAATG-3′,下游引物序列为5′-ATGGTGGTGAAGACGCCAGTA-3′,产物长度143 bp。PCR反应条件:94 ℃ 2 min,94 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s,72 ℃ 5 min,共30个循环。反应产物经2%琼脂糖凝胶电泳后分析对比灰度值。
1.4大鼠下丘脑组织中NPY蛋白检测将下丘脑制成组织匀浆,冰上放置40 min,12 000 r/min 4 ℃离心20 min,取上清。用BCA试剂盒进行蛋白定量。配12%分离胶、5%浓缩胶,SDS-PAGE分离的蛋白经转膜转至PVDF膜上,用含5%脱脂奶粉的TBST缓冲液封闭4 ℃过夜,加入一抗(兔抗NPY多克隆抗体1∶1 000,鼠抗β-actin单抗1∶1 000)室温孵育5 h,洗膜后加入二抗(羊抗兔IgG 1∶1 000,羊抗小鼠IgG 1∶1 000),室温孵育1 h,洗膜,化学发光显影,定影,冲洗晾干备用。以Quantity One4.62软件分析条带平均灰度值,代表蛋白相对表达量。
2结果
实验组注射后2、4 h下丘脑组织中NPY mRNA表达量高于对照组(P均<0.05);实验组注射后各时点NPY蛋白量表达高于对照组(P均<0.05)。详见表1。
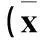
表1 两组注射后不同时点下丘脑组织中NPY mRNA
注:与同时点对照组相比,*P<0.05。
3讨论
下丘脑是调节摄食和能量平衡的中心[3]。动物生殖功能与下丘脑-垂体-性腺轴(HPG)密切相关,自然环境、社会因素及个体能量代谢状态也会通过神经内分泌系统作用于GnRH进而影响HPG轴,一些神经内分泌因子可通过调节GnRH活性影响生殖功能。GnRH以脉冲方式分泌,是调控性腺活动的关键因素。
GnIH是一种含有12个氨基酸的神经肽,有广泛的生物活性,以剂量依赖性抑制前垂体细胞分泌GnRH[1]。一项关于鸟类的研究表明,GnIH可作用于GnRH神经元上的受体,抑制GnRH释放[4]。大量哺乳动物研究也发现,GnIH神经纤维与GnRH神经元有紧密接触[5]。哺乳动物GnIH同系物(RFRP)神经元主要存在下丘脑背内侧核,该区域是调节食欲和能量平衡的中心,因此推测RFRP与摄食行为相关。GnIH促进摄食作用在雄性大鼠和雌性大鼠研究中也得到证实[2,6,7]。有学者[8]发现羊的RFRP神经元投射到NPY集中分布的大脑区域,推测GnIH与NPY存在一定联系。
下丘脑GnRH的表达受多种内源性因素影响,NPY是内源性因子之一,其由下丘脑神经元分泌与合成,广泛存在于中枢和外周神经系统,可调节性成熟和机体能量代谢[9,10]。目前研究[11]表明,NPY受体表达在GnRH神经元上,并通过轴突与GnRH神经元连接,因此推测GnIH还可能通过作用于下丘脑NPY神经元发挥对下丘脑GnRH神经元的调节作用。
本实验于大鼠侧脑室微量注射GnIH,并于注射后1、2、4 h观察GnIH对大鼠下丘脑组织中NPY mRNA及蛋白表达的影响,结果显示,与对照组相比,实验组NPY mRNA和蛋白表达明显增多,提示侧脑室注射GnIH后可能在一定时间内对大鼠下丘脑NPY神经元起到正反馈调节作用。注射GnIH后随着时间延长,GnIH对NPY是否仍有促进作用尚未明确,我们将在今后研究中加以验证。
参考文献:
[1] Ukena K, Ubuka T, Tsutsui K. Distribution of a novel avian gonadotrophin-inhibitory hormone in the quail brain[J]. Cell Tissue Res, 2003,312(1):73-79.
[2] Tachibana T, Sato M, Takahashi H, et al. Gonadotrophin-inhibiting hormone stimulates feeding behavior in chicks[J]. Brain Res, 2005,1050(1-2):94-100.
[3] 龚雅婷,史小林,牛晶晶,等.下丘脑炎症和肥胖发病机制[J].辽宁中医药大学学报,2014,16(7):85-88.
[4] Tsutsui K. A new key neurohormone controlling reproduction, gonadotropin-inhibitory hormone(GnIH): Biosynthesis,mode of action and functional significance[J]. Prog Neurobiol, 2009,88(1):76-88.
[5] Clarke IJ, Qi Y, Puspita Sari I, et al. Evidence that RF-amide related peptides are inhibitors of reproduction in mammals[J]. Front Neuroendocrinol, 2009,30(3):371-378.
[6] Johnson MA, Tsutsui K, Fraley GS. Rat RFamide-related peptide-3 stimulates GH secretion, inhibits LH secretion,and has variable effects on sex behavior in the adult male rat [J]. Horm Behav, 2007,51(1):171-180.
[7] Murakami M, Matsuzak I, Iwasa TI, et al. Hypophysiotropic role of RFamide-related peptide-3 in the inhibition of LH secretion in female rats[J]. J Endocrinol, 2008,199(1):105-112.
[8] Qi Y, Oldfield BJ, Clarke IJ. Projections of RFamide-related peptide-3 neurones in the ovine hypothalamus,with special reference to regions regulating energy balance and reproduction[J]. J Neuroendocrinol, 2009,21(8):690-697.
[9] 倪迎冬,周玉传,王亚菊,等.长短日照下绍鸭性成熟时间、下丘脑GnRH-I、POMC和NPY mRNA表达的差异[J].动物学研究,2005,26(5):539-544.
[10] Bi S, Kim YJ, Zheng F. Dorsomedial hypothalamic NPY and energy balance control[J]. Neuropeptides(Edinburgh), 2012,46(6):309-314.
[11] Fetissov SO, Kopp J, Hokfelt T. Distribution of NPY receptors in the hypothalamus[J]. Neuropeptides, 2004,38(4):175-188.
(收稿日期:2015-10-24)
中图分类号:R322.81
文献标志码:A
文章编号:1002-266X(2016)07-0027-02
doi:10.3969/j.issn.1002-266X.2016.07.009
通信作者:乔跃兵(E-mail: chengll526@126.com)
基金项目:河北省自然科学基金资助项目(p013406115)。
