宫颈癌组织中APC、E-cadherin、ASC及FHIT基因启动子区域甲基化观察
2016-04-18王淑琴黄利鸣钱洪鑫李红月
王淑琴,黄利鸣,钱洪鑫,李红月
(1三峡职业技术学院医学院,湖北宜昌443002;2武汉大学;3湖北社会主义学院)
·临床研究·
宫颈癌组织中APC、E-cadherin、ASC及FHIT基因启动子区域甲基化观察
王淑琴1,黄利鸣2,3,钱洪鑫1,李红月1
(1三峡职业技术学院医学院,湖北宜昌443002;2武汉大学;3湖北社会主义学院)
摘要:目的观察宫颈癌组织中结肠腺瘤性息肉病蛋白(APC)、E-钙黏蛋白(E-cadherin)、凋亡相关点状蛋白(ASC)及脆性组氨酸三联体(FHIT)基因启动子甲基化状态。方法 采用甲基化特异性聚合酶链反应(MSP)检测31例份宫颈癌组织和20例份正常宫颈上皮组织中的APC、E-cadherin、ASC、FHIT基因启动子区域甲基化。分析APC、E-cadherin、ASC、FHIT基因启动子甲基化与宫颈癌临床病理参数的关系。结果31例份宫颈癌组织中测得基因启动子区域甲基化27例份,其中APC、E-cadherin、ASC基因甲基化分别为19(61%)、17(55%)、6(19%)例份;单基因甲基化13例份,2个基因甲基化11例份,3个基因甲基化3例份。20例正常宫颈组织中均未测出基因启动子区域甲基化。宫颈癌组织中APC、E-cadherin基因启动子区域甲基化率高于正常宫颈组织(P均<0.05)。不同年龄、组织学分级及病理分期的宫颈癌患者肿瘤组织中APC、E-cadherin、ASC 基因启动子区域甲基化状态差异无统计学意义。结论 宫颈癌组织中APC、E-cadherin、ASC基因存在启动子区域甲基化,可同时有多个基因甲基化。APC、E-cadherin、ASC基因启动子区域甲基化可能参与了宫颈癌的发病。
关键词:宫颈癌;启动子区域甲基化;结肠腺瘤性息肉病蛋白;E-钙黏蛋白;凋亡相关点状蛋白;脆性组氨酸三联体
近年来研究显示,肿瘤发病与DNA甲基化模式异常有关,抑癌基因启动子区域高甲基化是抑制基因转录的重要机制[1]。目前,国内外对宫颈癌基因甲基化的研究多数集中在单个基因,而后续研究提示宫颈癌可能同时存在多个基因的启动子区域异常甲基化。本研究观察了宫颈癌组织中结肠腺瘤性息肉病蛋白(APC)、E-钙黏蛋白(E-cadherin)、凋亡相关点状蛋白(ASC)及脆性组氨酸三联体(FHIT)基因启动子区域甲基化状态,探讨基因启动子区域甲基化在宫颈癌发生发展中的作用,分析基因启动子区域甲基化状态与宫颈癌临床病理参数的关系。
1材料与方法
1.1实验标本选取2013年12月~2014年5月手术切除或门诊活检取得的宫颈癌组织31例份,患者肿瘤临床分期(FIGO)Ⅰ期16例、Ⅱ期13例、Ⅲ期2例,病理类型均为鳞状上皮癌,组织学分级G14例、G215例、G312例。患者年龄23~70岁,术前均未进行放疗及化疗。取同期良性病变行子宫切除术取得的20例份正常宫颈鳞状上皮作对照。所有标本取材后立即放入冰盒中,转入-80 ℃冰箱保存。
1.2APC、E-cadherin、ASC、FHIT基因启动子甲基化检测
1.2.1组织DNA提取采用常规的蛋白酶K消化、酚/氯仿抽提和乙醇沉淀法,无菌双蒸水溶解后用紫外分光光度计定量蛋白。A260/A280为1.6~1.8,样品-20 ℃保存备用。
1.2.2DNA的亚硫酸氢盐修饰DNA经过亚硫酸氢盐修饰后,样品DNA中所有未甲基化的胞嘧啶将被转变为尿嘧啶,而甲基化的胞嘧啶则不发生变化。取2 μg DNA,按甲基化分析试剂盒说明的操作步骤进行。
1.2.3甲基化特异性聚合酶链反应(MSP)第一轮PCR反应使用外侧引物,反应总体系25 μL, 包括经过亚硫酸氢盐修饰的DNA模版4 μL,10 mmol/L的dNTP 1 μL,10×PCR buffer 2.5 μL,引物浓度10 pmol/L,Taq酶0.5 μL,反应条件为94 ℃预变性5 min,94 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,循环35次,72 ℃延伸5 min。将第一轮PCR产物稀释300倍,取4 μL进行第二轮PCR反应,此反应使用内侧引物,反应总体系仍为25 μL,引物量为0.3 μL,其余不变,各基因的退火温度与循环数见表1,其余反应条件与第一轮PCR反应相同。同时以人外周血淋巴细胞体外甲基化的DNA(IVD)作为阳性对照,以正常人外周血淋巴细胞DNA(NL)作为阴性对照,以水作空白对照。
1.2.4扩增产物鉴定取10 μL反应产物,经2%含有溴乙锭的琼脂糖凝胶电泳,紫外成像系统下观察并照相。

表1 APC、E-cadherin、ASC、FHIT基因引物序列及产物长度
1.3统计学方法采用SPSS14.0统计软件。计数资料比较采用Fisher确切检验。以P<0.05为差异有统计学意义。
2结果
2.1宫颈癌组织中与正常宫颈组织中APC、E-cadherin、ASC、FHIT基因启动子区域甲基化情况31例份宫颈癌组织中测得基因启动子区域甲基化27例份,其中单基因甲基化13例份,2个基因甲基化11例份,3个基因甲基化3例份;APC、E-cadherin、ASC基因启动子区域甲基化分别为19(61%)、17(55%)、6(19%)例份,而FHIT基因未检测出甲基化。20例份正常宫颈组织中均未测出基因启动子区域甲基化。宫颈癌组织中APC、E-cadherin基因启动子区域甲基化率高于正常宫颈组织(P均<0.05)。
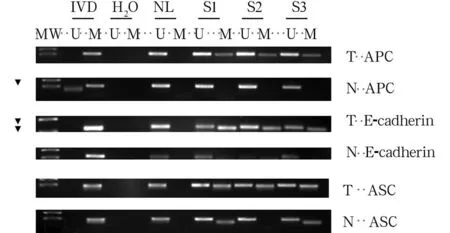
注:MW为DNA marker;IVD为甲基化阳性对照;NL为甲基化阴性对照;H2O为空白对照;S为调查样本;T为宫颈癌组织;N为正常宫颈组织。
图1宫颈癌组织与正常宫颈组织中APC、E-cadherin、
ASC、FHIT基因启动子区域甲基化检测结果
2.2APC、E-cadherin、ASC基因启动子区域甲基化与宫颈癌临床病理参数的关系不同年龄、组织学分级及病理分期的宫颈癌患者肿瘤组织中APC、E-cadherin、ASC 基因甲基化状态差异无统计学意义。见表2。
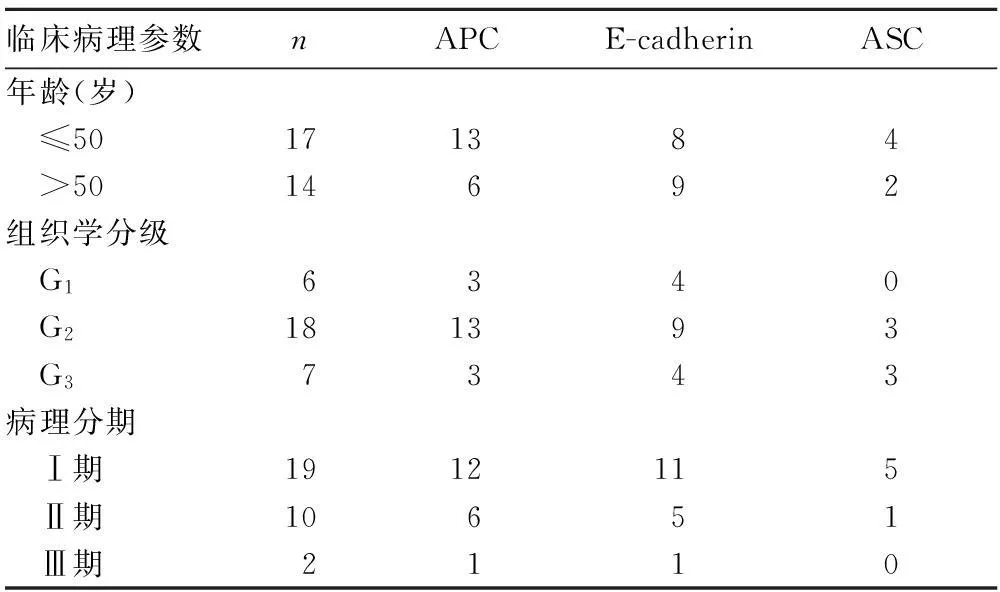
表2 APC、E-cadherin、ASC基因启动子区域甲基化
3讨论
基因启动子区域甲基化是在DNA甲基转移酶催化下,利用S-腺苷甲硫氨酸提供的甲基,将甲基转移到特定碱基的过程。甲基化反应不改变DNA序列和遗传密码,具有可逆性。人类许多基因中含有CpG序列密集区,称为CpG岛,常位于基因上游调控区的启动子内,这些基因多为管家基因或组织特异表达基因。启动子区的CpG岛通常处于非甲基化状态,基因可正常表达,当其发生甲基化时则影响基因转录调控,使基因表达沉默。一些肿瘤相关基因尤其是抑癌基因可因异常甲基化而失活,导致正常细胞生长分化调控失常。研究发现,在人类肿瘤与变异细胞中存在DNA异常甲基化,如APC、VHL、E-cadherin、P16基因启动子区CpG岛高甲基化[1~4]。
APC是Wnt信号转导通路的重要组成部分,在细胞的生长发育、凋亡、迁移、信号传递等方面起着重要调控作用。APC基因失活使β-catenin蛋白降解障碍,导致游离β-catenin在胞质内积聚并易位入胞核,从而使Tcf/Lef激活,引起如c-myc、c-jun、Cyclin D1基因的异常转录,最终导致细胞发生恶变[5]。目前在结直肠癌、胃癌、胰腺癌及肝癌等恶性肿瘤中已发现APC基因启动子区域高甲基化[6,7],而关于宫颈癌的研究较少。E-cadherin是一种与癌细胞浸润、转移和分化密切相关的细胞黏附分子,E-cadherin表达下调将使细胞失去黏附,正常组织无法发育成形;对于恶性肿瘤,则细胞极性丧失、呈现恶性细胞形态并具备侵袭性生长特征[8,9]。ASC是一个新发现的抑癌基因,其编码的蛋白具有促进细胞凋亡、激活Caspase和调节NF-κB活性等功能[10]。研究证实,在卵巢癌、非小细胞肺癌、乳腺癌等肿瘤中存在ASC基因启动子区域的频繁甲基化。有学者[11]发现乳癌细胞系甲基化诱导静止基因(TMS1/ASC)表达缺失与TMS1/ASC基因CpG岛高度甲基化相关。我们在宫颈癌组织中测出APC、E-cadherin、ASC基因启动子区域甲基化,且APC、E-cadherin基因启动子区域甲基化检出率高于正常宫颈组织,与相关研究结果一致[8,9]。
FHIT基因是近年来在染色体3p区域发现的候选抑癌基因,可能通过诱导细胞凋亡、阻滞细胞周期发挥抑制肿瘤细胞增殖的作用。但我们未在宫颈癌组织中测得FHIT基因启动子区域甲基化,这与相关研究[12]结果不一致,可能与标本取材、样本数量有关,也可能与肿瘤组织中基因启动子区域甲基化不均质性有关。
总之,宫颈癌组织中存在APC、E-cadherin、ASC基因启动子区域甲基化,提示在宫颈癌发生、发展过程中存在多个基因的异常甲基化,APC、E-cadherin、ASC基因启动子区域甲基化可能参与了宫颈癌的发病。
参考文献:
[1] Esteller M, Sparks A, Toyota M, et al. Analysis of adenomatous polyposis coli promoter hypermethylation in human cancer[J]. Cancer Res, 2000,60(16):4366-4371.
[2] Graff JR, Herman JG, Lapidus RG, et al. E-cadherin expression is silenced by DNA hypermethylation in human breast and prostate carcinomas[J]. Cancer Res, 1995,55(22):5195-5199.
[3] Merlo A, Herman JG, Mao L, et al. 5′ CpG island methylation is associated with transcriptional silencing of the tumor suppressor p16/CDKN2/MTS1 in human cancers[J]. Nat Med, 1995,1(7): 686-692.
[4] Herman JG, Latif F, Weng Y, et al. Silencing of the VHL tumor-suppressor gene by DNA methylation in renal carcinoma[J]. Proc Natl Acad Sci USA, 1994,91(21):9700-9704.
[5] Fearnhead NS, Britton MP, Bodmer WF. The ABC of APC[J]. Hum Mol Genet, 2001,10(7):721-733.
[6] Esteller M, Sparks A, Toyota M, et al. Analysis of adenomatous polyposis coli promoter hypermethylation in human cancer[J]. Cancer Res, 2000,60(16):4366-4371.
[7] Tsuchiya T, Tamura G, Sato K, et al. Distinct methylation patterns of two APC gene promoters in normal and cancerous gastric epithelia[J]. Oncongene, 2000,19(32):3642-3646.
[8] Zambrano P, Segura-Pacheco B, Perez-Cardenas E, et al. A phase I study of hydralazine to demethylate and reactivate the expression of tumor suppressor genes[J]. BMC Cancer, 2005,5(1):44-55.
[9] Dong SM, Kim HS, Rha SH, et al. Promoter hypermethylation of multiple genes in carcinoma of the uterine cervix[J]. Clin Cancer Res, 2001,7(7):1982-1986.
[10] Mcconnell BB, Vertino PM. Activation of a caspase-9 mediated apoptotic pathway by subcellular redistribution of the novel caspase recruitment domain protein TMS1[J]. Cancer Res, 2000,60(22):6243-6247.
[11] Conway KE, McConnell BB, Bowring CE, et al. TMS1, a novel proapoptotic caspase recruitment domain protein, is a target of methylation-induced genesilencing in human breast cancers[J]. Cancer Res, 2000,60 (22):6236-6242.
[12] 史惠蓉,吴庆华,索振河,等.宫颈癌组织中FHIT基因5′端CpG岛甲基化状态及其与基因失活的关系[J].癌症,2005,24(1):7-11.
(收稿日期:2015-11-06)
中图分类号:R737.31
文献标志码:B
文章编号:1002-266X(2016)07-0039-03
doi:10.3969/j.issn.1002-266X.2016.07.014
通信作者:钱洪鑫(E-mail: 3812501@qq.com)
