丹参酮ⅡA磺酸钠腹腔注射对阿霉素心肌病大鼠心功能及左心室纤维化的影响
2016-04-18王伊林单晓彤柴花苗昊魏成喜赵明
王伊林,单晓彤,柴花,苗昊,魏成喜,赵明
(1内蒙古民族大学,内蒙古通辽028000;2内蒙古民族大学附属医院)
丹参酮ⅡA磺酸钠腹腔注射对阿霉素心肌病大鼠心功能及左心室纤维化的影响
王伊林1,单晓彤1,柴花1,苗昊1,魏成喜1,赵明2
(1内蒙古民族大学,内蒙古通辽028000;2内蒙古民族大学附属医院)
摘要:目的观察丹参酮ⅡA磺酸钠(STS)对阿霉素心肌病大鼠心功能及左心室(左室)肌纤维化的影响。方法 雄性Wistar大鼠30只,随机分为实验组、模型组和对照组各10只。实验组腹腔注射STS、阿霉素各2 mg/kg,模型组腹腔注射阿霉素2 mg/kg,每周1次,对照组腹腔注射生理盐水10 mL/kg,各组每周注射1次、共3次。实验第7周末,进行心脏彩色多普勒超声(彩超)检查测算左室舒张末径及左室射血分数(LVEF),行颈动脉逆行插管测左室内压,HE染色观察左室组织病理变化,VG染色观察左室纤维化程度,采用ELISA法检测各组心肌组织匀浆中的心肌结缔组织生长因子(CTGF)、转化生长因子β1(TGF-β1),采用Western blotting法检测各组心肌细胞中的β-catenin。结果实验组血压高于模型组、低于对照组(P均<0.05)。模型组较对照组左室内径明显增大且室壁变薄,LVEF降低(P均<0.05);实验组较模型组左室内径减小、室壁变厚、LVEF升高(P均<0.05)。实验组左室压最大上升速度高于模型组、低于对照组,左室最大下降速度高于模型组、低于对照组(P均<0.05)。实验组心肌组织结构改变及纤维化程度较模型组减轻。实验组心肌组织中TGF-β1和CTGF水平低于模型组、高于对照组(P均<0.05),实验组心肌细胞中β-catenin表达量低于模型组(P<0.05)。结论 STS可在一定程度上减轻阿霉素心肌病大鼠左室纤维化程度,改善心功能,这些作用可能与下调TGF-β1、CTGF及β-catenin表达有关。
关键词:心肌病;阿霉素;丹参酮ⅡA磺酸钠;心功能;心室纤维化;转化生长因子β1;结缔组织生长因子;β-链蛋白
阿霉素属蒽环类抗癌药物,应用于多种恶性肿瘤的治疗[1],但该药可引起心脏重塑,严重影响心功能和患者预后[2]。阿霉素引发心肌损伤的机制尚不明确,且目前无特效药物干预。中药丹参具有活血通络、抗血小板凝集、扩张冠状动脉、改善心肌缺血及逆转心肌纤维化等作用[3,4]。2015年5~9月,我们观察了丹参主要成分丹参酮ⅡA磺酸钠(STS)[5]对阿霉素心肌病大鼠心功能及左心室(左室)纤维化的影响,为STS治疗阿霉素心肌病提供实验依据。
1材料与方法
1.1实验材料雄性Wistar大鼠30只,体质量(200±20)g,由吉林大学基础医学院实验动物中心提供。阿霉素,注射用丹参酮ⅡA磺酸钠,光学显微镜,结缔组织生长因子(CTGF)ELISA试剂盒,水平摇床,CX43CX内参抗体 β-actin,BL420生理仪,GE VIVID E9彩超机。
1.2阿霉素心肌病模型制备及STS用药方法将30只大鼠随机分为实验组、模型组与对照组,各10只。实验组腹腔注射阿霉素、STS各2 mg/kg,模型组腹腔注射阿霉素2 mg/kg,对照组腹腔注射生理盐水(10 mL/kg)。各组均每周注射1次,共3次,停药自由饮食4周。
1.3大鼠血压及心功能相关指标检测各组于实验第7周末行心脏彩色多普勒(彩超)检查,测算左室舒张末期直径(LVEDD)、左室壁厚度及左室射血分数(LVEF)。测定各组左室血流动力学指标。采用10%水合氯醛(300 mg/kg)腹腔注射麻醉大鼠,大鼠仰卧固定后,常规分离右侧颈总动脉,动脉导管内充37 ℃肝素生理盐水,动脉导管另一端与换能器连接,稳定5 min后,行颈动脉逆行插管检测左室压最大上升速度及左室最大下降速度。
1.4大鼠心脏大体观察及心脏组织病理观察实验第7周末,腹主动脉放血处死大鼠,剪开左肋,暴露心脏,观察大体变化。用眼科剪将心脏取出,剪下左室壁心肌标本,一部分留作检测蛋白用,一部分以10%多聚甲醛固定用于病理观察。
1.5大鼠心脏组织中CTGF、TGF-β1及心肌细胞中β-catenin检测实验第7周末,采用ELISA法检测心脏组织匀浆中的CTGF、TGF-β1;采用Western bloting法检测各组心肌细胞中的β-catenin。
2结果
2.1各组大鼠血压及心功能相关指标比较三组收缩压、舒张压、左室收缩末压、左室舒张末压相比,P均<0.05。模型组较对照组左室内径明显增大且室壁变薄,LVEF降低(P均<0.05);实验组较模型组左室内径减小、室壁变厚、LVEF升高(P均<0.05)。实验组左室压最大上升速度高于模型组、低于对照组,左室最大下降速度高于模型组、低于对照组(P均<0.05)。见表1、2。

表1 各组大鼠血压指标比较
注:与对照组相比,*P<0.05;与模型组相比,▲P<0.05。
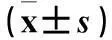
表2 各组心功能相关指标比较
注:与对照组相比,*P<0.05;与模型组相比,▲P<0.05。2.2各组大鼠心脏大体改变及心肌组织病理变化对照组心脏外观无明显改变。模型组心外膜均可见大面积的黄白色斑点,个别有心包积液。实验组心外膜偶见黄白色斑点,心外膜下无淤血。对照组大鼠心肌细胞排列整齐、细胞饱满、胞核清晰且位于细胞中央;模型组心肌细胞排列紊乱,部分核仁消失,心肌纤维间隔明显增宽,间质明显水肿,出现较严重的肌溶解、纤维化;实验组心肌纤维间隔及心肌纤维排列尚可,心肌溶解现象减轻,心肌组织纤维化较模型组减轻。
2.3各组大鼠心肌组织中TGF-β1、CTGF水平比较实验组TGF-β1、CTGF水平分别为(311.75±146.26)、(300.44±30.78)pg/mL,模型组分别为(685.81±173.56)、(508.76±43.98)pg/mL,对照组分别为(95.55±40.64)、(99.1±4.24)pg/mL,实验组TGF-β1和CTGF水平低于模型组、高于对照组(P均<0.05)。
2.4各组心肌细胞中β-catenin表达比较实验组、模型组、对照组心肌细胞中β-catenin表达量分别为1 546±66、2 497±91、1 528±82,实验组β-catenin表达低于模型组(P<0.05)。
3讨论
阿霉素心肌病是由于过量氧化自由基使心肌线粒体受到严重损伤,导致心肌细胞损伤、心肌纤维化,严重者可出现心力衰竭。心肌细胞纤维化又可导致心肌舒张功能减弱,影响心脏泵血功能。因此,抑制心肌纤维化、保持心肌细胞舒张功能可能是治疗阿霉素心肌病的方法。STS是从中药丹参中提取的有效成分。有学者[7]研究发现,STS可能通过抑制c-fos基因表达,从而起到抑制心肌细胞肥大、减少成纤维细胞增殖的作用。另有学者称STS可能通过下调心脏成纤维细胞血管内皮素表达并干扰eNOS-NO通路从而起到抑制心肌纤维化、改善心功能的作用[8]。
我们建立了阿霉素心肌病大鼠模型,并给予STS干预,结果发现,模型组出现了较强的心肌溶解、间质纤维化等病理改变,心腔扩大、心功能降低;实验组心肌纤维化程度较模型组明显减轻,左室内径减小,室壁变厚,LVEF升高,各项心功能指标得到一定恢复。提示STS可改善阿霉素心肌病大鼠心功能,并延缓心肌纤维化。
TGF-β1是公认的致纤维化因子之一,参与多个器官或组织纤维化形成。TGF-β1是CTGF的上游因子,可通过Smads途径诱导CTGF表达[9,10]。CTGF具有促进有丝分裂、促进心脏成纤维细胞增殖和细胞基质合成等作用,可加速心肌纤维化进程[11]。Wnt1/β-catenin信号通路参与细胞凋亡及增殖、分化等多个生理病理过程[12,13]。另有文献[14,15]报道Wnt1/β-catenin信号通路与TGF-β1/Smad通路在组织纤维化过程中有协同作用。本研究结果显示,实验组心肌组织匀浆中TGF-β1和CTGF水平低于模型组、高于对照组,实验组β-catenin表达低于模型组,提示STS抑制心肌纤维化、改善心功能的作用与下调TGF-β1、CTGF及β-catenin表达有关。
综上所述,STS能有效减轻阿霉素所致的心肌纤维化,抑制心肌溶解,机制与调节TGF-β1/Smad通路及Wnt/β-catenin信号通路有关。有学者[16,17]认为,STS还可能通过抑制阿霉素导致的心肌细胞凋亡从而减轻纤维化。我们将对此进行研究,进一步阐明STS治疗阿霉素心肌病的机制。
参考文献:
[1] 刘一,边原.阿霉素抗肿瘤作用的研究进展[J].泸州医学院学报,2008,31(1):101-103.
[2] 张剑,金哲.阿霉素心肌病的研究进展[J].中外医学研究,2013,11(13):152-153.
[3] 杨志霞,林谦,马利.丹参对心血管疾病药理作用的文献研究[J].世界中西医结合杂志,2012,7(2):93-96.
[4] 唐忠志,郑智,唐瑛.丹参对自发性高血压大鼠心肌纤维化的逆转作用及其机制研究[J].华中科技大学学报(医学版),2002,31(3):292-294.
[5] 李玉萍,顾兵,刘建涛.丹参酮ⅡA的研究进展[J].时珍国医国药,2010,21(7):1770-1772.
[6] 周荣,杨彩虹,王强.两种给药方式建立阿霉素心肌病大鼠模型的评价[J].中西医结合心脑血管疾病杂志,2009,7(11):1315-1317.
[7] Feng J, Zheng Z. Effect of sodium tanshinone Ⅱ A sulfonate on car-diac myocyte hypertrophy and its underlying mechanism[J].ChinJ Integr Med, 2008,14(3):197-201.
[8] Cheng TH, Cheng PY, Shih NL, et al. Involvement of reactive oxy-gen species in angiotensin Ⅱ-induced endothelin-1 gene expressionin rat cardiac fibroblasts[J]. J Am Coll Cardiol, 2003,42(10):1845-1854.
[9] Leask A, Sa S, Holmes A, et al. The control of ccn2(ctgf) gene expression in normal and scleroderma fibroblasts[J]. MOL Pathil, 2001,54(3):180-183.
[10] Ulloa L, Tabibzadeh S. Lefty inhibits receptor-regulated Smad Phosphorylation induced by the aetivated transforming grwoth faetor-beta receptor[J]. Biol Chem, 2001,276(24):21397-21404.
[11] Bradham DM, Igarashi A, Potter RL, et al. Connective tissue growth factor: a cysteine-rich mitogen secreted by human vascular endothelial cells is related to the SRC-induced immediate early gene product CEF-10[J]. Cell Biol, 1991,114(6):1285-1294.
[12] 石春花,石明隽,王圆圆,等.Wnt/β-catenin信号通路与器官纤维化的关系[J].贵阳医学院学报,2015,40(4):325-329.
[13] Duan J, Gherghe C, Liu D, et al. Wnt1/β-catenin injury response activates the epicardium and cardiac fibroblasts to promote cardiac repair [J]. EMBO, 2012,31(2):429-442.
[14] 邓文超,方敬爱.黄芪对糖尿病肾病大鼠肾间质Wnt/β-catenin及TGF-β1信号通路表达的影响[J].中国中西医结合肾病杂志,2012,13(7):571-574.
[15] 饶翠,林力山,邓红,等.经典转化生长因子β/Smad信号和Wnt/β-catenin信号间的相互作用[J].浙江大学学报(医学版),2013,42(5):591-597.
[16] 赵雅君,王伊林,赵明.阿霉素致心肌细胞凋亡时网腔钙结合的变化[J].临床心血管病杂志,2015,31(8):895-898.
[17] 王伊林,赵雅君,杨洋,等.磷酸肌酸钠对慢病毒介导Calumenin蛋白沉默对阿霉素损伤心肌细胞内质网应激信号通路的作用[J].临床心血管病杂志,2015,31(10):1119-1122.
(收稿日期:2015-09-12)
中图分类号:R331.3;R332
文献标志码:A
文章编号:1002-266X(2016)07-0034-03
doi:10.3969/j.issn.1002-266X.2016.07.012
通信作者:赵明(E-mail:langzhe73@163.com)
基金项目:内蒙古自治区蒙药系统生物学科技创新团队;内蒙古民族大学博士、硕士研究生科研创新项目(NMDSS1463)。
