PCOS患者孕期血脂水平变化及其对胎儿脂代谢的影响
2016-04-18相加军庄永玲徐本福
相加军,庄永玲,徐本福
(沂水中心医院,山东临沂276400)
PCOS患者孕期血脂水平变化及其对胎儿脂代谢的影响
相加军,庄永玲,徐本福
(沂水中心医院,山东临沂276400)
摘要:目的观察多囊卵巢综合征(PCOS)患者孕期血脂水平变化及其对胎儿脂代谢的影响。方法 选取PCOS孕妇74例为PCOS组,选取健康孕妇80例为对照组。两组孕妇分别于孕早期、孕中期及孕晚期检测血清总胆固醇(CHOL)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。两组新生儿分别于出生后1、3、7 d检测血清CHOL、HDL、LDL、睾酮。结果PCOS组TG在孕早、中、晚期呈上升趋势,孕中期CHOL、HDL、LDL高于孕早期(P均<0.05),孕晚期HDL、LDL较孕中期有所下降(P均<0.05);对照组孕妇孕中、晚期CHOL、TG、HDL及LDL高于孕早期(P均<0.05),孕晚期CHOL、HDL、LDL均高于孕中期(P均<0.05)。PCOS组孕早期CHOL、TG、LDL低于对照组(P均<0.05);PCOS组孕中期TG低于对照组,CHOL、HDL、LDL高于对照组(P均<0.05);PCOS组孕晚期CHOL、HDL、LDL低于对照组,TG高于对照组(P均<0.05)。PCOS组及对照组新生儿出生后CHOL、HDL、LDL及睾酮均呈不同程度上升趋势。PCOS组新生儿出生后1 d血清CHOL、LDL水平高于对照组,睾酮水平低于对照组(P均<0.05);PCOS组新生儿出生后3 d血清HDL、LDL及睾酮水平低于对照组,CHOL水平高于对照组(P均<0.05);PCOS组新生儿出生后7 d血清CHOL、LDL水平低于对照组,睾酮水平高于对照组(P均<0.05)。结论 PCOS孕妇血脂水平及其新生儿出生后血脂、睾酮水平均呈动态变化,PCOS患者孕期血脂水平变化对其胎儿出生后脂代谢和睾酮水平有一定影响。
关键词:多囊卵巢综合征;新生儿;胆固醇;睾酮
多囊卵巢综合征(PCOS)是育龄妇女常见病,主要临床表现为不孕、月经不调、肥胖和多毛等[1~3]。目前PCOS发病机制尚未明确,已知高胰岛素血症和胰岛素抵抗是PCOS的主要病理生理基础[4,5]。胆固醇是新生儿生长发育的重要物质,参与细胞膜形成,是维生素D、胆汁酸合成的原料[6,7]。睾酮是胎儿生长发育必需物质,可刺激红细胞形成,促进骨骼生长和蛋白质合成[8,9]。2014年1月~2015年1月,本研究观察了PCOS患者孕期血脂水平变化及其对胎儿脂代谢的影响。
1资料与方法
1.1临床资料PCOS[10]孕妇74例(PCOS组),年龄25~41(30.2±4.5)岁,BMI 23.2±3.7,妊娠方式为自然周期妊娠18例、运用促排卵方案33例、采用辅助生殖技术23例,均采用剖宫产,新生儿体质量2 000~3 800(3 052±342)g。同时选取80例健康孕妇为对照组,年龄23~42(29.8±4.8)岁,BMI 22.8±3.6,均采用剖宫产,新生儿体质量2 300~3 800(2985±323)g,排除PCOS、高血压、糖尿病、心脏病、肝肾疾病及甲状腺功能异常者。两组年龄、BMI、新生儿体质量等一般资料具有可比性。所有研究对象均自愿签署知情同意书,本研究通过伦理委员会批准。
1.2PCOS孕妇及其新生儿血脂、睾酮检测两组孕妇分别于孕早期、孕中期及孕晚期空腹取静脉血,采用日本奥林巴斯640型全自动生化分析仪检测血清总胆固醇(CHOL)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。两组新生儿分别于出生后1、3、7 d静脉抽血,检测血清CHOL、HDL、LDL-C、睾酮。
2结果
2.1两组孕妇孕早、中、晚期血脂水平比较PCOS组TG在孕早、中、晚期呈上升趋势,孕中期CHOL、HDL、LDL高于孕早期(P均<0.05),孕晚期HDL、LDL较孕中期有所下降(P均<0.05);对照组孕妇孕中、晚期CHOL、TG、HDL及LDL高于孕早期(P均<0.05),孕晚期CHOL、HDL、LDL均高于孕中期(P均<0.05)。PCOS组孕早期CHOL、TG、LDL低于对照组(P均<0.05);PCOS组孕中期TG低于对照组,CHOL、HDL、LDL高于对照组(P均<0.05);PCOS组孕晚期CHOL、HDL、LDL低于对照组,TG高于对照组(P均<0.05)。见表1。
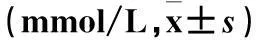
表1 两组孕妇血脂指标比较
注:与同组孕早期相比,△P<0.05,△△P<0.01;与同时点对照组相比,*P<0.05,**P<0.01。
2.2两组新生儿血脂水平及睾酮水平比较PCOS组及对照组新生儿出生后CHOL、HDL、LDL及睾酮均呈不同程度上升趋势。PCOS组新生儿出生后1 d血清CHOL、LDL水平高于对照组,睾酮水平低于对照组(P均<0.05);PCOS组新生儿出生后3 d血清HDL、LDL及睾酮水平低于对照组,CHOL水平高于对照组(P均<0.05);PCOS组新生儿出生后7 d血清CHOL、LDL水平低于对照组,睾酮水平高于对照组(P均<0.05)。见表2。
表2 两组新生儿血脂水平及睾酮水平比较±s)
注:与同组出生后1 d相比,△P<0.05,△△P<0.01;与对照组同时点比较,*P<0.05,**P<0.01。
3讨论
PCOS是女性常见的内分泌紊乱性疾病,发病机制尚不明确,主要临床表现为卵巢多囊改变、高雄激素血症等[11]。正常产妇妊娠期孕激素和雌激素促进肝脏合成TG、HDL、LDL,肠道加强对血脂的吸收,脂肪酸分解加速,葡萄糖分解减慢,能量供应给胎儿[12~14]。胆固醇是细胞膜的基本结构成分,决定细胞膜的性质,在胎儿体内可转化为胆汁酸,促进胎儿后续进食[15]。HDL能够转运胆固醇,减少胆固醇在细胞内积累[16]。LDL可将胆固醇运送到肝外其他组织,为胎儿生长发育提供能量[17]。PCOS患者除不孕、月经紊乱外,还存在并发心血管疾病、糖尿病、子宫内膜癌等风险。PCOS患者多合并代谢异常,如血脂代谢异常、胰岛素抵抗等,且高雄激素血症和高胰岛素血症在PCOS病程进展中起协同作用。PCOS产妇的新生儿在胎儿期暴露于母体高水平睾酮环境中,可影响新生儿体质量、身高和血脂代谢,导致新生儿出生时体质量偏低,而新生儿时期出现迅速生长的情况。临床上可用睾酮治疗胎儿生长发育缓慢[18]。
本研究结果显示,PCOS孕妇CHOL、HDL、LDL水平孕中期高于孕早期,而在孕晚期略有降低,且孕中期血清CHOL、HDL、LDL水平高于对照组,孕晚期TG水平高于对照组,说明PCOS患者孕期存在生理性高血脂症。分析其机制:胰岛素抵抗导致脂肪分解氧化,血中游离脂肪酸增多,导致合成血脂的原料增多;PCOS引发的高雄血症影响血脂代谢可能加剧了患者妊娠期脂代谢紊乱。本研究选择剖宫产分娩的孕妇为研究对象,排除了不同分娩方式对新生儿临床特征的影响。研究结果显示,PCOS组新生儿出生后1、3 d血清CHOL水平升高,出生后1 d血清LDL水平升高,出生后7 d血清CHOL、LDL水平下降,推测新生儿肝脏合成CHOL和LDL增多,为生长发育准备,随后胆固醇转化为胆汁酸,故而LDL水平降低。我们还发现,PCOS组新生儿出生后1、3 d睾酮水平较低,但在出生后7 d睾酮水平升高。睾酮水平上升可以促进胎儿骨骼发育和蛋白质合成,因生长发育的需要,新生儿体内睾酮分泌增多。另有研究[19]表明,PCOS产妇体内CHOL、胰岛素水平均可影响新生儿体内CHOL水平。PCOS组新生儿CHOL、LDL水平低而睾酮水平较高,推测可能是PCOS产妇血中雄激素水平升高、胰岛素水平降低,从而影响了新生儿。
总之,PCOS患者孕期血脂水平呈动态变化,脂代谢加快,其中孕晚期TG水平升高显著,其新生儿出生后7 d血清CHOL、LDL水平降低,睾酮水平显著升高。我们建议,PCOS产妇应进行产前血脂水平检测,发现异常及时给予干预,减小脂代谢紊乱对胎儿的影响。
参考文献:
[1] 阴红,吴桂芳.PCOS患者血清FABP4水平与糖脂代谢紊乱的相关性[J].山东医药,2014,54(30):17-19.
[2] 李游,范平,白怀,等.PCOS患者PAF-AH活性及其与糖脂代谢相关性的研究[J].四川大学学报(医学版),2009,40(6):1066-1070.
[3] 俞琳,何倩,来蕾,等.多囊卵巢综合征患者胰岛素抵抗与脂代谢的关系[J].生殖与避孕,2002,22(5):277-279.
[4] 韩芸,黄健玲,钟秀弛,等.不同类型多囊卵巢综合征患者糖脂代谢特征[J].中国实验方剂学杂志,2013,19(14):288-291.
[5] 甄月巧,王冬梅.多囊卵巢综合征患者糖脂代谢及胰岛素抵抗特点的分析研究[J].中国糖尿病杂志,2013,21(6):511-513.
[6] 宋颖,田波,李启富,等.多囊卵巢综合征患者糖脂代谢异常及胰岛素抵抗的特点[J].中国糖尿病杂志,2010,18(11):803-805.
[7] 黄卡立,蒋凤艳,黎红芳,等.不同肥胖标准的PCOS患者脂代谢的对比研究[J].中国临床新医学,2010,3(5):414-417.
[8] 易丹妮,朱亚莉.多囊卵巢综合征胰岛素抵抗与性激素及血脂代谢的关系[J].广东医学,2013,34(10):1571-1573.
[9] 裴友娟,王蔼明,闫玲,等.多囊卵巢综合征患者静息心率与糖脂代谢及血压等指标关系的研究[J].生殖医学杂志,2013,22(2):114-118.
[10] 徐晓航,陈圆辉,王倩,等.多囊卵巢综合征诊治新进展[J].国际生殖健康/计划生育杂志,2015,34(2):160-164.
[11] 杨慧霞,张眉花,孙伟杰,等.妊娠期糖代谢异常相关因素的研究[J].中华妇产科杂志,2005,40(11):725-728.
[12] 侯智,玉建雯,李明,等.多囊卵巢综合征伴胰岛素抵抗对妊娠结局的影响[J].河北医药,2012,34(15):2297-2298.
[13] 阳红,吴桂芳.PCOS患者血清FABP4水平与糖脂代谢紊乱的相关性[J].山东医药,2014,54(30):17-19.
[14] 杨洁,徐莉,刘益芬,等.多囊卵巢综合征孕妇并发妊娠期糖代谢异常的相关因素探讨[J].中国妇幼保健,2008,23(29):4115-4116.
[15] 张亚杰,王建业,张菱,等.PCOS妊娠患者的产科并发症和新生儿结局[J].中国妇幼保健,2011,26(23):3584-3586.
[16] 肖虎,凌晟荣,章琴,等.多囊卵巢综合征患者血脂代谢的特点分析[J].中华内分泌代谢杂志,2014,30(2):129-132.
[17] Wissing ML, Bjerge MR, Olesen AIG, et al. Impact of PCOS on early embryo cleavage kinetics[J]. Reprod Biomed Online, 2014,28(4):508-514.
[18] Shafiee MN, Khan G, Ariffin R, et al. Preventing endometrial cancer risk in polycystic ovarian syndrome (PCOS) women: Could metformin help?[J]. Gynecol Oncol, 2014,132(1):248-253.
[19] Mazza A, Fruci B, Guzzi P, et al. In PCOS patients the addition of low-dose spironolactone induces a more marked reduction of clinical and biochemical hyperandrogenism than metformin alone[J]. Nutr Metab Cardiovasc Dis, 2014,24(2):132-139.
(收稿日期:2015-09-25)
中图分类号:R711.75
文献标志码:B
文章编号:1002-266X(2016)07-0064-03
doi:10.3969/j.issn.1002-266X.2016.07.024
