双抗体夹心ELISA法研究rMBP- NAP在大鼠体内的药代动力学
2016-04-18崔明辰陈娇时冉冉王建国
崔明辰,陈娇,时冉冉,王建国
(漯河医学高等专科学校 1.医疗系, 2.生物化学教研室,河南 漯河 462002)
双抗体夹心ELISA法研究rMBP- NAP在大鼠体内的药代动力学
崔明辰1,陈娇2,时冉冉2,王建国
(漯河医学高等专科学校 1.医疗系, 2.生物化学教研室,河南 漯河462002)
[摘要]目的:研究重组麦芽糖结合蛋白- 中性粒细胞激活蛋白(rMBP- NAP )在大鼠体内的药代动力学。方法:给大鼠静脉注射rMBP- NAP后在不同时间点采血,用双抗体夹心酶联免疫法(ELISA)测定rMBP- NAP的血浆浓度,然后用DAS2.1药动学软件进行曲线拟合并计算药代动力学参数。结果:rMBP- NAP静脉给药后迅速入血,2.5、5和10 mg·kg(-1) 3种剂量的消除半衰期分别为1.983、1.747和2.006 h,血浆清除率呈非剂量依赖性改变,血浆药物浓度—时间曲线下面积随着剂量的增加而成比例增加;rMBP- NAP在大鼠体内的分布以肾脏最高,其后为肺和肝,以脑组织中浓度最低。结论:rMBP- NAP给药后能迅速进入血液循环,其消除符合线性动力学特征,rMBP- NAP在大鼠体内的药代动力学过程符合二室开放模型,呈一级动力学消除,给药后主要分布到肾脏。
[关键词]rMBP- NAP; 酶联免疫法; 药代动力学
在肿瘤宿主抗原特异性T细胞的分化过程中,Th2的分化占优势,Th2优势状态与肿瘤的免疫逃逸有密切关系[1- 3]。幽门螺杆菌中性粒细胞激活蛋白(HP- NAP)是幽门螺杆菌(Helicobacterpylori,H.Pylori)的主要毒力因子之一。Amedei等报道,HP- NAP是一种脱氧受体2(Toll- like receptor 2)激动剂,能够诱导人中性粒细胞和单核细胞产生IL- 12和IL- 23等细胞因子,促进树状突细胞(DC)成熟,使宿主抗原特异性CD4+T细胞由Th2向Th1免疫反应转变,产生显著的细胞毒性免疫应答[4],增强Th1免疫,起到对肿瘤进行免疫治疗的作用。
但是由于H.Pylori体外培养条件苛刻,利用DNA重组技术制备HP- NAP技术成熟且有市场开发价值。我们从H.Pylori临床分离株MEL- HP27中克隆到HP- NAP编码基因HP- napA全长,目前,已经通过基因工程手段对天然序列改造,获得了一组新型重组融合蛋白,经筛选重组麦芽糖结合蛋白-中性粒细胞激活蛋白(recombinant maltose- binding protein- neutrophil- activa-
ting protein, rMBP- NAP )具有免疫活性[5]。
目前,尚未有关于rMBP- NAP药代动力学的报道,为了确立rMBP- NAP的药代动力学特性以及其药代药效间的关系,本实验欲建立一种双抗体夹心酶联免疫法(ELISA),测定融合蛋白rMBP- NAP在对大鼠给药后的药代动力学,以了解其代谢情况,为合理用药提供依据。
1材料与方法
1.1试剂与仪器
rMBP- NAP[6]、重组谷胱甘肽- 中性粒细胞激活蛋白(GST- NAP)均由本实验室制备,浓度为2 mg·ml-1,纯度96.5%。兔抗NAP多克隆抗体由本实验室制备,浓度为2.5 mg·ml-1,纯度97%;MBP- 标签小鼠单克隆抗体(南京金斯瑞生物科技公司);Bio Rad 680酶标仪(上海麦莎生物科技有限公司);Heal Force Neofuge 15R 台式高速冷冻离心机。
1.2动物
清洁级SD大鼠,6~8周龄,雌雄各半,河南省实验动物中心提供,动物合格证号SYXK(豫)2005- 0012。
1.3棋盘滴定法确定抗体夹心ELISA最佳试剂浓度
将捕获抗体(兔NAP多克隆抗体2.5 mg·ml-1)分别稀释成浓度为1︰500、1︰1 000、1︰2 000,包被在ELISA酶标板上,每一浓度包被一横行,4 ℃过夜,洗涤拍干;把强阳性抗原(125 ng·ml-1)与阴性对照液加到同一包被抗体浓度的一列中,温育,洗涤拍干。抗体稀释液将检测抗体(小鼠MBP标签单抗0.5 mg·ml-1)分别稀释成浓度为1∶1 000、1∶2 000、1∶4 000,加到每一纵行,温育,洗涤拍干;每孔加入1∶25 000稀释的HRP标记的羊抗小鼠IgG抗体,温育,洗涤拍干显色,读取OD450值。
1.4大鼠血浆中rMBP- NAP检测标准曲线的制备
应用建立的最佳ELISA条件测定不同稀释倍数的rMBP- NAP蛋白(1000、500、250、125、62.5、31.25和15.625 ng·ml-1),用Origin 8.0软件中的四参数逻辑曲线绘制标准曲线,求得回归方程。
1.5大鼠血浆中rMBP- NAP回收率测定
将大鼠空白血浆配制成含250、62.5、15.625 ng·ml-1的rMBP- NAP,每个样品设6个孔,按夹心ELISA步骤检测,计算出平均回收率。
1.6ELISA法的灵敏度、精密度及特异性
在线性范围内选取选取250、62.5、15.625 ng·ml-13个浓度,与标准曲线同时测定。在同一次实验中每个浓度测6孔,计算批内变异系数;连续测6批,计算批间变异系数。
将rMBP- NAP的结构相似物GST- NAP及标准品rMBP- NAP以相同的终浓度加入到rMBP- NAP中。具体如下:设6个样本孔,加入100 μl rMBP- NAP(终浓度为62.5 ng·ml-1),另设6个对照孔,加入终体积为100 μl 的rMBP- NAP(终浓度为62.5 ng·ml-1)和GST- NAP(终浓度为也62.5 ng·ml-1),观察干扰物对rMBP- NAP的测定影响。
1.7rMBP- NAP在大鼠体内的药代动力学研究
选取24只SD大鼠,雌雄各半,随机分成4组,每组6只,参照药效学试验,将rMBP- NAP剂量设为10、5、2.5 mg·kg-1),另设空白对照组,尾静脉注射给药体积1 ml。给药后0.25、0.5、1、2、 4、6、 8、10 和12 h 从眼眶静脉丛用肝素化的毛细管采血,离心收集血浆,低温保存,待样品准备完后按照优化过的双抗体夹心ELISA方法检测。然后用DAS2.2.1药动学软件进行曲线拟合并计算参数。
1.8rMBP- NAP静脉注射后在大鼠体内的组织分布检测
选取24只大鼠,雌雄各半,随机分成4组,每组6只,其中1组为空白对照组,其余3组按照5 mg·kg-1剂量尾静脉注射给药,体积为1 ml。分别在给药后0.5、2、4 h将大鼠乙醚麻醉处死,迅速取出心、肝、脾、肺、肾以及脑组织,用预冷的PBS冲净组织血液,滤纸吸干后称重,剪碎组织后加入组织重量5倍体积的预冷PBS,用高速匀浆器制成匀浆,以3 000 r·min-1离心10 min后取上清,用PBS稀释不同倍数制成样品,用建立的ELISA法完成测定。
2结果
2.1双抗体夹心ELISA法的建立
棋盘滴定结果显示,兔NAP多克隆抗体滴定浓度为1∶500,小鼠MBP单克隆抗体滴定浓度为1∶1 000处的OD450值在0.8左右,阴性对照的OD450小于0.1,因此,这两种抗体的稀释度选择1∶500和1∶1 000。
2.2双抗体夹心ELISA法标准曲线
双抗体夹心ELISA法标准曲线如图1,标准曲线范围5.625~1 000 ng·ml-1,R2>0.99。
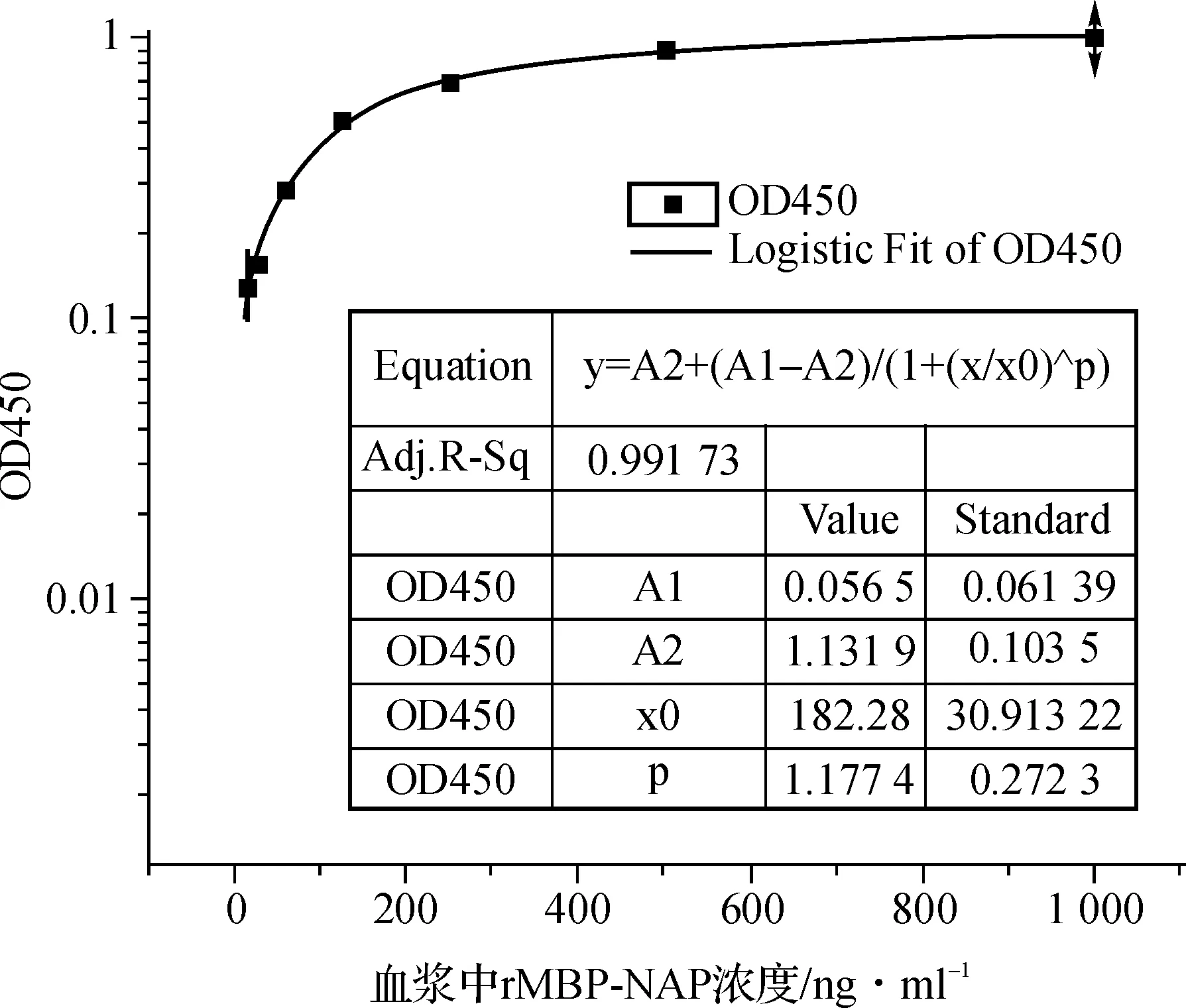
图1双抗体夹心ELISA方法检测重组融合蛋白rMBP- NAP标准曲线
2.3双抗体夹心ELISA法检测rMBP- NAP的回收率
测得 rMBP- NAP在250、62.5、15.625 ng·ml-13种浓度时的回收率见表1, 平均回收率为106%。
表1ELISA法检测rMBP- NAP的回收率

样品序号理论值/ng·ml-1平均值/ng·ml-1标准差SD回收率/%1250260.7315.39104262.564.154.96103315.62517.281.25111
2.4ELISA法检测rMBP- NAP的灵敏度、精密度及特异性
经多次测定, ELISA法最低检测灵敏度为15.625 ng·ml-1。批内及批间变异系数如表2所示,均小于10%,符合精密度的要求。
在加入了结构类似物GST- NAP后,OD450检测值变化很小,与未加结构类似物相比,差异无统计学意义,说明此ELISA方法能特异性检测rMBP- NAP。
表2ELISA法检测rMBP- NAP的批内及批间精密度

理论值/ng·ml-1测定平均值/ng·ml-1标准差SD变异系数CV/%平均变异系数CV/%批内6.95250260.7315.395.9062.564.154.967.7315.6317.281.257.23批间6.93250257.2217.336.7362.564.804.026.2015.6316.391.297.85
表3ELISA法测定rMBP- NAP的特异性

样品孔1OD值孔2OD值孔3OD值孔4OD值孔5OD值孔6OD值平均OD值P值rMBP-NAP61.25ng·ml-10.6070.5480.5350.4560.5380.5360.537加入等浓度GST-NAP0.540.5290.480.510.490.460.500.84
2.5rMBP- NAP静脉给药后大鼠血药浓度及药代动力学参数的变化
图2显示,静脉注射rMBP- NAP后迅速入血,然后慢慢消除,12 h时在血液中仍能被检测到,药代动力学参数如表4。
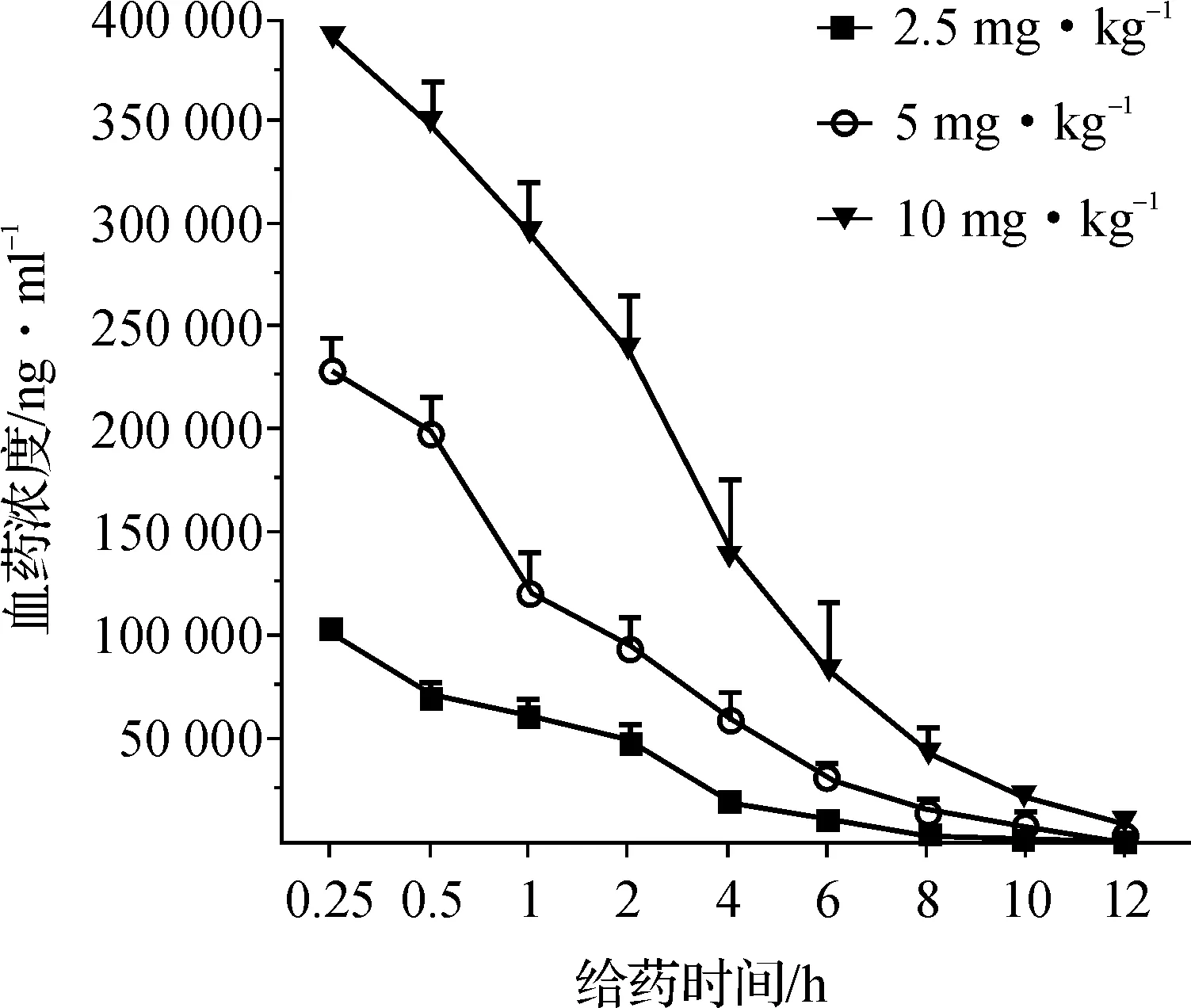
图2静脉注射给药后大鼠血浆中rMBP- NAP的血药浓度—时间曲线(n=6)
2.6双抗体夹心ELISA法检测大鼠静脉注射融合蛋白rMBP- NAP在组织器官分布
如图3,可见rMBP- NAP进入体内大鼠后,主要分布到肾脏,其次为肝脏。
3讨论
目前临床多使用一种或几种细胞因子来改变T细胞向Th1/Th2漂移,如使用IL- 2、IFN-γ或拮抗剂等[7]。但细胞因子网络复杂,有时单一细胞因子疗效不显著,调节不当甚至有副作用[8]。初步药效学实验表明,重组rMBP- NAP具有提高Th1免疫活性的作用,可开发成为有效的细胞免疫调节剂。
我们采用双抗体夹心ELISA法测定了大鼠血浆中rMBP- NAP的含量,结果表明此方法特异性高、回收率稳定、灵敏度及精密度良好,能够满足测定要求。
本研究结果显示,2.5、5、10 mg·kg-1rMBP- NAP静脉注射后的消除半衰期和血浆清除率呈非剂量依赖性改变,血药浓度—时间曲线下面积和剂量均呈线性关系,药物峰浓度与给药剂量基本呈正相关,提示rMBP- NAP药物消除符合线性动力学特征,在大鼠的体内过程呈一级消除动力学。予以大鼠5 mg·kg-1rMBP- NAP静脉注射后显示,在肾脏中分布最高,其次为肝脏和肺,在脑组织中浓度最低。该结果也基本反映了rMBP- NAP主要分布到肾脏并由尿排泄的消除途径。
表4大鼠静脉注射rMBP- NAP后的药代动力学参数

rMBP-NAP剂量药代动力学参数药-时曲线下面积/μg·h-1·L-1峰浓度/μg·L-1达峰时间/h半衰期/h2.5mg·kg-1252526.74±18956.979103803.67±3121.2950.251.983±0.4115mg·kg-1625904.66±70638.334229033.333±15100.9490.251.747±0.53610mg·kg-11444486.86±205120.287393333.333±22240.0240.252.006±0.31rMBP-NAP剂量药代动力学参数平均驻留时间/h血浆清除率/L·h-1·g-1表观分布容积/L·kg-12.5mg·kg-12.225±0.20.01±0.0010.015±0.0045mg·kg-12.653±0.3140.008±0.0010.02±0.00610mg·kg-12.979±0.3430.007±0.0010.02±0.004
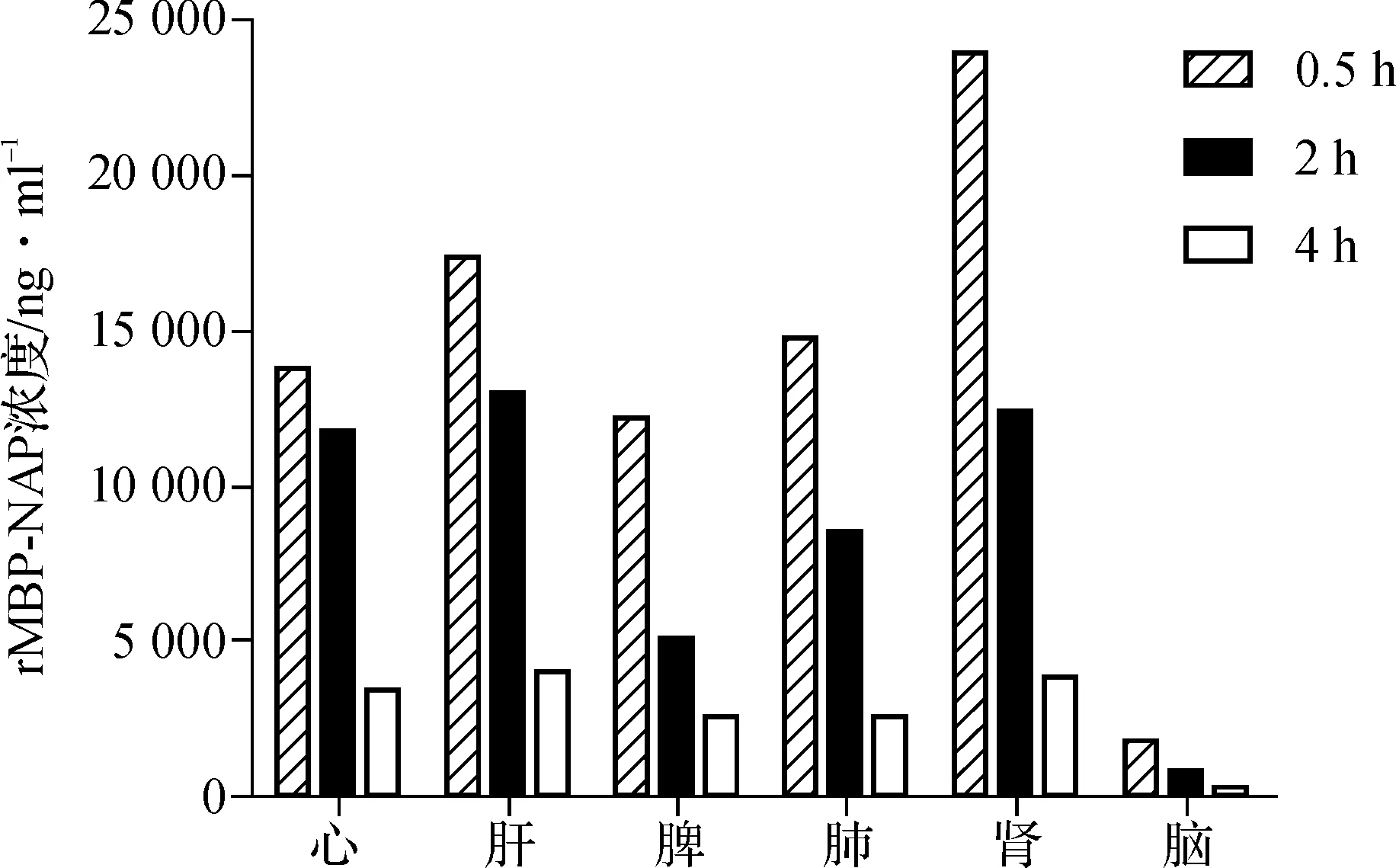
图3静脉注射rMBP- NAP后的组织器官分布
总之,rMBP- NAP的药代动力学研究是新药药理评价的重要内容之一,它在一定程度上揭示了rMBP- NAP在体内的动态过程,为临床合理用药提供了部分理论依据。
[参考文献]
[1] 刘宝霞.Th1/Th2 细胞平衡与中医药免疫调节[J].实用医技杂志,2008,15(1):114- 116.
[2] 张圣林,邱法波,吴力群.Th1/Th2 偏移与恶性肿瘤关系的研究进展[J].细胞与分子免疫学杂志,2005,21(1):113- 117.
[3] 袁少洋,王爱丽,庞启贞,等.上皮性卵巢癌患者外周血 Th1/Th2 细胞因子表达水平的变化[J].第四军医大学学报,2008,29(17):1625- 1627.
[4] AMEDEI A,CAPPON A,CODOLO G,et al.The neutrophil- activating protein ofHelicobacterpyloripromotes Th1 immune responses[J].J Clin Invest,2006,116(4):1092.
[5] KANG Q Z,DUAN G C,FAN Q T,et al.Fusion expression of Helicobacter pylori neutrophil- activating protein in E.coli[J].World J Gastroenterol,2005,11(3):454- 456.
[6] 丁亚骏,何璐云,王亚楠,等.亲和层析纯化重组中性粒细胞激活蛋白[J].河南医学研究,2012,21(3):271- 273.
[7] 张浩.自身免疫病的 Th1/Th2 细胞因子平衡治疗[J].免疫学杂志,2000,16(2):119- 122.
[8] LIN W W,KARIN M.A cytokine- mediated link between innate immunity,inflammation,and cancer[J].J Clin Invest,2007,117(5):1175- 1183.
doi:10.3969/j.issn.1671- 6264.2016.02.017
[中图分类号]R969.1
[文献标识码]A
[文章编号]1671- 6264(2016)02- 0222- 04
[通信作者]王建国ranranpeptide@163.com
[作者简介]崔明辰(1964-),男,河南南阳人,副主任医师,医学硕士。E- mail:ajiao278747551@126.com
[基金项目]漯河医学高等专科学校科研基金(2014- S- LMC10)
[收稿日期]2015- 10- 14[修回日期] 2015- 12- 22
[引文格式] 崔明辰,陈娇,时冉冉,等.双抗体夹心ELISA法研究rMBP- NAP在大鼠体内的药代动力学[J].东南大学学报:医学版,2016,35(2):222- 225.
·论著·
