山苦荬中总黄酮的提取及抗氧化活性研究
2016-04-17太文杰陈生科甘秀海
太文杰,陈生科,甘秀海
(贵州师范学院化学与生命科学学院,贵州 贵阳 550018)
山苦荬中总黄酮的提取及抗氧化活性研究
太文杰,陈生科,甘秀海
(贵州师范学院化学与生命科学学院,贵州 贵阳 550018)
在单因素试验基础上,采用响应面法优化山苦荬总黄酮的提取工艺并提取总黄酮,同时考察山苦荬样品中总黄酮对DPPH自由基的清除能力。结果表明:山苦荬总黄酮最佳提取工艺为液料比27∶1、乙醇浓度58wt.%、提取温度61℃,该条件下总黄酮的提取率为116.55 mg·g-1;另外,山苦荬总黄酮对DPPH自由基具有较好的清除能力。
山苦荬;总黄酮;响应面法;抗氧化活性
山苦荬Ixerischinensis(Thunb.)Nakai为菊科(Compositae)苦苣菜属(Soncbus)的全草,别名七托莲、小苦麦菜、小苦荬等,为多年生草本植物,主要分布于我国东北、华北等地。本品味苦,性凉、涩、钝、稀,具有清热解毒、排毒、止痛等功效,用于治疗痢疾、腹痛及肺出血等疾病[1]。
山苦荬中含有倍半萜内酯[2]、三萜[3]类化合物。另外还含有较多的黄酮类化合物,张垠等[4-5]从山苦荬中分离得到了熊果酸、β-谷甾醇、蒲公英萜醇乙酸酯、蒲公英萜醇、芹菜素、木犀草素及木犀草素-7-O-β-D-葡萄糖苷。2012年,吴七十三等[6]从山苦荬中分离得到芹菜素-7-O-β-D-葡萄糖苷、木犀草素-7-O-β-D-葡萄糖苷乙酸酯、5, 3', 4'-三羟基-7-甲氧基黄酮、5-羟基-7, 4'-二甲基黄酮、5, 7, 4'-三甲氧基黄酮等化合物。山苦荬具有多种药理活性,包括抗炎保肝作用[7],抗病毒、抗白血病作用[8],治疗糖尿病作用[9]等。由化学成分研究可知,山苦荬中含有多种黄酮类化合物,罗伟强等[10]对其茎的总黄酮提取方法进行了初步研究,但关于其全株总黄酮的提取及生物活性的研究未见相关报道。响应面法在提取工艺的优化中得到了广泛的应用,具有使用简单、精密度高、预测性好等优点[11]。与此同时,黄酮类化合物具有抗肿瘤、抗菌及抗氧化等多种生理活性,极具开发价值,在心血管疾病、内分泌疾病、肿瘤等疾病方面及食品添加剂和保健品方面均得到广泛的应用。DPPH清除能力评价方法是被广泛认可的抗氧化活性测定方法,具有快速、准确等优点[12]。为了开发山苦荬药材资源,本实验在单因素实验基础上通过响应面法优化了山苦荬总黄酮的提取工艺,在所得的最佳提取工艺条件下,提取获得山苦荬总黄酮,并采用可见分光光度法测定了山苦荬中总黄酮的含量,同时测定了山苦荬总黄酮对DPPH自由基的清除能力,以期为山苦荬资源综合开发与利用提供科学依据。
1 材料与设备
1.1 仪器722s可见分光光度计(上海精密科学仪器有限公司);XFB-200型中药粉碎机(长沙市中南制药机械厂);BSA1240S型电子分析天平(北京赛多利斯科学仪器公司);HH-8型电热恒温水浴锅(上海梅香仪器有限公司);KQ-500B型超声波清洗器(昆山市超声波仪器有限公司)。
1.2 试剂与药品山苦荬Ixerischinensis(Thunb.)Nakai样品于2016年5~6月采自河北省阳原县境内,经贵州师范学院钱长江副教授鉴定为山苦荬Ixerischinensis(Thunb.)Nakai;芦丁对照品(购于贵州迪大生物科技,批号GZDD-0001);1,1-二苯基苦基苯肼(DPPH),购于上海晶纯生化科技股份有限公司;维生素C(购于天津市科密欧化学试剂有限公司);其余试剂均为分析纯。
2 方法与结果
2.1 标准曲线的绘制参考文献[13]方法,精确称取2.8mg芦丁标准品,用60 %乙醇溶解并定容至25mL,即得0.112mg·mL-1的标准品溶液。参考文献[6]方法,准确吸取芦丁标准品溶液1.00、2.00、3.00、4.00、5.00mL于10mL比色管中,用60 %乙醇补至5.0mL,加入5%NaNO2溶液0.3mL,摇匀,静置6min;加入10%Al(NO3)3溶液0.3mL,摇匀,静置6min;再加入4%NaOH溶液2mL,用60wt.%乙醇定容至刻度,摇匀,以试剂为空白参比液于506nm处测定吸光度(A),平行测定3次,以吸光度(A)为纵坐标,浓度(c)为横坐标绘制标准曲线,进行回归分析,得回归方程:A=0.001c+0.0091,R2=0.9996,结果表明,芦丁浓度在0.112~0.560mg·mL-1范围内呈良好的线性关系。
2.2 单因素试验
2.2.1 液料比对山苦荬总黄酮提取率的影响

图1 液料比对山苦荬总黄酮提取率的影响
以60wt.%的乙醇为溶剂,于30 ℃,超声功率300W下,超声提取两次,每次20min,考察不同的液料比(10∶1、15∶1、20∶1、25∶1、30∶1、35∶1mL/g)对山苦荬总黄酮提取率的影响,结果如图1所示。由图可知,山苦荬总黄酮提取率随液料比的加大,先增大后降低,于25∶1时达到最大值。
2.2.2 乙醇浓度对山苦荬总黄酮提取率的影响
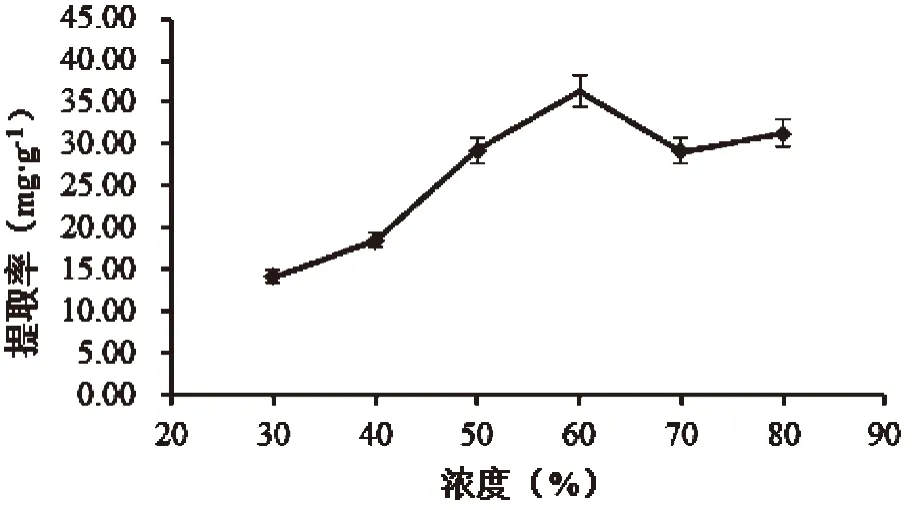
图2 乙醇浓度对山苦荬总黄酮提取率的影响
在液料比25∶1,超声功率300W,20 ℃,超声提取两次,每次20min,考察不同的乙醇浓度(30wt.%、40wt.%、50wt.%、60wt.%、70wt.%、80wt.%)对山苦荬总黄酮提取率的影响,结果如图2所示。由图可知,山苦荬总黄酮提取率在乙醇浓度为60%时达到最大值。当乙醇浓度进一步增大时,提取率反而减小,这主要是因为山苦荬黄酮类化合物多为黄酮苷类,乙醇浓度增大其溶解性反而减小。
2.2.3 提取时间对山苦荬总黄酮提取率的影响
以60wt.%乙醇为溶剂,液料比为25∶1,超声功率300W,20 ℃,超声提取两次,考察不同的超声时间(5、10、15、20、25、30min)对山苦荬总黄酮提取率的影响。结果如图3所示。由图可知,提取时间对山苦荬总黄酮提取率的影响较小。

图3 提取时间对山苦荬总黄酮提取率的影响
2.2.4 提取温度对山苦荬总黄酮提取率的影响
以60wt.%乙醇为溶剂,液料比为 25∶1,超声功率300W,超声提取两次,每次20min,考察不同的提取温度(30、40、50、60、70、80 ℃)对山苦荬总黄酮提取率的影响。结果如图4所示。由图可知,山苦荬总黄酮提取率先降低后升高,之后再次降低,且在60 ℃时达最大值。

图4 提取温度对山苦荬总黄酮提取率的影响
2.3 响应面优化[12]
在单因素试验的基础上,以60wt.%体积分数的乙醇为溶剂,选择液料比(A)、乙醇浓度(B)、提取温度(C)为因素,利用Design-Expert8.0.6软件中的Box-Behnken优化山苦荬总黄酮的提取工艺。试验安排及结果见表1。

表1 响应面试验设计方案及结果
对表1中的数据进行多元回归分析,得到总黄酮含量(Y)对因素料液比(A)、提取温度(B)、提取时间(C)的二次多项回归方程Y=115.95 + 3.84A- 1.61B+ 0.05C- 3.07AB+ 0.34AC- 3.07BC- 5.34A2- 8.48B2- 4.77C2,对该回归模型进行方差分析,结果见表2。
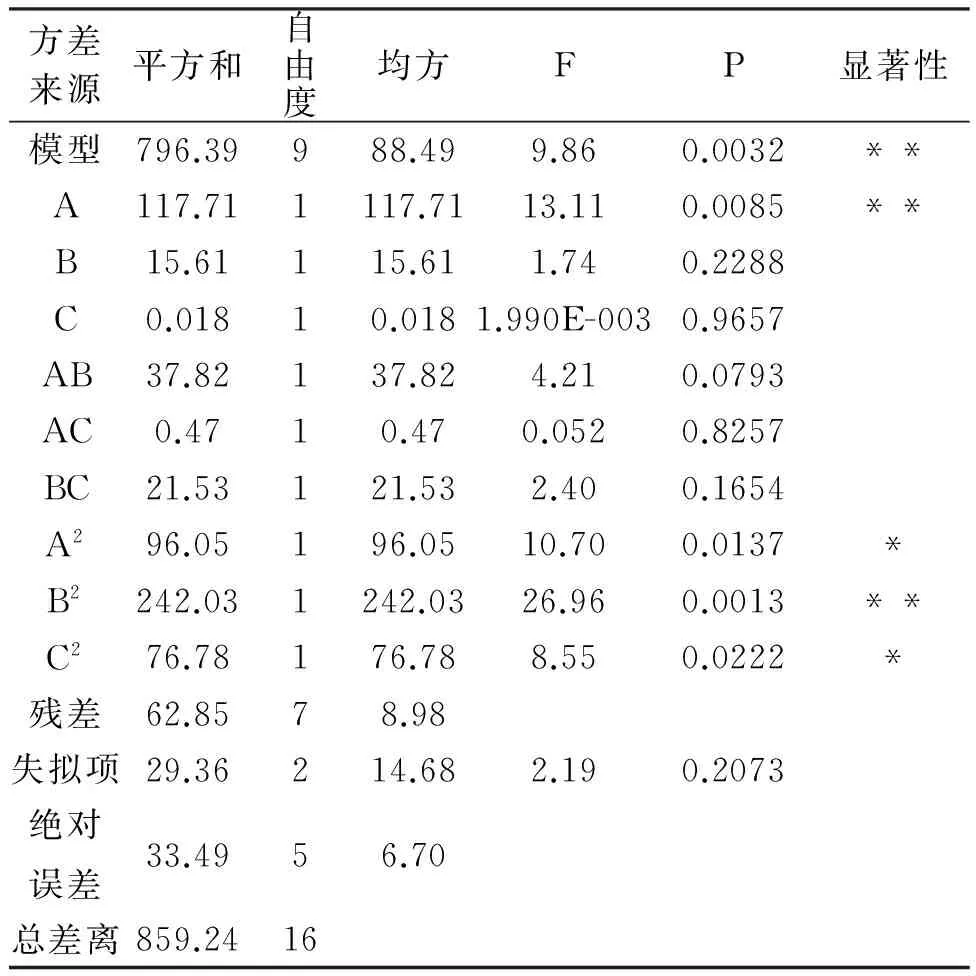
表2 回归模型参数检验
注:***差异极显著(P<0.001);**差异高度显著(P<0.01);*差异显著(P<0.05)
由表2可知,模型P<0.01,表明响应回归模型达到了高度显著水平,说明模型可靠。回归方程相关系数R2=0.9269,说明该模型拟合程度较好,表明该方程较好地反映了液料比、乙醇浓度和提取温度与山苦荬黄酮提取含量的关系,因此可用此模型对山苦荬黄酮的提取进行分析和预测。由回归模型的方差分析结果可知,方程一次项A和二次项B2对黄酮提取的影响高度显著,A2、C2对黄酮提取的影响显著。由F值可以判断,在所选实验范围内,三个因素对黄酮提取的影响顺序为液料比>乙醇浓度>提取温度。各因子交互作用对黄酮提取率影响的分析见图5-图7。由图可知,液料比(A)、乙醇浓度(B)、提取温度(C)对总黄酮提取的影响均表现为先上升后下降的趋势,同时在各因子交互作用图中交互因子对黄酮提取率影响均能够达到响应值的极大值,其中因素A影响最显著,表现为曲面最陡峭,响应值变化较大。

图5 液料比和乙醇浓度交互作用对总黄酮提取量的 响应面图

图6 液料比和提取温度交互作用对总黄酮提取量的 响应面图

图7 乙醇浓度和提取温度交互作用对总黄酮提取量的 响应面图
通过响应面设计软件分析得到山苦荬总黄酮的最佳提取工艺为:液料比27.07:1、乙醇浓度58.08wt.%、提取温度61.01 ℃,此条件下总黄酮的理论含量为117.32mg·g-1。考虑实际操作的情况,将提取条件修正为液料比27:1、乙醇浓度58wt.%、提取温度61 ℃,此条件下得到山苦荬总黄酮的含量为116.55mg·g-1。两者相比,相对误差约为0.66wt.%,说明响应面优化结果可靠。
2.4 抗氧化活性测定
参照文献[7]的方法,将样品溶液及阳性对照品溶液用乙醇配制成一系列浓度,测定不同浓度样品及阳性对照品对DPPH的清除能力,每份样品和阳性对照品平行操作3次,取平均值,计算出清除率。通过回归分析得到山苦荬总黄酮对DPPH自由基清除能力的IC50为73.00±2.52μg/mL,但弱于Vc(IC50=30.20±1.94μg/mL)的清除作用。由此可知,山苦荬总黄酮样品对DPPH自由基具有较好的消除能力。此外,山苦荬总黄酮对自由基的清除能力与总黄酮含量成正相关性。
3 结论
本实验在单因素试验基础上,采用响应面法优化了山苦荬总黄酮的提取工艺并在此条件下提取了总黄酮。抗氧化测定显示山苦荬总黄酮具有较好的消除DPPH自由基的能力。这为山苦荬的药理活性物质基础的进一步研究提供了实验依据,同时也为山苦荬在保健品等抗衰老制剂领域的开发利用提供了一定的理论基础。
[1]国家中医药管理局编.中华本草[M].贵阳:贵州科技出版社,2005.
[2]ZhangS.J,ZhaoM,BaiL.M,etal.BioactiveguaianolidesfromSiyekucai(Ixerischinensis)[J].JournalofNaturalProducts,2006,69:1425-1428.
[3]杨树青,朱晓伟,申键,等.苦荬菜属植物化学成分及药理活性研究进展[J].内蒙古医科大学学报,2013,35(S1):111-115.
[4]张垠,童志平,薛鹏禧,等.藏药山苦荬化学成分研究[J].安徽农业科学,2010,38(29):16222-16225.
[5]张垠.藏药山苦卖化学成分的研究[D].成都:西南交通大学,2011.
[6]吴七十三,王青虎,那音台.蒙药光叶山苦荬化学成分研究[J].中药材,2012,35(12):1945-1949.
[7]ZhengQ.S.,SunX.L.,XuB.,etal.Protectiveeffectsofuteolin-7-O-β-Dglucosideagainstliverinjurycausedbycarbontertrachloride[J].Pharmazie,2004,59(4):286-289.
[8]ChiangL.C.,ChengH.Y.,ChenC.C.,etal.Invitroanti-leukemicandantiviralactivitiesoftraditionallyusedmedicinalplantsinTaiwan[J].AmericanJournalofChineseMedicine,2004,32(5):695-704.
[9]邸子真,王光函,姜鸿,等.中华苦荬菜治疗糖尿病并发症的物质基础研究[J].医药导报,2011,30(11):1429-1431.
[10]罗伟强,黄润均,邓光辉.苦荬菜茎黄酮类化合物提取方法研究[J].广西民族学院学报(自然科学版),2003,9(1):31-32.
[11]周向军,高义霞,张霞.响应面法优化黄花菜总黄酮提取工艺[J].中国实验方剂学杂志,2011,17(16):29-32.
[12]甘秀海,梁志远,赵超.冷水花总黄酮的提取工艺优选及抗氧化活性考察[J].中国实验方剂学杂志,2015,21(16):10-13.
[13]周丹蓉,郑少泉,蒋际谋.响应面法优化枇杷花总黄酮超声波辅助提取工艺的研究[J].热带作物学报,2012,33(7):1219-1224.
[14]郑丹丹,王京龙,王占一,等.石榴叶总黄酮的提取工艺及抗氧化活性考察[J].中国实验方剂学杂志,2016,22(6):12-16.
[责任编辑:袁向芬]
Flavonoid extraction fromIxerischinensis(Thunb) Nakai and its antioxidant activity with DPPH
TAI Wen-jie, CHEN Sheng-ke, GAN Xiu-hai
(School of Chemistry and Life Science, Guizhou Education University, Guiyang, Guizhou, 550018)
The extraction process of total flavonoids fromIxerischinensis(Thunb.)Nakaiisoptimizedbyresponsesurfacemethodologybasedonsinglefactorexperiments.ThenthetotalflavonoidsareextractedanditsantioxidationareevaluatedagainstDPPHfreeradical.Theresultsshowthattheoptimumconditionisasfollows:li-quid-solidratio27∶1,ethanolconcentration58wt.%andextractiontemperature61°C.Inthiscondition,theextractionrateoftotalflavonoidsis116.55mg·g-1.Besides,thetotalflavonoidsofIxerischinensis(Thunb.)NakaipossessgoodscavengingabilityonDPPH.
Ixerischinensis(Thunb.) Nakai; Total flavonoids; Response surface methodology; Antioxidation
2016-11-29
贵州师范学院学生科研项目“山苦荬总黄酮提取及抗氧化活性测定”(项目编号:DXS2016112)。
太文杰(1994-),男,河北阳原人,贵州师范学院在读本科生,研究方向:中药化学。
R284.2
A
1674-7798(2016)12-0059-05
