基于萘酰亚胺骨架的双光子荧光探针构建及应用
2016-04-17祝新月张海霞
祝新月,张海霞
(兰州大学化学化工学院,甘肃省有色金属化学与资源利用重点实验室,功能有机分子化学国家重点实验室,甘肃兰州730000)
基于萘酰亚胺骨架的双光子荧光探针构建及应用
祝新月,张海霞*
(兰州大学化学化工学院,甘肃省有色金属化学与资源利用重点实验室,功能有机分子化学国家重点实验室,甘肃兰州730000)
荧光成像技术作为一种可以在无损条件下可视化探究生命活动的手段,近年来得到了广泛的关注。双光子荧光显微镜因拥有背景荧光低,光致损伤小,样品穿透深度大,成像观测时间长等其它成像方法无法比拟的优势已经成为了荧光成像不可或缺的工具。双光子荧光探针作为成像过程中荧光信号的承担者在双光子成像过程中起着至关重要的作用,在目前已报道的众多双光子成像的材料中,基于有机小分子构建的双光子荧光探针因具有细胞穿透能力强,成像速度快,特异性强,易修饰等特点得到了蓬勃的发展。该文综述了近两年双光子荧光探针成像研究的进展,并对双光子荧光探针的发展前景进行了展望。
双光子;探针;成像
0 引言
一花一世界,一叶一菩提,人类对于微观世界的探索从未止歇。显微镜的问世为人们揭开了微观世界的面纱,但是简单的观察已经不能满足人们探寻生命奥秘的渴求,研究生命体内分子间的相互作用,获得更直观有效的生命信息,已经成为了生命科学的一个发展趋势。为了实现这一目标,科研工作者开发了大量的分析和成像手段,操作简单,灵敏度高的荧光成像作为一种可以对生命体进行无损成像方法得到了广泛关注。双光子成像更是因为背景荧光低,光致损伤小,样品穿透深度大,成像观测时间长等独特的优势在细胞和组织甚至活体成像中得到了广泛的应用。
1 双光子激光扫描显微镜
1931年Maria Göeppert-Mayer提出分子可以同时吸收两个光子被激发至激发态,建立了双光子成像的理论基础[1],这一光物理过程于1963年被Kaiser和Garret用实验证明。经过了前期漫长的探索,也得益于工业技术发展,1990年Denk.Webb及其合作者成功的发明双光子激光扫描显微镜[2],开启了3D活体成像的新篇章。
区别于传统的单光子激光共聚焦成像技术,双光子激光扫描显微镜利用两个同时发射的近红外区段的低能量的光子作为激发光源[3],由于双光子材料要同时吸收两个光子以达到激发态,只有光通量最高的区域才能够被成功的激发,这一特性使得双光子显微镜拥有了局域性成像的性质,有效的降低了背景荧光的干扰(图1)。同时位于生物窗口(600~950 nm)的近红外区段的长波激发也避免了生物大分子自发荧光的干扰 (血红蛋白和组织色素的吸收和发射在紫外可见区),降低了光漂白和光损伤,使得生物材料可以长期的保持活性,可以为人们提供更长的观测时间和更深的组织深度的成像信息。

图1 单(a)/双(b)光子荧光激发发射过程[3]Fig.1 The process of One(a)/Two(b)photon fluorescence excitation and emission[3]
1.1 双光子吸收材料
具有双光子吸收性能的材料是双光子荧光成像的关键所在,随着双光子荧光显微镜的发展,大量的双光子材料被设计和研究(图2),包括金纳米材料[4], 石墨烯材料[5],有序纳米硅材料[6],有机量子点[7],有机小分子[8]和聚合物[9]。
其中有机小分子荧光探针因易修饰,毒性低,细胞渗透快等特点得到了广泛的关注,大量基于有机小分子骨架的荧光探针被合成和应用。常用的小分子骨架包括(图3):苯并咪唑[10],香豆素[11],部花菁[12],芴[13],罗丹明[14],喹啉[15],吡唑硼[16],苯并吡喃酮[17],芘[18],萘酰亚胺[19],萘[20],苯乙烯吡嗪[21],哌洛宁[22]等,基于这些骨架,科研工作者基于的光物理过程和识别机理开展了大量的工作。
2 双光子探针设计机理
常用的荧光探针构建机理主要包括光致电子转移(photo-induced electron transfer,PET),分子内电荷转移 (intramolecular charge transfer,ICT),荧光共振能量转移(fluorescence/Förster resonance energy transfer,FRET)。近年来科研工作者又发现了跨键能量转移 (through-bond energy transfer,TBET),聚集诱导荧光发射 (aggregation-induced emission,AIE),激发态质子转移 (excited-state intramolecular proton transfer,ESIPT),碳氮双键异构化 (C=N isomerization),共价聚集 (covalentassembly)等新的探针构建机理,这些机理在荧光探针的设计中发挥着重要的作用。

图2 具有双光子吸收性能的材料Fig.2 Materials have two-photon absorption properties
2.1 光致电子转移(PET)
光致电子转移体系通常由荧光团(flurescence)和识别基团(receptor)两部分通过非共轭连接的方式组成。基于前线轨道理论(图4)[23],当分子中识别基团可以提供一个空轨道,而该轨道的能级介于荧光团的最高占有轨道(Highest Occupied Molecular Orbital,HOMO)和最低未占轨道能级 (Lowest Unoccupied Molecular Orbital, LUMO)之间,即可实现该过程,基于该机理设计的探针通常具有优异的荧光off-on性质。PET作为经典的荧光探针设计机理,提出至今,已被广泛的应用于实践中[24]。
2.2 分子内电荷转移(ICT)
分子内电荷转移通常发生在同时具有吸电子基团(A-acceptor)和给电子基团(D-donor)的共轭体系中(D-π-A),当外界环境变化导致给电子(吸电子)基团的给电子(吸电子)能力改变时,分子的电荷分布发生变化,其荧光性质也会随之产生相应的变化(图5)。基于该机理设计的探针通常拥有优异的比率荧光性能,目前已有大量的研究被报道[25]。
2.3 荧光共振能量转移(FRET)
1948年Theodor Förster建立了荧光共振能量转移过程的理论基础[26]。荧光共振能量转移是荧光团之间的能量传递过程,这种非辐射的能量传递一般发生在分子间距离小于100 Å的两个分子之间,以荧光素 (Fluorescein)和罗丹明(Rhdamine)的体系为例(图6),能量供体荧光素(Donor)的发射光谱与受体罗丹明(Acceptor)的吸收光谱有一定的光谱重叠(Spectral Overlap),体系被激发后,受体分子吸收由供体分子非辐射弛豫形式所发出的能量,完成该过程的能量传递,同时完成供体与受体分子之间的荧光信号的传递。由于可用于构建FRET过程的能量供体和受体的资源非常丰富,所以大量基于该机理的探针被设计[27]。
2.4 跨键能量转移(TBET)
跨键能量转移也是一种两个分子间非辐射的能量传递过程,于1987年由Verhoeven等首次提出[28], 近年来得到了广泛的关注与传统的FRET过程不同,TBET不要求能量供体和受体之间的光谱重叠,而是通过共轭的方式将作为供体的荧光团(Donor)和受体(Accepter)连接在一起,并保证供体与受体的空间扭转,使其形成一个能量传递系统,而不是大共轭的平面分子(图7),基于该机理构建的探针通常拥有很好的比率荧光性能[29]。

图3 常用的小分子双光子骨架(1-苯并咪唑[10],2-香豆素[11],3-部花菁[12],4-芴[13],5-罗丹明[14],6-喹啉[15],7-吡唑硼[16],8-苯并吡喃酮[17],9-芘[18],10-萘酰亚胺[19],11-萘[20],12-苯乙烯吡嗪[21],13-哌洛宁[22])Fig.3 Commonly used small molecule two-photon skeleton(1-benzene and imidazole[10],2-coumarin[11],3-hemicyenine[12],4-fluorene[13],5-rhodamine[14],6-quinoline[15],7-pyrazole boron[16],8-benzo pyran ketone[17],9-pyrene[18],10-naphthalene imide[19],11-naphthalene[20],12-styrene pyrazine[21],13-pp doronin[22])

图4 PET机理[24]Fig.4 The principle of PET[24]

图5 ICT机理Fig.5 The principle of ICT

图6 FRET机理[27]Fig.6 The principle of FRET[27]

图7 TBET机理Fig.7 The principle of TBET
2.5 聚集诱导荧光发射(AIE)
聚集诱导荧光发射是2001年由唐本忠课题组发现的光物理现象。通常情况下,聚集态的ππ堆积会引起荧光分子(Pyrene)的荧光淬灭,该现象被称为聚集诱导荧光淬灭 (aggregation-caused quenching,ACQ),而具有AIE性质的分子(HPS)与传统的荧光分子不同,在非聚集态下由于分子内苯环的快速旋转,其激发态的能量通过非辐射的形式弛豫无荧光,而当外界环境的改变使苯环的自由旋转被禁阻时,分子会发射出强烈的荧光(图8)[30],这一特殊的性质使AIE得到了广泛的应用[31]。
2.6 激发态质子转移(ESIPT)

图8 AIE机理[30]Fig.8 The principle of AIE[30]
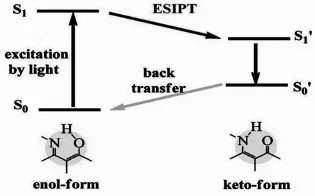
图9 ESIPT机理[25]Fig.9 The principle of ESIPT[25]
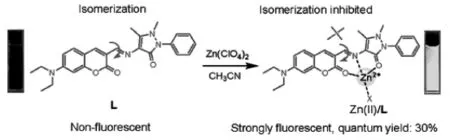
图10 C=N异构化机理[34]Fig.10 The principle of C=N isomerization[34]
激发态质子转移于1973年由Sengupta和Kasha首次提出[32],是指处于激发态的分子内部邻近质子供体与质子受体之间的质子转移过程(图9),该过程主要发生于羟基上的氢到羧基上的氧或氨基上的氢到亚氨基上的氮之间,通过分子内氢键形成五/六元环来实现,激发态质子转移完成后,回到基态的分子再由酮(keto-form)异构化回到醇(enol-form)的结构。ESIPT过程的实现,一般要求质子供体和受体之间的距离小于2Å,经历了这一过程的分子,通常紫外吸收性质不变,而荧光性质发生巨大变化。因质子转移有速度快(1-10皮秒)[33],斯托克斯位移(Stokes shift)大的特点,和显著的基态激发态分子互变异构的双荧光特性,ESIPT被广泛的应用于荧光探针的设计中[25]。
2.7 碳氮双键异构化(C=N异构化)
C=N异构化作为一种新型探针设计机理,2007年,汪鹏飞等首次报道[34],通过对化合物构象受限的光物理过程研究,发现C=N异构化是一个非常重要的激发态弛豫过程,由于C=N快速的异构化,通常会导致含有此官能团的荧光骨架无荧光,而当C=N的异构化被抑制,分子则会恢复原有的荧光发射(图10)。近年来已有大量的基于该机理的探针被设计[35]。
2.8 共价聚集
2010年Anslyn等首次报道了新型的荧光探针NO550用以检测生物体内的一氧化氮(NO),该探针基于共价聚集的机理设计,通过一氧化氮与氨基形成重氮键诱导的荧光信号的改变来完成NO的识别(图11)[36]。2014年Lv X等以氟硼吡咯为荧光骨架基于这一机理构建了NO探针,并将其成功的应用于NO的细胞成像[37]。杨有军等在2015年分别报道了可以应用于细胞成像的aBCLs系列荧光染料和检测亚硝酸钠的探针NT550,进一步拓展了共价聚集机理的平台[38]。
3 双光子荧光探针的应用
近年来荧光探针得到了蓬勃的发展,该文课题组在这方面也展开了一些研究[39-48]。对于在生命体系成像研究中的具有巨大优势的双光子荧光探针也进行了一些探索,该文结合前期的工作以及相关研究就近两年发表的双光子荧光探针进行简要的介绍[49]。
3.1 双光子pH探针

图11 共价聚集的机理[36]Fig.11 The principle of covalent assemble[36]
细胞内的pH水平是反映细胞新陈代谢过程的重要参数,正常的生理条件下细胞内液的pH约为7.2,线粒体内pH约为8.0,溶酶体为4.0~5.5。pH的变化与细胞间的信号传递,细胞增殖与凋亡,酶的活性,肿瘤生长都有着密切的关系。pH水平的异常会引起细胞功能的障碍,甚至诱发各种疾病[50]。建立有效的监控细胞和组织内pH变化的双光子荧光探针可以更好的了解pH值在生命体内扮演的角色。
2015年Kim小组基于ICT机理,以2-萘酚的衍生物为荧光骨架,建立了探针1(图12),探针1通过酚羟基的去质子化作用实现对pH变化的响应,在pH6~pH9的变化范围内,探针展示了从黄色到红色的发射光谱变化,可以有效的定量的监控线粒体内的pH变化[51]。
3.2 双光子离子探针
离子在生命体的生理和病理过程中起着重要作用,对于其含量和分布的研究一直是科研工作者关注的领域[52]。
锌作为人体的必需微量元素,在人体的生长发育、免疫、内分泌等生理过程中起着极其重要的作用,其含量异常会引起细胞功能障碍,导致糖尿病,前列腺癌,帕金森病,阿茨海默症等诸多疾病[53]。2016年,Ahn等报道了基于PET机理设计的双光子锌离子探针2(图13),该探针以萘酰亚胺作为荧光骨架,N,N-二(2-吡啶甲基)乙二胺为识别基团(配体),实现了溶酶体内锌离子的检测,并成功的应用于鼠脑组织中锌离子的双光子成像[54]。
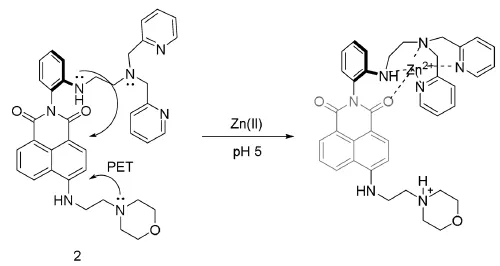
图13 锌离子探针2及其识别机理图[54]Fig.13 The molecular structure and recognition mechanism of probe 2[54]
钯作为第五周期Ⅷ族铂系元素的成员,是航天、核工业以及汽车制造业不可缺少的关键材料。钯的摄入可以对人体的皮肤和眼睛造成刺激,同时由于钯与DNA、蛋白质以及其他的生物大分子间强烈的亲和作用,会造成细胞功能的紊乱[55]。近期,谭蔚泓课题组报道了一种新型的双光子比率荧光探针3用于生物体内的钯离子成像研究(图14)[24],该探针以TBET为设计机理,将荧光团萘和罗丹明染料相连接,形成一个Np-Rh-Pd的能量传递体系,当时钯离子存在时,罗丹明开环与钯离子形成氢键,同时与萘进行快速的能量传递,完成比率荧光检测过程,探针3被成功的应用于细胞和组织(90~270 μm)的钯离子成像研究。

图14 钯离子探针3及其识别机理图[24]Fig.14 The molecular structure and recognition mechanism of probe 3[24]
氟离子与生命体的诸多生理和病理过程息息相关[56]。2015年,该文课题组报道了以萘酰亚胺为荧光骨架的探针4(图15)[39],基于氟与硅的亲和作用对氟离子进行特异性的识别。当探针与氟离子作用时,探针的硅氧键被切断,脱掉叔丁基苯基硅基,实现对氟离子的检测。该探针被成功应用于细胞和组织内的氟离子的成像。

图15 氟离子探针4及其识别机理图[39]Fig.15 The molecular structure and recognition mechanism of probe 4[39]
3.3 双光子巯基小分子、硫化氢探针
小分子巯基化合物在生命过程中扮演着重要的角色[57]。2016年该文课题组报道了反应型的双光子off-on探针5(图16)[40],探针基于光PET机理构建,以哌嗪基团连接荧光团萘酰亚胺(NAP)和对巯基具有优越的识别性能的2,4-二硝基苯磺酰基(NBDS)。由于2,4-二硝基苯磺酰基的强吸电子性能破坏了萘酰亚胺荧光团的电子分布,探针分子的荧光被淬灭。而当探针与含有巯基的被分析物作用后,2,4-二硝基苯磺酰基与哌嗪相连的S-N键被切断,生成具有强烈的荧光发射的N-butyl-naphthalimide(NAP-P)。实验结果证明探针Z1可以被应用于生物的细胞和组织中的巯基成像研究。

图16 巯基探针5及其识别机理图[40]Fig.16 The molecular structure and recognition mechanism of probe 5[40]
同年,基于PET机理,该文课题组以萘酰亚胺作为电子供体和荧光团,顺丁烯二酰亚胺作为电子受体和识别基团设计并合成了巯基探针6 (o-Z3,m-Z3和p-Z3)7(图17)[41]。通过巯基与顺丁烯二酰亚胺的双键之间的迈克加成作用,来调节电子转移的发生,从而调控萘酰亚胺荧光团的荧光性质。探针可以应用于血浆中的巯基含量的测定及细胞成像研究,此外,该文课题组结合密度泛函理论对于探针的设计给出了计算化学领域的理论支撑。

图17 巯基探针6及其识别机理图[41]Fig.17 The molecular structure and recognition mechanism of probe 6[41]
H2S作为一种重要的气体信标物质参与了大量的生理和病理过程,研究表明其在血管生成,神经调节,细胞凋亡的过程起着重要的作用[58]。2015年Ahn等以萘作为荧光骨架,改进了迈克加成机理,设计了对H2S具有高灵敏度和特异性的比率型双光子荧光探针7(图18),并将其成功的应用于细胞和组织中H2S的成像[59]。
2016年赵宝祥课题组以香豆素和部花箐两个荧光骨架构建了新的FRET平台(图19),并将其用于H2S的检测,探针8表现出了优越的FRET性能,并且可以成功的比率荧光成像线粒体中的H2S[60]。
3.4 双光子活性氧探针(ROS)和活性氮探针(RNS)
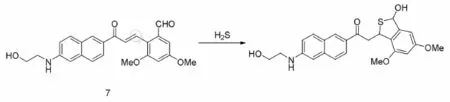
图18 H2S探针7及其识别机理图[59]Fig.18 The molecular structure and recognition mechanism of probe 7[59]
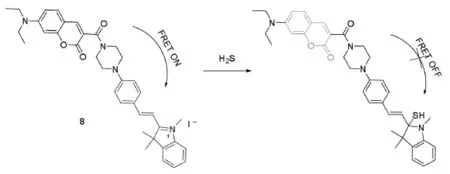
图19 H2S探针8及其识别机理图[60]Fig.19 The molecular structure and recognition mechanism of probe 8[60]
生物体内的活性氧类物质会引起细胞损伤,诱发细胞凋亡,引发各种疾病,导致机体的衰老[61]。2015年唐波课题组设计双光子过氧阴离子探针9(图20)[21],探针以苯乙烯吡嗪为荧光骨架,在其末端共轭连接两个识别基团二羟基桂皮酸,当探针与过氧阴离子作用后,羟基被氧化成酮羰基,探针的双光子吸收截面明显增大,荧光增强,从而实现对过氧阴离子的检测。探针可以实现细胞和组织(900 μm)中的过氧阴离子成像,并被成功的应用于线虫和小鼠体内的过氧阴离子含量与其寿命关系的研究。
过氧亚硝酸根离子作为生物体内的一种强氧化剂,参与了生命体的氧化还原信号传递,免疫应答等诸多的生理和病理过程,其含量的升高通常与代谢紊乱,血管疾病,甚至癌症有关[62]。 2016年Kim和Hong等报道了基于PET机理设计的双光子过氧亚硝酸根离子探针10 (图21),探针以萘为荧光骨架,N-甲基苯酚为识别基团和荧光淬灭基团,当探针与过氧亚硝酸根离子作用后,苯酚结构被剪切,探针分子的荧光恢复[63]。

图21 过氧亚硝酸根离子探针10及其识别机理图[63]Fig.21 The molecular structure and recognition mechanism of probe 10[63]
3.5 双光子生物大分子探针
研究表明组织缺氧在中风,心脏病等疾病的发生过程中扮演着重要的角色,同时恶性肿瘤的增生通常也会引起组织的缺氧,从而导致细胞内的硝基还原酶(NTR)的过表达[64],因此可以通过检测硝基还原酶的含量变化间接地实现对组织含氧量的测定。2016年谭蔚泓课题组基于PET机理,以萘为荧光骨架,硝基为响应位点,设计了探针11 (图22),在烟酰胺腺嘌呤二核苷酸(NADH)存在的情况下,探针的硝基被NTR还原成氨基,随后通过1,6-重排消除释放荧光团,荧光恢复,以实现对硝基还原酶的识别,间接反映生命体组织含氧量[65]。该探针首次成功的实现了对生物细胞和组织(70~160 μm)中的含氧量的双光子成像研究。

图22 硝基还原酶探针11及其识别机理图[65]Fig.22 The molecular structure and recognition mechanism of probe 11[65]
4 展望
双光子荧光成像在生物体的细胞,组织及活体成像的研究中有着其他成像方法无可比拟的优势。随着双光子技术的进一步完善,双光子荧光成像已经成为了不可或缺的探究生命奥秘的手段,虽然迄今已经有大量的双光子探针被设计和研究,但是相对应单光子成像探针的深入性研究,双光子探针的研究仍然具有广阔的空间和巨大的潜力。建立双光子吸收性能好,灵敏度高,选择性好,光物理性质稳定的探针依然被迫切的需要。同时现存的探针大多存在成像功能单一的缺点,单一的成像已经不能满足现今的科研需求,进一步的建立具有多功能的双光子探针势在必行。该文课题组认为下一步的研究可以从以下几个方面入手:1、构建集成化的探针,实现单一探针的多分子识别成像,通过不同的成像信号,完成多分子的识别研究。2、探针与药物结合实现检测治疗一体化,通过探针信号的变化实现药物治疗效果的可视化甚至是可控化的研究。3、小分子的探针仍然需要外界光源激发才能观察到的问题,这对于生命活动的可视化检测仍然存在一定的掣肘,因此可以考虑将小分子探针与长辉光材料相结合,构建可以一次激发长时间监测的探针材料,进一步对生命体系进行探究。
[1]Goeppert-Mayer M.überelementarakte mitzwei
quantensprüngen[J].Annalen der Physik,1931,401(2):273-294.
[2]Denk W,Strickler J H,Webb W W.Two-photon laser scanning fluorescence microscopy[J].Science,1990, 248(4951):73-76.
[3]O'daly A.Encyclopedia of life sciences[M].The United Kingdom:Macmillan Publishers Ltd,2002.
[4]Durr N J,Larson T,Smith D K,et al.Two-photon luminescence imaging of cancer cells using molecularly targeted gold nanorods[J].Nano Letters,2007,7(4):941-945.
[5]Wang L L,Zheng J,Yang S,et al.Two-photon sensing and imaging of endogenous bological cyanide in plant tissues using graphene quantum Dot/Gold nanoparticle conjugate[J].ACS Applied Materials and Interfaces,2015,7(34):19509-19515.
[6]Rendng N,Zheng J,Yang S,et al.Two-photon sensing and imaging of endogenous bological cyanide on microscopy imaging via controlled formation of 4,4′-diethylaminostyryl-2,2′-bipyridine Zn(II)surface complexes[J].Chemistry of Materials,2011,23(13):3228-3236.
[7]Liu C L,Ho M L,Chen Y C,et al.Thiol-functionalized gold nanodots:two-photon absorption property and imaging in vitro[J].Journal of Physical Chemistry C,2009, 113(50):21082-21089.
[8]Zhu M Q,Zhang G F,Li C,et al.Reversible two-photon photos witching and two-photon imaging of immunofunctionalized nanoparticles targeted to cancer cells[J]. Journal of the American Chemical Society,2011,133(2): 365-372.
[9]Parthasarathy A,Ahn H Y,Belfield K D,et al.Two-photon excited fluorescence of a conjugated polyelectrolyte and its application in cell imaging[J].Acs Applied Materials and Interfaces,2010,2(10):2744-2748.
[10]Joong K H,Ho H C,Myung K H.Benzimidazole-based ratiometric two-photon fluorescent probes for acidic pH in live cells and tissues[J].Journal of the American Chemical Society,2013,135(47):17969-17977.
[11]Sarkar A R,Heo C H,Lee H W,et al.Red emissive twophoton probe for real-time imaging of mitochondria trafficking[J].Analytical Chemistry,2014,86(12):5638-5641.
[12]Niu W F,Guo L,Li Y H,et al.Highly selective two-photon fluorescent probe for ratiometric sensing and imaging cysteine in mitochondria[J].Analytical Chemistry,2016, 88(3):1908-1914.
[13]Gursahani H I,Schaefer S.Mitochondria-targeted reaction-based two-photon fluorescent probe for imaging of superoxide anion in live cells and in vivo[J].Analytical Chemistry,2004,287(6):H2659-H2665.
[14]Elisa T,Lippard S J.Ratiometric and intensity-based zinc sensors built on rhodol and rhodamine platforms[J]. Inorganic Chemistry,2010,49(20):9113-9115.
[15]Zeng L Y,Chen S Y,Xia T,et al.Two-photon fluorescent probe for detection of exogenous and endogenous hydrogen persulfide and polysulfide in living organisms[J]. Analytical Chemistry,2015,87(5):3004-3010.
[16]Liu H W,Zhang X B,Zhang J,et al.Efficient two-photon fluorescent probe with red emission for imaging of thiophenols in living cells and tissues[J].Analytical Chemistry,2015,87(17):8896-8903.
[17]Lee Y H,Ren W X,Han J,et al.Highly selective twophoton imaging of cysteine in cancerous cells and tissues [J].Chemical Communications,2015,51(76):14401-14404.
[18]Hu Y,Heo C H,Kim G,et al.One-photon and two-photon sensing of biothiols using a bis-pyrene-Cu(II)ensemble and its application to image GSH in the cells and tissues[J].Analytical Chemistry,2015,87(6):3308-3313.
[19]Yu H B,Xiao Y,Jin L J.A lysosome-targetable and twophoton fluorescent probe for monitoring endogenous and exogenous nitric oxide in living cells[J].Journal of the American Chemical Society,2012,134 (42):17486-17489.
[20]Rao A S,Kim D,Wang T,et al.Reaction-based twophoton probes for mercury ions:fluorescence imaging with dual optical windows[J].Organic Letters,2012,14 (10):2598-2601.
[21]Zhang W,Wang X,Li P,et al.Elucidating the relationship between superoxide anion levels and lifespan using an enhanced two-photon fluorescence imaging probe[J]. Chemical Communications,2015,51(47):9710-9713.
[22]Liu W M,Xu L W,Zhang H Y,et al.Dithiolane linked thiorhodamine dimer for Hg2+recognition in living cells [J].Organic and Biomolecular Chemistry,2009,7(4): 660-664.
[23]Lakowicz J R,ed.Pinciples of fluorescence pectroscopy, 1st.[M].New York:Springer,1983.
[24]Zhang W,Ma Z,Du L P,et al.Design strategy for photoinduced electron transfer-based small-molecule fluorescent probes of biomacromolecules[J].Analyst,2014, 139(11):2641-2649.
[25]Yang Y,Zhao Q,Feng W,et al.Luminescent chemod-osimeters for bioimaging[J].Chemical Reviews,2013, 113(1):192-270.
[26]Förster T.Zwischenmolekulare energiewanderung and fluoreszenz[J].Annalen Der,1948,437(1-2):55-75.
[27]Förster T.10th Spiers Memorial Lecture.Transfer mechanisms of electronic excitation[J].Discussions of the Faraday Society,1959,248(27):7-17.
[28]Oevering H,Paddon-Row M N,Heppener M,et al. Long-range photoinduced through-bond electron transfer and radiative recombination via rigid nonconjugated bridges:distance and solvent dependence[J].Journal of the American Chemical Society,1987,109(11):3258-3269.
[29]Zhou L Y,Wang Q Q,Zhang X B,et al.Through-bond energy transfer-based ratiometric two-photon probe for fluorescent imaging of Pd2+ions in living cells and tissues [J].Analytical Chemistry,2015,87(8):4503-4507.
[30]Luo J,Xie Z,Lam J W Y,et al.Aggregation-induced emission of 1-methyl-1,2,3,4,5-pentaphenylsilole[J]. Chemical Communications,2001,18(18):1740-1741.
[31]Hong Y N,Lam J W Y,Tang B Z.Aggregation-induced Emission:Phenomenon,Mechanism and Applications[J]. Chemical Communications,2009,29(29):4332-4353.
[32]Sengupta P K,Kasha M.Excited state proton-transfer spectroscopy of 3-hydroxyflavone and quercetin[J]. Chemical Physics Letters,1979,68(2):382-385.
[33]Berezin M Y,Achilefu S.Fluorescence lifetime measurements and biological imaging[J].Chemical Reviews,2010,110(5):2641-2684.
[34]Wu J S,Liu W M,Zhuang X Q,et al.Fluorescence turn on of coumarin derivatives by metal cations:A new signaling mechanism based on C=N Isomerization[J].Organic Letters,2007,9(1):33-36.
[35]Gaenko A V,Devarajan A,Gagliardi L,et al.Ab initio DFT study of the Z-E isomerization pathways of N-benzylideneaniline[J].Theoretical Chemistry Accounts,2007,118(1):271-279.
[36]Yang Y J,Seidlits S K,Adams M M,et al.A highly selective low-background fluorescent imaging agent for nitric oxide[J].Journal of the American Chemical Society,2010,132(38):13114-13116.
[37]Lv X,Wang Y,Zhang S,et al.A specific fluorescent probe for NO based on a new NO-binding group[J]. Chemical Communications,2014,50(56):7499-7502.
[38]Shen Y M,Zhang Q J,Qian X H,et al.Practical assay for nitrite and nitrosothiol as an alternative to the Griess Assay or the 2,3-diaminonaphtHalene assay[J].Analytical Chemistry,2015,87(2):1274-1280.
[39]Xinyue Zhu,Jianxi Wang,Jianjian Zhang,et al.Imaging of Fluoride Ion in Living Cells and Tissues with a Two-Photon Ratiometric Fluorescence Probe[J].Sensors, 2015,15:1611-1622.
[40]Xinyue Zhu,Yan Li,Wenyan Zan,et al.A two-photon off-on fluorescence probe for imaging thiols in live cells and tissues[J].Photochem.Photobiol.Sci.,2016,15: 412-419.
[41]Xinyue Zhu,Hong Gao,Wenyan Zan,et al.A rational designed thiols fluorescence probe:The positional isomer in PET[J].Tetrahedron,2016,72:2048-2056.
[42]Jianjian Zhang,Chuwen Li,Rui Zhang,et al.A Phosphinate-Based Near-Infrared Fluorescence Probe for Imaging the Superoxide Radical Anion in In Vitro and In Vivo [J].Chem.Commun.,2016,52(13):2679-2682.
[43]Jianjian Zhang,Lulu Ning,Jiting Liu,et al.Naked-Eye and Near-Infrared Fluorescence Probe for Hydrazine and Its Applications in In Vitro and In Vivo Bioimaging[J]. Anal.Chem.,2015,87(17):9101-9107.
[44]Jianjian Zhang,Jianxi Wang,Jiting Liu,et al.Near-Infrared and Naked-Eye Fluorescence Probe for Direct and Highly Selective Detection of Cysteine and Its Application in Living Cells[J].Anal.Chem.,2015,87(9): 4856-4863.
[45]Jianjian Zhang,Bianfei Yu,Lulu Ning,et al.A Near-Infrared Fluorescence Probe for Thiols Based on Analyte-Specific Cleavage of Carbamate and Its Application in Bioimaging[J].Eur.J.Org.Chem.,2015,15(8):1711-1718.
[46]Jianxi Wang,Cheng Zhou,Jianjian Zhang,et al.A new fluorescence turn-on probe for biothiols based on photoinduced electron transfer and its application in living cells[J].Spectrochim.Acta,Part A,2016,166:31-37.
[47]Jianxi Wang,Cheng Zhou,Wei Liu,et al.A near-infrared fluorescent probe based on chloroacetate modified naphthofluorescein for selectively detecting cysteine/homocysteine and its application in living cells[J].Photochem.Photobiol.Sci.,2016,15:1393-1399.
[48]Li Y,Qiu Y,Zhang J,et al.Naphthalimide derived fluorescent probes with turn-on response for Au(3+)and the application for biological visualization[J].Biosensors& Bioelectronics,2016,83:334-338.
[49]Kim H M,Cho B R.Small-molecule two-photon probes for bioimaging applications[J].Chemical Reviews,2015, 115(11):5014-5055.
[50]Gursahani H I,Schaefer S.Acidification reduces mito-chondrial calcium uptake in rat cardiac mitochondria[J]. American Journal of Physiology Heart and Circulatory Physiology,2004,287(6):H2659-H2665.
[51]Sarkar A R,Heo C H,Xu L,et al.A ratiometric two-photon probe for quantitative imaging of mitochondrial pH values[J].Chemical Science,2016,7(1):766-773.
[52]Myung K H,Rae C B.Two-photon probes for intracellular free metal ions,acidic vesicles,and lipid rafts in live tissues[J].Accounts of Chemical Research,2009,42(7): 863-872.
[53]Frederickson C J,Koh J Y,Bush A I.The neurobiology of zinc in health and disease[J].Nature Reviews Neuroscience,2005,6(6):449-462.
[54]Lee H J,Cho C W,Seo H,et al.A two-photon fluorescent probe for lysosomal zinc ions[J].Chemical Communications,2016,52(1):124-127.
[55]Yusop R M,Unciti-Broceta A,Johansson E M V,et al. Palladium-mediated intracellular chemistry[J].Nature Chemistry,2011,3(11):239-243.
[56]Sessler J L,Gale P A,Cho W S.Anion Receptor Chemistry[M].Cambridge.UK.:RSC Publishing,2006.
[57]Shahrokhian S.Lead phthalocyanine as a selective carrier for preparation of a cysteine-selective electrode[J]. Analytical Chemistry,2001,73(24):5972-5978.
[58]Yang G,Wu L,Jiang B,et al.H2S as a physiologic vasorelaxant:hypertension in mice with deletion of cystathionine gamma-lyase[J].Science,2008,322(5901): 587-590.
[59]Singha S,Kim D,Moon H,et al.Toward a selective,sensitive,fast-responsive,and biocompatible two-photon probe for hydrogen sulfide in live cells[J].Analytical Chemistry,2015,87(2):1188-1195.
[60]Feng X,Zhang T,Liu J T,et al.A new ratiometric fluorescent probe for rapid,sensitive and selective detection of endogenous hydrogen sulfide in mitochondria[J]. Chemical Communications,2016,52(15):3131-3134.
[61]Lee S J,Hwang A B,Kenyon C.Inhibition of respiration extends C.elegans life spanvia reactive oxygen species that Increase HIF-1 activity[J].Current Biology CB, 2010,20(23):2131-2136.
[62]Radi R.Peroxynitrite,A stealthy biological oxidant[J]. Journal of Biological Chemistry,2013,288(37):26464-26472.
[63]Park J H,Heo C H,Kim H M,et al.Two-photon fluorescent probe for peroxynitrite[J].Tetrahedron Letters, 2016,57(6):715-718.
[64]Xu K H,Wang F,Pan X H,et al.High selectivity imaging of nitroreductase using a near-infrared fluorescence probe in hypoxic tumor[J].Chemical Communications, 2013,49(25):2554-2556.
[65]Zhang J,Liu H W,Hu X X,et al.Efficient two-photon fluorescent probe for nitroreductase detection and hypoxia imaging in tumor cells and tissues[J].Analytical Chemistry,2015,87(23):11832-11839.
Synthesis and application of two-photon fluorescent probes based on naphthalimide
Zhu Xin-yue,Zhang Hai-xia*
(State Key Laboratory of Applied Organic Chemistry,Key Laboratory of Nonferrous Metals Chemistry and Resources Utilization of Gansu Province,College of Chemistry and Chemical Engineering,Lanzhou University,Lanzhou 730000,China)
Biological imaging technology as the best noninvasive way to study living systems in a natural setting has obtained widespread attention in recent years.Two-photon fluorescence microscope has become the indispensable tool in the field of biological imaging due to the advantages of high signal-to-noise ratio,localized excitation,deeper tissue penetration,less photodamage,prolonged observation time,and better three-dimensional imaging.TP fluorescent probes as the render of fluorescent signals play key roles in two-photon imaging.So far,there are many of the two-photon imaging material have been reported,among which two-photon fluorescent probes based on organic small molecular have been development vigorous owning the good cell permeability,fast imaging,high specificity and easy modification.We summarized the studies of imaging by two-photon fluorescence probe in nearly two years, and the prospect of the development of two-photon fluorescence probes was given.
two-photon;probes;imaging
国家自然科学面上基金项目(21575055,21375052)
*通信联系人,E-mail:zhanghx@lzu.edu.cn,Tel.:Fax:0931-8912058
