周期性牵拉与TNF-α对角膜成纤维细胞增殖的影响
2016-04-15冯鹏飞李晓娜陈维毅王晓君
姚 艳,冯鹏飞,李晓娜,贺 瑞,陈维毅,王晓君
(1.太原理工大学 a.力学学院,b.应用力学与生物医学工程研究所,太原030024;
2.山西省眼科医院 准分子激光室,太原 030002)
周期性牵拉与TNF-α对角膜成纤维细胞增殖的影响
姚艳1a,冯鹏飞1b,李晓娜1b,贺瑞2,陈维毅1b,王晓君1a
(1.太原理工大学 a.力学学院,b.应用力学与生物医学工程研究所,太原030024;
2.山西省眼科医院 准分子激光室,太原 030002)
摘要:利用Flexcell4000柔性基底拉伸系统对角膜成纤维细胞实施应变为5%或15%、频率为0.1 Hz的周期性牵拉载荷,用质量浓度为1 ng/mL或10 ng/mL的肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)处理,并采用流式细胞仪检测细胞周期,研究周期性牵拉与TNF-α对角膜成纤维细胞增殖的影响。结果表明:5%周期性牵拉或TNF-α单独作用对正常及圆锥角膜成纤维细胞S期细胞比例均无显著性影响;15%牵拉使正常及圆锥角膜成纤维细胞S期细胞比例均显著下降;与正常角膜相比,15%牵拉和TNF-α共同作用使圆锥角膜S期细胞比例下降更显著。周期性牵拉及TNF-α可能通过抑制圆锥角膜基质细胞增殖参与圆锥角膜的发生和发展。
关键词:周期性牵拉;肿瘤坏死因子;圆锥角膜;成纤维细胞;细胞增殖
圆锥角膜是一种原发性角膜退变性疾病。通常发生于青春期前后,常表现为双眼先后进行性发病,发病率介于0.05%~0.23%之间,与性别种族无关[1]。目前病因尚不清楚,可能与眼角膜损伤有关[2]。角膜基质细胞是正常角膜基质中的主要细胞成分,在眼角膜未受损伤的情况下,角膜基质细胞处于相对静止状态,细胞呈扁平多突起状,通过细胞突起顶部的缝隙连接与相邻细胞发生联系。在眼角膜受到损伤时,原本处于静止状态的角膜基质细胞被激活,转变为修复表型,被称作角膜成纤维细胞。激活后的角膜成纤维细胞迁移到受损伤的角膜基质附近,参与组织修复过程。与角膜基质细胞相比,成纤维细胞的细胞形态发生明显改变,由原来的扁平多突起状态转变成长梭形,细胞功能也发生显著变化,细胞合成和分泌细胞外基质的水平大大提高。此时,它的增殖平衡对于角膜的透光性、屈光性及保护、防御功能的发挥至关重要[3]。
在圆锥角膜疾病发展过程中,角膜会受到不同程度力的刺激,但角膜成纤维细胞的增殖在力学刺激下是如何响应的,目前尚不清楚。有文献报道,炎性因子TNF-α在圆锥角膜中的表达明显增高,它在调节炎症反应和调节细胞生存或死亡方面起着重要作用[4],可能参与了圆锥角膜的发生和发展[5-6]。而TNF-α对角膜成纤维细胞增殖的影响仍不清楚。在生理环境中,细胞的增殖会受到多种因素的共同作用。因此,研究周期性牵拉和炎性因子TNF-α单独或联合作用对角膜成纤维细胞增殖的影响十分重要。
本文通过对体外培养的正常人和圆锥角膜患者的角膜成纤维细胞给予周期性机械牵拉和TNF-α处理,研究周期性牵拉和TNF-α对角膜成纤维细胞增殖的影响,进而探究圆锥角膜的发病原因和发展机制,为手术治疗、术后恢复提供参考和理论依据。
1材料与方法
1.1细胞提取与培养
圆锥角膜和正常角膜均取自于山西省眼科医院。圆锥角膜患者1:男,1985年生,2003年被诊断为圆锥角膜,2013年底施左眼角膜移植术。圆锥角膜患者2:男,1997年生,2005年视力开始下降,2012年初被诊断为圆锥角膜,2012年底施左眼角膜移植术,2013年底施右眼角膜移植术。首先机械剥离上皮层和内皮层,然后用2 mg/mL的Ⅱ型胶原酶消化组织块,直至培养液完全清亮。离心后获得角膜成纤维细胞,加入胎牛血清(Fetal bovine serum,FBS)体积分数为10%的F12全血清培养基,置于37 ℃、二氧化碳体积分数为5%的孵箱内培养,细胞覆盖培养皿90%左右时进行传代。本文研究采用第五代角膜成纤维细胞。文中NC(Normal cornea)代表正常角膜,KC(Keratoconus)代表圆锥角膜。KC1和KC2分别代表患者1、患者2的圆锥角膜。
1.2细胞周期性牵拉及TNF-α处理
采用Flexcell4000柔性基底拉伸系统(美国Flexcell)对角膜成纤维细胞实施周期性机械牵拉。该系统通过真空泵产生的负压抽吸特制的柔性培养膜,使黏附生长在培养膜上的细胞受到周期性牵拉作用。整个加载装置放置于培养箱内,加载程序由Flexcell4000计算机软件自动控制。本文采用应变为5%和15%,频率为0.1 Hz的正弦波周期性力学加载来模拟角膜受力。
角膜成纤维细胞用质量分数为0.25%的胰蛋白酶消化,以3×105mL-1的细胞密度接种于裱衬有I型胶原蛋白的BioFlex弹性膜六孔培养板(美国Flexcell)上,置于孵箱内培养。待细胞80%融合时,换成不含FBS的DMEM/F12(Dulbecco′s Modified Eagle Media:Nutrient Mixture F-12)培养基进行饥饿处理。12 h后添加含TNF-α(质量浓度分别为0,1,10 ng/mL)的全血清培养基,同时进行周期性力学加载,以静态培养组(未施加载荷)作为对照,每组重复3次实验。12 h后收集细胞,采用流式细胞仪检测细胞周期,观察细胞增殖情况。本研究中TNF-α质量浓度的选择参考了以前文献中所采用的TNF-α质量浓度[7-9]。
1.3细胞周期检测
用PBS清洗细胞,然后用质量分数0.25%的胰蛋白酶消化,再加入FBS体积分数为10%的F12培养基终止消化,并吹打成单细胞悬浮。1 000 r/min离心5 min,弃上清,加入预冷的70%乙醇,采用流式细胞仪进行细胞周期检测。本文以S期细胞百分比变化情况考察细胞增殖情况。
1.4统计学分析
2结果
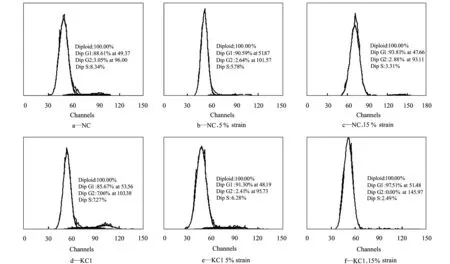

NC:Normal cornea; KC:Keratoconus图1 单独周期性牵拉对人角膜成纤维细胞增殖的影响Fig.1 The effects of cyclic stretch on human corneal fibroblasts
流式细胞仪检测图中,横坐标为荧光信号强度(用道数表示),与DNA含量成正比;纵坐标表示相对细胞数;第一峰为G1期细胞,第二峰为S期细胞(图1)。由图1可知,静态培养条件下,NC,KC1,KC2组角膜成纤维细胞处于S期细胞的比例无显著性差异。单独周期性牵拉12 h后,与静态组相比,5%周期性牵拉对NC,KC1,KC2组处于S期的细胞比例无显著性影响;15%周期性牵拉时NC,KC1,KC2组处于S期的细胞比例显著下降(P<0.05),这说明高应变条件下角膜成纤维细胞增殖受到抑制。
静态培养下,加入1 ng/mL或10 ng/mL TNF-α时,NC,KC1,KC2的S期细胞数比例有所下降,但无显著性差异(P>0.05)(图2)。这说明TNF-α单独作用对正常及圆锥角膜成纤维细胞增殖均无显著性影响。
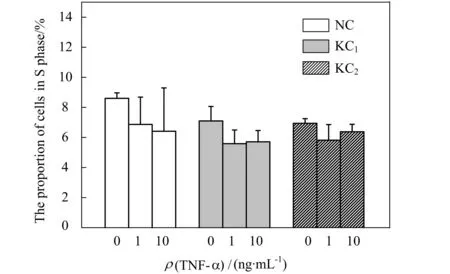
图2 TNF-α对人角膜成纤维细胞增殖的影响Fig.2 The effects of TNF-α on the proliferationof human corneal fibroblasts
5%周期性牵拉和TNF-α联合作用12 h后,NC,KC1组处于S期的细胞比例与静态对照组比较无显著性差异(P>0.05);与静态对照组比较,KC2组S期的细胞比例显著下降(P<0.05),且各组之间无显著性差异(P>0.05)(图3)。
当牵拉应变为15%时,添加1 ng/mL或10 ng/mL TNF-α后,NC,KC1,KC2组处于S期的细胞比例下降,且与NC组比较,KC组S期细胞比例下降更显著(P<0.05),KC组之间无统计学差异(P>0.05)(图3、表1)。这表明,15%周期性牵拉与TNF-α联合作用对角膜成纤维细胞增殖无协同效应,高应变和TNF-α共同作用时抑制角膜成纤维细胞增殖,且对圆锥角膜成纤维细胞增殖抑制更显著。

表1 15%牵拉下KC组与NC组细胞增殖显著性差异分析
3讨论
圆锥角膜属于角膜病的一种,对视力有严重的影响,可导致失明。但其发生发展的机理尚不明确。
研究发现,该疾病可能与隐形眼镜磨损和揉眼等机械性创伤有关[10]。而机械性创伤在导致人角膜力学微环境改变[11]的同时还使角膜中TNF-α因子表达增加[12]。但关于力学因素和TNF-α对人角膜成纤维细胞增殖的影响尚未见相关报道。
本文对正常角膜成纤维细胞和圆锥角膜成纤维细胞施加频率为0.1 Hz、应变为5%或15%的周期性牵拉,并添加不同质量浓度的TNF-α处理,12 h后采用流式细胞技术检测细胞周期。结果表明,高应变抑制角膜成纤维细胞增殖,且对圆锥角膜成纤维细胞增殖抑制更显著。而成纤维细胞的主要功能是合成细胞外基质,其增殖受到抑制,不利于角膜成纤维细胞外基质的合成,可能使角膜进一步变薄,促进圆锥角膜病程的发展。本课题组前期研究发现,高幅度牵拉使角膜成纤维细胞中基质金属蛋白(Matrix metallo proteinases)表达增加[13],表明高应变条件下基质合成受到影响,这与本文研究结果相符。有研究报道,对离体培养的人皮肤成纤维细胞施加拉伸幅度为30%的拉力,48 h后流式细胞仪检测细胞周期,结果表明一定强度机械应力持续作用可促进皮肤成纤维细胞增殖[14];频率为0.1 Hz、应变为5%的周期性机械拉伸作用24 h和36 h能够促进兔角膜成纤维细胞增殖[15];对胎鼠肺成纤维细胞施加频率为1 Hz,拉伸幅度为5%,15 min/h间歇性牵拉24 h,能够抑制细胞增殖,并诱导其凋亡[16]。不同成纤维细胞在不同力的加载形式下,细胞增殖响应不统一,这可能与应力刺激的大小、频率、时间、加载形式以及组织来源有关。圆锥角膜成
纤维细胞增殖在不同加载时间、加载方式、加载频率下是如何响应的,还有待进一步深入研究。
本研究还发现,单独作用TNF-α对人角膜成纤维细胞增殖无显著影响,这与Mohan,et al[7]研究结果相一致。而TNF-α可抑制前列腺淋巴结癌(lymph node carcinoma of prostate,LNCaP)细胞的增殖[17],但可以促进人牙龈成纤维细胞的增殖[9],这说明不同来源的成纤维细胞对TNF-α反应有所不同。在TNF-α和5%周期性牵拉联合作用时,KC2细胞增殖受到抑制,分析可知,这可能与患者的个体差异及病程有关。圆锥角膜患者1,发病10 a,病程进展缓慢。患者2在右眼发生圆锥角膜1 a后,左眼也迅速发展成圆锥角膜,属于急性发病,因此他的角膜成纤维细胞在受到周期性牵拉和TNF-α作用时变化更显著。本研究结果还表明,TNF-α与15%周期性牵拉联合作用对角膜成纤维细胞增殖无协同效应。文献报道,白细胞介素(IL-1β)抑制皮肤微血管细胞和关节软骨细胞增殖,力学刺激促进皮肤微血管细胞和关节软骨细胞增殖,力学刺激和IL-1β同时作用时则促进其细胞增殖[18-19]。高质量浓度的外源性炎症介质前列腺素E2(Prostaglandin E2,PGE2)(100 ng/mL,500 ng/mL)能促进类风湿性关节炎中成纤维细胞样滑膜细胞增殖,但力学刺激和PGE2共同作用时对滑膜细胞增殖的下调作用并不明显[20]。可知炎性因子和力学刺激在影响细胞增殖时,它们之间的相互作用机制尚不明确。
角膜处在一个复杂的力学环境之中。本研究表明,在高应变或高应变与TNF-α联合作用条件下,角膜成纤维细胞增殖受到抑制,进而影响细胞外基质合成,使角膜进一步变薄,促进圆锥角膜病程的发展。但角膜成纤维细胞如何感受应力变化和炎性因子,实现增殖调控,这还有待进一步深入研究。参考文献:
[1]NOTTINGHAM J.Practical observations on conical cornea[M].London:Churchill,1984:1-19.
[2]BRON A,RABINOWITZ Y S.Corneal dystrophies and keratoconus[J].Curr Opin Ophthalmol,1996,7(4):71-82.
[3]RABINOWITZ Y S.Keratoconus:update and new advances[J].Surv Ophthalmol,1998,42(4):297-319.
[4]向春艳,何小燕,李逐波,等.TNF-α在癌症中的作用研究进展[J].生命科学学报,1999,24(3):250-254.
[5]LEMA I,SOBRINO T,DURJ A,et al.Subclinical keratoconus and inflammatory molecules from tears[J].Br J Ophthalmol,2009,93(6):820-834.
[6]CATHERINE P,HEATHER L C,JASON J N,et al.Tear proteomics in keratoconus[J].Mol Vis,2010,16:1949-1957.
[7]MOHAN R R,MOHAN R RAHUL,KIM W J,et al.Modulation of TNF-α-induced apoptosis in corneal fibroblasts by transcription factor NF-κB[J].IOVS,2000,41(6):1327-1336.
[8]BAE S H,JUNG Y J,CHOI Y M,et al.Effects of Er-Miao-San extracts on TNF-α-induced MMP-1 expression in human dermal fibroblasts[J].Biological Research,2015,48:8.
[9]韦艺,郭新程,周嫣,等.环孢素A和肿瘤坏死因子仪对人牙龈成纤维细胞增殖的影响[J].中华口腔医学杂志,2012,47(1):39-42.
[10]KRACHMER J H,FEDER R S,BELIN M W.Keratoconus and related noninflammatory corneal thinning disorders[J].Surv Ophthalmol,1984,28(4):293-322.
[11]REFIK O,MERYEM D,GUNHAL S,et al.Effect of eye rubbing on corneal biomechanical properties and intraocular pressure[J].Turk J Ophthalmol,2014,44:268-271.
[12]BALASUBRAMANIAN S A,PYE D C,WILLCOX M D.Effects of eye rubbing on the levels of protease,protease activity and cytokines in tears:relevance in keratoconus[J].Clin Exp Optom,2013,96(2):214-228.
[13]LIU C X,FENG P F,LI X N,et al.Expression of MMP-2,MT1-MMP,and TIMP-2 by cultured rabbit corneal fibroblasts under mechanical stretch[J].Exp Biol Med (Maywood),2014,239(8):907-912.
[14]张歌,张建成,刘林襎,等.持续张力对人皮肤成纤维细胞增殖的影响[J].中国临床康复,2004,8(26):5532-5533.
[15]刘成星,李晓娜,冯鹏飞,等.机械拉伸对兔角膜成纤维细胞增殖和迁移的影响[J].太原理工大学学报,2014,45(1):138-142.
[16]JUAN S E,WANG Y L,LAWRENCE A C,et al.Cyclic mechanical stretch inhibits cell proliferation and induces apoptosis in fetal rat lung fibroblasts[J].Am J Physiol Lung Cell Mol Physiol,2002,282(3):448-456.
[17]刘达.二氢睾酮对肿瘤坏死因子-α抑制前列腺癌细胞增殖作用的影响[D].天津:天津医科大学临床医学院,2002.
[18]LIU J,SUDHA A.Mechanical signals activate vascular endothelial growth factor receptor-2 to upregulate endothelial cell proliferation during inflammation[J].J Immunol,2010,185(2):1215-1221.
[19]PEREAR P M,WYPASEK E,MADHAVAN S.Mechanical signals control SOX-9,VEGF,and c-Myc expression and cell proliferation during inflammation via integrin-linked kinase,B-Raf,and ERK1/2-dependent signaling in articular chondrocytes[J].Arthritis Research and Therapy,2010,12(3):R106.
[20]颜艳.力刺激对类风湿性关节炎滑膜细胞中COX-2/PGE2表达及细胞增殖调控研究[D].重庆:重庆大学生物医学工程学院,2012.
(编辑:张红霞)
Effects of Cyclic Stretch and TNF-α on Cell Proliferation of Corneal Fibroblasts
YAO Yan1a,FENG Pengfei1b,LI Xiaona1b,HE Rui2,CHEN Weiyi1b,WANG Xiaojun1a
(1.a.CollegeofMechanics,b.InstituteofAppliedMechanicsandBiomedicalEngineering,TaiyuanUniversityofTechnology,Taiyuan030024,China;2.ExcimerLaserDepartment,ShanxiEyeHospital,Taiyuan030002,China)
Abstract:Corneal fibroblasts isolated from normal corneas and keratoconus in vitro were subjected to cyclic stretch (0.1 Hz,5% or 15% strain) using Flexcell 4000 tension system,in the presence of 1 ng/mL or 10 ng/mL tumor necrosis factor-α (TNF-α). Cell cycle was detected by flow cytometry,to study the effect of cyclic stretch and TNF-α on proliferation of fibroblasts in keratoconus corneas. The experiment result shows that,5% strain orTNF-α had no significant effects on S phase proportion of keratoconus and normal corneal fibroblasts. All groups’ S phase proportions of keratoconus and normal corneal fibroblasts decreased under 15% stretch. Compared with normal corneal fibroblasts,keratoconus fibroblasts decreased in S phase proportion more significantly under the effect of 15% stretch and TNF-α,and there is no difference between keratoconus groups. By this study,we know that cyclic stretch and TNF-α may promote the development of keratoconus by inhibiting the proliferation of corneal stromal cells.
Key words:cyclic stretch;tumor necrosis factor-α;keratoconus;fibroblasts;cell proliferation
中图分类号:R318.01
文献标识码:A
DOI:10.16355/j.cnki.issn1007-9432tyut.2016.01.021
作者简介:姚艳(1990-),女,辽宁沈阳人,硕士生,主要从事生物力学研究,(E-mail)yaoyan199001@163.com通讯作者:王晓君(1974-),女,博士,副教授,硕士生导师,(E-mail) wangxiaojun@tyut.edu.cn
基金项目:国家自然科学基金资助项目:在体角膜材料生物力学特性研究及基于角膜微结构的建模分析(11402161), 非糖基化交联后基质刚度变化对角膜基质重塑的调控机理研究(11402162); 山西省高等学校教学改革资助项目(J2012014)
收稿日期:2015-03-18
文章编号:1007-9432(2016)01-0108-05
