瑞舒伐他汀联合厄贝沙坦对大鼠心肌肥厚性重构的影响
2016-04-15汤建民杨雁华
张 斌, 汤建民, 杨 蕾, 杨雁华
(郑州大学第二附属医院心内科,河南 郑州 4500H14)
瑞舒伐他汀联合厄贝沙坦对大鼠心肌肥厚性重构的影响
张斌,汤建民△,杨蕾,杨雁华
(郑州大学第二附属医院心内科,河南 郑州 4500H14)
[摘要]目的: 探讨瑞舒伐他汀联合厄贝沙坦对心肌肥厚大鼠心室重构的影响。方法: SPF级体重240~300 g雄性SD大鼠50只随机分为对照组、模型组、瑞舒伐他汀组、厄贝沙坦组和联合组。除对照组外,其余4组大鼠连续14 d给予皮下注射异丙肾上腺素(2.5 mg/kg)。自造模当天开始,对照组和模型组给予生理盐水灌胃,瑞舒伐他汀组、厄贝沙坦组和联合组分别给予瑞舒伐他汀(4 mg·kg-1·d-1)、厄贝沙坦(15 mg·kg-1·d-1)和瑞舒伐他汀(4 mg·kg-1·d-1)+厄贝沙坦(15 mg·kg-1·d-1)灌胃处理,连续干预4周。干预结束后,分别测定各组大鼠心脏质量指数、左室质量指数,HE染色观察心肌细胞肥大程度,RT-PCR测定肥大相关因子ANF、β-MHC和AT1受体(AT1R)的mRNA表达,Western blot法测定AT1R的蛋白表达。结果: 与对照组相比,模型组的心脏质量指数、左室质量指数、ANF和β-MHC的mRNA表达均增加(P<0.05);与模型组相比,瑞舒伐他汀组和厄贝沙坦组的心脏质量指数、左室质量指数、ANF和β-MHC 的mRNA表达均降低(P<0.05),联合组效果优于单药组(P<0.05)。瑞舒伐他汀组及厄贝沙坦组AT1R的mRNA及蛋白表达均低于模型组(P<0.05),而联合组AT1R的mRNA及蛋白表达水平低于各单独用药组(P<0.05)。结论: 瑞舒伐他汀及厄贝沙坦均能不同程度地改善心肌肥厚。它们的抗心肌肥厚作用可通过下调AT1R的mRNA和蛋白表达实现。联合用药的效果优于单一药物。
[关键词]心肌肥厚; 瑞舒伐他汀; 厄贝沙坦; AT1受体
心肌肥厚(cardiac hypertrophy)是形成心力衰竭的病理生理基础,是心力衰竭、冠心病、猝死等的独立危险因素[1-2]。研究心肌肥厚与心肌重构的病理发生、发展过程及机制,预防并及时治疗心肌肥厚,对于降低病人发病率、死亡率及提高生活质量具有重要意义。临床上常规选用血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)、血管紧张素受体阻断剂(angiotensin receptor blocker,ARB)、醛固酮拮抗剂等药物改善心室重构,近几年众多文献证实他汀可通过调控多条不同的信号转导途径发挥抗心肌肥厚作用。尽管他汀类及ARB类药物抗心肌肥厚的作用被众多实验及临床研究证实,但是在ARB类药物治疗的基础上加用他汀,药理机制完全不同的这两类药物同时服用是否产生协同或累积效应以及改善心室肥厚药理机制,目前相关文献报道较少。研究表明AT1受体在心肌肥厚及心肌重构中发挥着最为重要的作用[3]。血管紧张素II作用于AT1受体,通过PLC-IP3、DAG-PKC信号转导通路诱导原癌基因c-fos、c-myc转录表达,增加心肌细胞内DNA、RNA的含量,增加蛋白质的合成,诱发心肌细胞增殖及心室重构,其与心肌肥厚密切相关[4]。研究已表明ARB类药物可通过阻断Ang Ⅱ与AT1 受体结合及降低心肌Ang Ⅱ水平及AT1受体的亲和力, 从而逆转左室肥厚。Ichiki等[5]的文献报道西利伐他汀及氟伐他汀可使AT1受体mRNA的表达减少,进而拮抗AT1受体介导的心肌肥厚。故我们假设两者通过影响AT1受体表达及阻断血管紧张素II与AT1受体的结合发挥更强及有效的抗心肌肥厚作用。本实验通过皮下注射异丙肾上腺素造成大鼠心肌肥厚,并用瑞舒伐他汀及厄贝沙坦进行治疗,来探讨这2种药物抗心肌肥厚的作用及对AT1受体的影响,为临床抗心肌重构及治疗心力衰竭提供实验依据。
材料和方法
1材料
1.1实验动物及分组50只SD雄性大鼠,体质量240~300 g,购自河南省动物实验中心。于SPF级动物房内适应性喂养7 d 后分为5组: 空白组、模型组、瑞舒伐他汀组(4 mg·kg-1·d-1)、厄贝沙坦组(15 mg·kg-1·d-1)和联合组(瑞舒伐他汀4 mg·kg-1·d-1+厄贝沙坦15 mg·kg-1·d-1),每组10只。
1.2实验试剂瑞舒伐他汀(可定)由阿斯利康制药有限公司馈赠;厄贝沙坦(科苏)由北京海燕药业有限公司馈赠;异丙肾上腺素注射液购自上海禾丰制药有限公司;RNA提取试剂盒、PCR试剂盒均购自北京全式金生物技术有限公司;引物由上海生工生物工程公司合成。
1.3主要仪器设备PCR GeneAmp System 2700(Applied Biosystems)电泳仪DYY-6C(北京市六一仪器厂);显微摄影仪(Olympus)。
2方法
2.1实验动物造模及给药空白组皮下注射生理盐水1 mL,其它各组大鼠每天用异丙肾上腺素(2.5 mg/kg)经腹部皮下注射14 d得到心肌肥厚模型。造模第1天开始, 将瑞舒伐他汀和厄贝沙坦研磨成粉,溶于少量蒸馏水中制成悬液,采用灌胃法给药,空白组和模型组大鼠均用等量生理盐水灌胃。每日上午定时1次,共4周。造模期间模型组死亡3只,瑞舒伐他汀组死亡2只,厄贝沙坦死亡1只,联合组死亡2只。
2.2心脏重量参数测定4周后大鼠称体重(body weight,BW),麻醉,消毒,打开胸腔剪取心脏,冲洗干净,滤纸吸干后称心脏质量(heart mass,HM),分离出左心室,称左心室质量(left ventricular mass,LVM)。心脏质量指数(heart mass index,HMI)=HM/BW,左室质量指数(left ventricular mass index,LVMI)=LVM/BW。
2.3苏木紫-伊红染色常规进行HE染色,显微镜下观察各组大鼠心肌组织病理切片并拍照。
2.4RT-PCR 法测定心房钠尿肽(atrial natriuretic factor,ANF)、β-MHC及AT1受体的mRNA 表达剪去大鼠心肌,向组织中加入适量的RNAisoPlus,提取RNA,逆转录成cDNA,RT-PCR 法检测心肌肥厚相关因子ANF及β-MHC的mRNA表达,β-MHC的上游引物为5’TGCCAGCGAGTCGTCAGT-3’,下游引物为5’TCTCCACCGCATCCACAA-3’,扩增片段为338 bp;ANF 的上游引物为5’TGGAGCAAATCCCGTATA-3’,下游引物为5’GAGCAGAGCCCTCAGTTT-3’,扩增片段为289 bp;AT1受体的上游引物为5’TCTCCACCGCATCCACAA-3’,下游引物为5’AGACCCTCTGTCCAACCC-3’,扩增片段为145 bp;GAPDH的上游引物为5’TGGAGCAAATCCCGTATA-3’,下游引物为5’-GAGCAGAGCCCTCAGTTT-3’,扩增片段为588 bp。循环条件为:94 ℃ 2 min;94 ℃ 30 s,60 ℃ 30 s, 72 ℃ 45 s,35 个循环;72 ℃ 5 min。扩增产物行琼脂糖凝胶电泳,结果以目的条带和内参照吸光度比值表示,GAPDH 作为内参照。
2.5Western blot法检测AT1受体蛋白的表达向组织中加入适量蛋白裂解液,用组织细胞匀浆器匀浆至组织充分裂解,提取大鼠心肌总蛋白,BCA法测蛋白浓度,调整蛋白浓度至上样量一致。加等量蛋白于加样孔中,电泳,半干法转膜,5%脱脂奶粉封闭,I抗孵育过夜,洗膜,II抗孵育,洗膜,显色。显影之后分析所测电泳条带的性质。β-actin作为内参照。
3统计学处理
采用SPSS 20.0软件进行统计分析,实验数据用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,Bonferroni法行各组均数间两两比较。以P<0.05为差异有统计学意义。
结果
1大鼠HWI和LVWI的测定
与对照组相比,模型组及药物干预组的HMI和LVMI增加,差异有统计学显著性(P<0.05)。与模型组相比,药物干预组的HMI和LVMI下降(P<0.05),且联合组的HMI和LVMI下降程度优于单药组(P<0.05),见表1。
表1不同药物处理对大鼠HMI和LVMI的影响
Table 1.The effects of different treatments on HMI and LVMI of rats (Mean±SD)

GroupnHMILVMIControl102.47±0.071.78±0.07Model73.38±0.11*2.31±0.15*Rosuvastatin83.21±0.07#2.24±0.06#△Irbesartan93.07±0.08#2.11±0.09#△Combination82.87±0.14#1.98±0.12#
*P<0.05vscontrol group;#P<0.05vsmodel group;△P<0.05vscombination group.
2心肌细胞病理学改变
对照组大鼠心肌细胞排列整齐、规则;与对照组相比,模型组心肌细胞肥大、排列紊乱,而药物干预组较模型组心肌细胞偏小,联合组较单药组心肌细胞偏小,见图1。
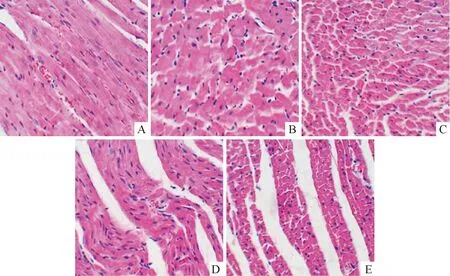
Figure 1.The pathological changes of rat myocardial tissues with HE staining (×400). A: control group; B: model group; C: rosuvastatin group; D: irbesartan group; E: combination group.
图1各组大鼠心肌HE染色
3大鼠心肌ANF 和β-MHC的mRNA 相对表达量的比较
模型组ANF和β-MHC 的mRNA 表达水平高于对照组(P<0.05),而瑞舒伐他汀组、厄贝沙坦组、联合组ANF及β-MHC的mRNA 表达水平较模型组均下降(P<0.05);联合组与单药组相比,ANF及β-MHC的mRNA 表达水平下降,差异具有统计学显著性(P<0.05),见图2。
4大鼠心肌组织AT1受体mRNA相对表达量的比较
模型组大鼠心肌组织中AT1受体的mRNA表达量升高,与对照组相比差异有统计学显著性(P<0.05)。各药物干预组大鼠心肌组织中AT1受体的mRNA表达与模型组相比差异有统计学显著性(P<0.05),其中与单药组相比,联合组AT1受体的mRNA表达量下降,差异具有统计学显著性(P<0.05),见图3。

Figure 2.The mRNA expression of ANF and β-MHC in rat myocardial tissues. 1: control group; 2: model group; 3: rosuvastatin group; 4: irbesartan group; 5: combination group. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group;△P<0.05vscombination group.
图2大鼠心肌组织 ANF及β-MHC的mRNA表达
5大鼠心肌组织AT1受体蛋白的相对表达
模型组大鼠心肌组织AT1受体蛋白表达明显增加,与对照组相比差异有统计学显著性(P<0.05);与模型组相比,瑞舒伐他汀组、厄贝沙坦组和联合组大鼠心肌组织的AT1受体蛋白表达明显下降,差异有统计学显著性(P<0.05),联合组AT1受体蛋白的表达量低于各单独用药组(P<0.05),见图4。

Figure 3.The mRNA expression of AT1R in rat myocardial tissues. 1: control group; 2: model group; 3: rosuvastatin group; 4: irbesartan group; 5: combination group. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group;△P<0.05vscombination group.
图3大鼠心肌组织 AT1R的mRNA表达

Figure 4.The protein expression of AT1R in rat myocardial tissues.1: control group; 2: model group; 3: rosuvastatin group; 4: irbesartan group; 5: combination group. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group;△P<0.05vscombination group.
图4大鼠心肌组织 AT1R蛋白的表达
讨论
心肌肥厚是心肌组织超负荷的一种代偿性反应,其发病机制、药物治疗机制经多年研究尚未完全阐明。异丙肾上腺素是一种儿茶酚胺类药物,通过结合及激动β肾上腺素受体,增强心肌收缩力,增快心率,心肌间质纤维增生,进而诱导心肌肥厚[6]。而心肌肥厚可通过动物心脏、左心室质量的变化情况、心脏超声测定心功能、HE染色观察细胞面积与排列的变化以及测定肥大相关因子如ANP、BNP 和β-MHC在mRNA或者蛋白水平的改变来评价心肌肥厚模型的建立效果[7-8]。本研究通过对大鼠皮下注射异丙肾上腺素构建心肌肥厚模型,结果表明与对照组相比,模型组的心脏质量指数、左室质量指数、肥大相关因子ANF和β-MHC的 mRNA表达均明显升高,提示心肌肥厚模型造模成功。
研究表明他汀类药物除降血脂作用,还具有抗炎、抗氧化、改善血管内皮功能、抗心肌重构、稳定动脉粥样硬化斑块、治疗心衰等其它心血管保护作用[9]。众多国内外文献均报道他汀可以通过对多条不同信号转导通路的调控,发挥改善心室重构及抗心肌肥厚的作用。而ARB类药物抑制心肌细胞增生, 延迟或逆转心肌肥厚的作用目前已经得到广泛认同。这2种不同药理作用机制的药物联合应用理论上应能产生累积或协同效应。Lee等[10]报道对心肌梗死后左室肥厚的大鼠,奥美沙坦与普伐他汀联用较各自单用更能有效降低心肌细胞面积及ANP 的mRNA表达。Sohma等[11]报道血管紧张素受体阻滞剂与他汀类药物联合应用对逆转左室肥厚有协同作用。李建新[12]报道阿托伐他汀与厄贝沙坦有协同增效的逆转左心室肥厚作用。本研究表明,瑞舒伐他汀组、厄贝沙坦组干预后心脏质量指数、左室质量指数、肥大相关因子ANF和β-MHC的mRNA表达均显著降低,说明瑞舒伐他汀及厄贝沙坦均能有效缓解异丙肾上腺素所致的心肌肥厚,而联合组较单用药物组更为明显,差异有统计学显著性。这与Sohma等[11]的研究结果相一致。
虽然联合应用他汀及血管紧张素受体阻断剂抗心肌肥厚的协同作用已逐步被认可[10-12],但联合这两类药物进一步改善心肌肥厚的药理作用机制仍不清楚。现研究证明,诱导心肌肥厚大鼠的心肌细胞AT1受体表达增强,AT1受体在心肌肥厚及心肌重构中发挥着最为重要的作用[13]。我们知道血管紧张素是促进心肌细胞和血管平滑肌细胞增殖肥厚的刺激因子,而AngII大部分生物效应就是通过AT1受体介导的。研究表明,他汀类药物可直接下调AT1受体的表达[14]。Nickenig等[15]研究表明在高胆固醇血症人群中应用他汀类药物可有使AT1受体的表达减少。崔晓琼等[16]报道阿托伐他汀可通过下调AT1受体的基因表达从而发挥抑制心肌细胞肥大的作用。而血管紧张素受体阻滞剂本身就可通过阻断Ang Ⅱ与AT1 受体结合及降低心肌Ang Ⅱ水平及AT1受体的亲和力, 从而逆转左室肥厚。本研究表明,异丙肾上腺素诱导的心肌肥厚模型较对照组AT1受体显著增加,而瑞舒伐他汀组、厄贝沙坦组干预后,AT1受体的mRNA及蛋白表达均显著低于模型组,提示两药具有下调AT1受体转录及翻译水平表达,而联合组AT1的mRNA及蛋白表达显著低于单独用药组,表明两药联用更有利于改善心肌肥厚,从而证实了我们关于瑞舒伐他汀及厄贝沙坦通过影响AT1受体表达及阻断血管紧张素II与AT1受体的结合发挥更强及有效抗心肌肥厚作用的假设。
综上所述,瑞舒伐他汀和厄贝沙坦均能通过下调AT1受体的表达而改善异丙肾上腺素所致的心肌肥厚,两者联用较各自单独应用更有利于改善心肌肥厚,为二者在临床上联合用药治疗心肌肥厚、心衰提供新的思路及理论依据。但两者通过何种机制下调AT1受体的表达,需要进一步更深的研究。
[参考文献]
[1]Dahlöf B. Regression of left ventricular hypertrophy: are there differences between antihypertensive agents?[J]. Cardiology,1992, 81(4-5):307-315.
[2]Chowdhury D, Tangutur AD, Khatua TN, et al. A proteomic view of isoproterenol induced cardiac hypertrophy: prohibitin identified as a potential biomarker in rats[J].J Transl Med, 2013, 11:130.
[3]Barauna VG, Magalhaes FC, Krieger JE, et al. AT1 receptor participates in the cardiac hypertrophy induced by resistance training in rats[J]. Am J Physiol Regul Integr Comp Physiol, 2008, 295(2):R381-R387.
[4]张萍,何国祥,王国超,等. 血管紧张素II受体在压力超负荷致左室肥大中的作用[J]. 中国病理生理杂志, 2001, 17(1):50-53.
[5]Ichiki T,Takeda K,Tokunou T,et al. Down regulation of angiotensin II type I receptor by hydrophobic 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors in vascular smooth muscle cells[J]. Arterioscler Thromb Vasc Biol,2001,21(12):1896-1901.
[6]Ocaranza M, Díaz-Araya G, Chiong M, et al. Isoproterenol and angiotensin I-converting enzyme in lung, left ventricle, and plasma during myocardial hypertrophy and fibrosis[J]. Cardiovasc Pharmacol, 2002, 40(2):246-254.
[7]Di Domenico M, Casadonte R, Ricci P, et al. Cardiac and skeletal muscle expression of mutant β-myosin heavy chains, degree of functional impairment and phenotypic heterogeneity in hypertrophic cardiomyopathy[J]. J Cell Physiol,2012, 227(10):34-71.
[8]Backs J, Olson EN. Control of cardiac growth by histone acetylation deacetylation[J]. Circ Res, 2006, 98(1):15-24.
[9]赵丹,侯玉辉. 他汀类药物的临床多效性研究进展[J]. 世界最新医学信息文摘, 2014,14(33):234-235.
[10]Lee T, Lin M, Chou T, et al. Additive effects of combined blockade of AT1 receptor and HMG-CoA reductase on left ventricular remodeling in infarcted rats[J]. Am J Physiol Heart Circ Physiol, 2006, 291(3):H1281-H1289.
[11]Sohma R, Inoue T, Abe S, et al. Cardioprotective effects of low-dose combination therapy with a statin and an angiotensin receptor blocker in a rat myocardial infarction model[J]. J Cardiol, 2012, 59(1):91-96.
[12]李建新. 阿托伐他汀联合厄贝沙坦治疗高血压左心室肥厚的临床疗效分析[J]. 亚太传统医药, 2012, 8(8):164-165.
[13]Maejima Y, Nobori K, Ono Y, et al. Synergistic effect of combined HMG-CoA reductase inhibitor and angiotensin-II receptor blocker therapy in patients with chronic heart failure: the HF-COSTAR trial[J]. Circ J, 2011, 75(3):589-595.
[14]Wassmann S, Laufs U, Bäumer AT, et al. HMG-CoA reductase inhibitors improve endothelial dysfunction in normocholesterolemic hypertension via reduced production of reactive oxygen species[J]. Hypertension, 2001, 37(6):1450-1457.
[15]Nickenig G, Bäumer AT, Temur Y, et al. Statin-sensitive dysregulated AT1 receptor function and density in hypercholesterolemic men[J]. Circulation,1999, 100(21):2131-2134.
[16]崔晓琼,曲鹏,姜华,等. 阿托伐他汀对Ang II诱导大鼠心肌肥大的抑制作用及对TLR4基因表达的影响[J].中国病理生理杂志, 2007, 23(12):2357-2360.
(责任编辑: 陈妙玲, 罗森)
Effect of rosuvastatin combined with irbesartan on remodeling of myocardial hypertrophy in rats
ZHANG Bin, TANG Jian-min, YANG Lei, YANG Yan-hua
(DepartmentofCardiology,TheSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014,China.E-mail:tjmgrx@163.com)
[ABSTRACT]AIM: To evaluate the effect of rosuvastatin combined with irbesartan on the remodeling of myocardial hypertrophy in the rats. METHODS: Male SD rats (n=50) were randomly divided into control group, model group, rosuvastatin group, irbesartan group and combination group. The model of myocardial hypertrophy was established by subcutaneous injection of isoproterenol at dose of 2.5 mg/kg for 14 d. From the first day of modeling, the rats in control group and model group received intragastrical saline, and the rats in rosuvastatin group, irbesartan group and combination group were treated with rosuvastatin (4 mg·kg-1·d-1), irbesartan (15 mg·kg-1·d-1) and rosuvastatin (4 mg·kg-1·d-1)+ irbesartan (15 mg·kg-1·d-1), respectively. The interventions continued for 4 weeks. After the interventions, the cardiac mass index and left ventricular mass index of the SD rats were measured. Besides, the degree of myocardial hypertrophy was observed with HE staining. The mRNA expression of hypertrophy-related factors, such as ANF, β-MHC and AT1R was determined by RT-PCR, and the protein expression of AT1R was determined by Western blot. RESULTS: Compared with control group, the cardiac mass index, left ventricular mass index, as well as the mRNA expression of ANF and β-MHC in model group were significantly increased (P<0.05). Compared with model group, the above factors in rosuvastatin group and irbesartan group were decreased (P<0.05), and the factors in combination group were lower than those in rosuvastatin group and irbesartan group (P<0.05). In addition, the expression of AT1R at mRNA and protein levels in rosuvastatin group and irbesartan group was lower than that in model group (P<0.05), while the expression AT1R at mRNA and protein levels in combination group was lower than that in rosuvastatin group and irbesartan group (P<0.05). CONCLUSION: Rosuvastatin and irbesartan are equally effective drugs to resist the formation of myocardial hypertrophy by decreasing the expression of AT1R. Moreover, combination of the 2 drugs is more effective to improve the degree of myocardial hypertrophy than the 2 drugs alone.
[KEY WORDS]Cardiac hypertrophy; Rosuvastatin; Irbesartan; AT1 receptor
doi:10.3969/j.issn.1000- 4718.2016.03.024
[中图分类号]R363.2
[文献标志码]A
通讯作者△Tel: 0371-63974108; E-mail: tjmgrx@163.com
[收稿日期]2015- 10- 13[修回日期] 2016- 01- 12
[文章编号]1000- 4718(2016)03- 0534- 06
杂志网址: http://www.cjpp.net
