二十二碳六烯酸抑制氧化应激状态下人视网膜色素上皮细胞凋亡*
2016-04-15刘越峰罗卫民钟晓东
刘越峰, 罗卫民, 张 勇, 钟晓东
(湖北医药学院附属十堰市太和医院 1眼科中心, 2心胸外科,湖北 十堰 442000)
二十二碳六烯酸抑制氧化应激状态下人视网膜色素上皮细胞凋亡*
刘越峰1,罗卫民2△,张勇1,钟晓东1
(湖北医药学院附属十堰市太和医院1眼科中心,2心胸外科,湖北 十堰 442000)
[摘要]目的: 观察二十二碳六烯酸(docosahexaenoic acid,DHA)对外源性H2O2诱导人视网膜色素上皮细胞凋亡的影响及分子机制。方法: 体外培养人视网膜色素上皮细胞系ARPE-19,加入终浓度为12.5 mol/L的H2O2诱导氧化应激,随后用30~100 μmol/L DHA作用细胞4~24 h;real-time PCR和Western blot分别检测血红素氧合酶-1(heme oxygenase-1,HO-1) mRNA和蛋白的表达;比色法分析HO-1酶活性;荧光探针检测活性氧簇(reactive oxygen species,ROS)的产生;免疫荧光检测转录因子NF-E2相关因子2(NF-E2-related factor 2,Nrf2)的核转位。最后通过HO-1 siRNA干扰后,流式细胞术观察其对ARPE-19细胞凋亡的影响。结果: DHA能以浓度依赖性方式诱导ARPE-19细胞表达HO-1 mRNA和蛋白,同时,HO-1的酶活性也随着DHA浓度的递增而增强;DHA处理也能诱导Nrf2核转位。此外,H2O2处理可促进ARPE-19细胞凋亡,并诱导其产生ROS。同时给予100 μmol/L DHA处理后,细胞凋亡率和ROS生成显著降低。转染HO-1 siRNA或用HO-1抑制剂ZnPP处理后,可明显降低DHA对细胞凋亡率和ROS的抑制作用。结论: DHA可能通过Nrf2途径诱导视网膜色素上皮细胞表达HO-1,从而发挥对细胞的保护作用。
[关键词]二十二碳六烯酸; 视网膜色素上皮细胞; 血红素氧合酶-1
年龄相关性黄斑变性(age-related macular dege-neration,AMD)是一种黄斑神经疾病,好发于50岁以上人群,其病理生理特征是患者出现双侧进行性视网膜黄斑部退行性病变,是老年人群常见的致盲性眼病之一[1-2]。目前AMD的病因和发病机制尚不完全明了。流行病学研究表明它是一种与环境以及遗传有关的多因素疾病[3],其中氧化应激机制在本病的发生发展过程中发挥核心作用。由于黄斑部解剖学与组织学的特殊性,视网膜色素上皮细胞是AMD发生的中心环节。目前临床上针对AMD尚无有效的治疗方法,主要通过针对晚期脉络膜新生血管病干预为主的综合治疗,但治疗效果欠佳,仅有20%~40%患者的视力得到一定改善[4]。有研究发现,二十二碳六烯酸(docosahexaenoic acid,DHA)在中枢神经系统的发育及其功能功能方面发挥重要作用。如DHA可以通过影响凋亡相关基因的表达而降低大鼠脑部的缺血再灌注损伤,减少神经细胞的凋亡[5]。此外,DHA不但具有抗氧化应激、抗神经炎性反应[6],另外对黄斑变性以及阿尔茨海默病等神经变性性疾病具有一定的预防和保护作用[7]。本研究旨在探讨DHA对氧化应激状态下人视网膜色素上皮细胞凋亡的影响,从而进一步明确其在AMD保护作用中的分子机制。
材料和方法
1主要实验试剂
ARPE-19细胞购自ATCC;DMEM培养基、无内毒素胎牛血清购自Gibco;DHA、β-actin多克隆抗体、荧光探针H2DCFDA、HO-1抑制剂ZnPP、激动剂CoPP为Sigma产品;抗HO-1多克隆抗体、抗Nrf2多克隆抗体以及C3标记羊抗鼠多克隆抗体购自Santa Cruz;细胞蛋白提取试剂盒和Bradford蛋白浓度测定试剂为Pierce产品;Nrf2和HO-1 siRNA由广州锐博公司合成;siRNA转染试剂盒购自Qiagen;Annexin V-FITC/PI凋亡检测试剂盒购自Roche;HO-1活性检测试剂盒购自GENMED。
2主要实验方法
2.1细胞培养与处理ARPE-19细胞用DMEM培养基(含10%胎牛血清、L-谷氨酰胺和抗生素),置于37 ℃、5% CO2的恒温培养箱中培养。待细胞生长至密度为80%后接种至6孔板中,并改用含1%血清的DMEM培养基培养24 h。随后细胞加入不同浓度的DHA作用4~24 h。
2.2细胞总蛋白提取与Western blot实验ARPE-19细胞经DHA处理结束后,用PBS漂洗1次,加入含蛋白酶抑制剂的Cocktails裂解细胞。采用Pierce公司试剂盒提取胞浆蛋白,并用Bradford法测定蛋白浓度。获取20 μL蛋白用于SDS-聚丙烯酰胺凝胶电泳,经转膜、封闭后,加入相应的 I 抗和 II 抗孵育,ECL显影、拍照。
2.3HO-1酶活性分析收集处理后细胞,1 000 r/min离心8 min。根据试剂盒操作步骤裂解细胞,并设置好背景管和样品管,分别加入340 μL缓冲液、20 μL反应液和20 μL底物混匀,37 ℃温育60 min后加入400 μL终止液。经1 000 r/min离心 5 min后,获取绿色相,酶标仪上设置波长为464 nm和530 nm,根据取其吸光度计算出HO-1的活性,结果以每毫克蛋白中每小时生成的胆绿素含量表示。
2.4免疫荧光观察Nrf2核转位ARPE-19细胞处理完毕后,用3.5%多聚甲醛重悬浮细胞,室温固定15 min。经甲醇通透10 min,洗涤后用1%羊血清封闭30 min。随后加入抗Nrf2抗体,室温孵育2 h。洗涤后继续加入C3标记羊抗鼠II 抗孵育1 h,激光共聚焦显微镜(Nikon C2 Plus)拍照。
2.5活性氧簇(reactive oxygen species,ROS)的测定ARPE-19细胞处理完毕后加入终浓度5 μmol/L的H2DCFDA染液,37 ℃避光孵育30 min。PBS洗细胞并重悬细胞,荧光分光光度计(SynergyHT,Bio-Tec)测量荧光强度(激发波长485 nm,发射波长530 nm),计算相对荧光值(relative fluorescence intensity,RFI)。
2.6细胞转染生长于培养皿中的ARPE-19细胞(约5×105个)在转染前更换为无血清培养基培养18~24 h。将100 nmol/L HO-1 siRNA或对照siRNA与转染试剂混合后,加至细胞培养液中。4 h后用无菌PBS漂洗细胞,并更换为完全培养基,随后加入DHA用于下一步研究。
2.7凋亡检测取1 mL细胞(约5×105个),加入195 μL结合液重悬细胞后,继续加入5 μL Annexin V-FITC使总体积为200 μL,并混匀,室温避光10 min;离心弃上清,再次用190 μL结合液重悬细胞,继续加入10 μL PI染液,4 ℃避光10 min后用于流式细胞术分析。
3统计学处理
所有实验数据均为3组实验结果的平均值,并重复3次,应用SPSS 17.0软件进行统计学分析,计量资料用均数±标准差(mean±SD)表示,并采用单因素方差分析数据后行SNK-q检验,以P<0.05为差异有统计学意义。
结果
1DHA诱导ARPE-19细胞表达HO-1 mRNA
Real-time PCR结果显示,DHA作用ARPE-19细胞8 h后,HO-1的mRNA表达随着DHA浓度增加而增加。此外,100 μmol/L DHA在不同的时点诱导HO-1的mRNA表达量也有所不同。其中DHA作用4 h后,HO-1的mRNA开始升高,8~12 h达到峰值,24 h时接近对照组水平,见图1。

Figure 1.DHA induced the mRNA expression of HO-1 in the ARPE-19 cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L;#P<0.05,##P<0.01vs0 h.
图1DHA诱导ARPE-19细胞表达HO-1 mRNA
2DHA上调HO-1蛋白表达并增强其酶活性
Western blot结果显示,0、30、50和100 μmol/L DHA与ARPE-19细胞孵育8 h后,HO-1蛋白的表达水平随之增多,呈一定的剂量依赖性。此外,100 μmol/L DHA作用ARPE-19细胞4 h后,HO-1酶活性逐渐增高,16 h后开始下降,见图2。

Figure 2.DHA induced ARPE-19 cells to express HO-1 protein and upregulated its enzymic activity. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图2DHA诱导HO-1蛋白表达并增高其酶活性
3DHA经Nrf2诱导HO-1表达
ARPE-19细胞在DHA处理前,Nrf2位于细胞浆中。经20~100 μmol/L DHA处理4 h后,细胞核中Nrf2显著增多,采用siRNA干扰Nrf2表达后,HO-1表达显著降低,见图3。
4抑制HO-1表达减弱DHA对ARPE-19细胞凋亡的抑制作用
流式细胞术结果显示,H2O2处理可诱导ARPE-19细胞凋亡。而同时给予100 μmol/L DHA处理8 h后,与H2O2处理组相比,细胞凋亡率明显降低。而在DHA干预的同时给予5 μmol/L HO-1抑制剂ZnPP处理,或采用siRNA干扰HO-1表达后,可明显逆转DHA对细胞凋亡的抑制效应,而给予10 μmol/L HO-1激动剂CoPP处理后,得到了与DHA类似的效果,见图4。
5抑制HO-1表达减弱DHA对ROS产生的抑制作用
H2O2处理可明显诱导ARPE-19细胞产生ROS。DHA可有效降低H2O2对细胞ROS的诱生作用。HO-1抑制剂ZnPP和siRNA处理后,ROS含量恢复至H2O2组水平;而DHA联合HO-1激动剂CoPP能进一步降低ROS的含量,见图5。

Figure 3.DHA induced HO-1 expression via Nrf2. A: DHA induced Nrf2 nuclear translocation; B: silencing ofNrf2 down-regulated HO-1 expression. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L;#P<0.05vs100 μmol/L DHA.
图3DHA经Nrf2诱导HO-1表达
讨论
HO-1是降解血红素代谢为CO、Fe2+和胆绿素的限速酶。多种病理生理状态,如氧化应激、感染、糖尿病和视网膜病变等因素均可上调其表达[8]。研究发现,多种对AMD具有保护作用的抗氧化治疗药物是通过上调HO-1的表达而实现的[9-11]。HO-1可通过其产物CO、胆红素和Fe2+而发挥细胞保护作用,包括降低TNF-α的促凋亡毒性[12],维持血管内皮细胞的生理功能,减轻炎症和氧化应激损伤[13]。DHA是含有22个碳原子的长链不饱和脂肪酸,是人体内不饱和程度最高的脂肪酸之一,其高度不饱和性可影响膜蛋白活性、信号转导及受体功能。研究表明,DHA可有效改善光损伤所致的视网膜氧化应激反应,并能上调内源性抗氧化蛋白的表达[14-15]。本研究通过体外培养视网膜色素上皮细胞ARPE-19,通过DHA干预后,结果发现,30 μmol/L的DHA即可能诱导HO-1 mRNA和蛋白表达,同时能上调其酶活性。基于HO-1多方面的细胞保护效应,以上结果表明DHA可能通过上调HO-1的表达从而减轻视网膜色素上皮细胞的氧化应激水平。
Nrf2是一种重要的氧化应激转录保护因子。生理条件下Nrf2存在于胞浆中,并与胞浆中抑制蛋白Keap1相结合。当细胞受到各种外源性刺激时,Keap1经泛素化降解而促使其与Nrf2分离。Nrf2随后转移至细胞核内与基因 5’非编码区的抗氧化反应元件(antioxidant response element,ARE)相结合而启动相关基因的转录[16]。本研究也发现DHA处理后,Nrf2转移至细胞核内而调控HO-1的表达。同时,采用Nrf2 siRNA沉默后发现,HO-1的表达显著减少,这表明Nrf2参与了HO-1的表达。
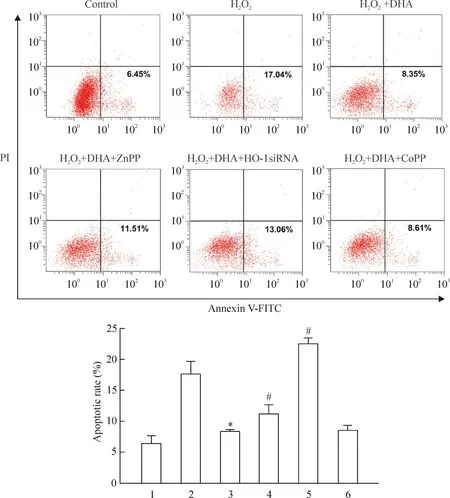
Figure 4.The effect of inhibition of HO-1 expression on ARPE-19 cells apoptosis. 1: control; 2: H2O2; 3: H2O2+DHA; 4: H2O2+DHA+ZnPP; 5: H2O2+DHA+HO-1 siRNA; 6: H2O2+DHA+CoPP. Mean±SD.n=3.*P<0.05vsH2O2;#P<0.05vsH2O2+DHA.
图4抑制HO-1表达对ARPE-19细胞凋亡的影响

Figure 5.The effect of inhibition of HO-1 expression on ROS production in the ARPE-19 cells. 1: control; 2: H2O2; 3: H2O2+DHA; 4: H2O2+DHA+ZnPP; 5: H2O2+DHA+HO-1 siRNA; 6: H2O2+DHA+CoPP. Mean±SD.n=3.*P<0.05vsH2O2;#P<0.05vsH2O2+DHA.
图5抑制HO-1表达对ARPE-19细胞ROS产生的影响
由于细胞凋亡是AMD发生的根本原因,因此本研究随后对HO-1在氧化应激条件下的细胞护作用进行了观察,首先采用HO-1抑制剂ZnPP和DHA共同与ARPE-19细胞孵育,结果发现ZnPP可显著降低DHA对细胞凋亡和ROS产生的抑制作用。此外,通过siRNA干扰HO-1表达后也得到了类似结果。另外本研究也从正向方面得到了验证,即,DHA处理的同时加入HO-1激动剂CoPP共同孵育,与单纯DHA处理相比,凋亡率和ROS的产生进一步降低。以上结果证明DHA可能通过上调HO-1表达,从而改善ARPE-19细胞的氧化应激状态及凋亡。
总之,本课题研究结果说明,DHA可激活视网膜色素上皮细胞Nrf2并诱导HO-1的表达。HO-1的上调可减少氧化应激损伤后视网膜色素上皮细胞凋亡以及ROS的产生,最终发挥对其保护作用,在随后的研究中,我们将对HO-1抗凋亡机制开展进一步研究。
[参考文献]
[1]French DD, Margo CE. Age-related macular degeneration, anti-vascular endothelial growth factor agents, and short-term mortality: a postmarketing medication safety and surveillance study[J]. Retina, 2011, 31(6):1036-1042.
[2]Seddon JM, Reynolds R, Maller J, et al. Prediction mo-del for prevalence and incidence of advanced age-related macular degeneration based on genetic, demographic, and environmental variables[J]. Invest Ophthalmol Vis Sci, 2009, 50(5):2044-2053.
[3]Hemminki K, Forsti A, Li X, et al. Familial risks of age-related macular degeneration[J]. Am J Ophthalmol, 2011, 151(3):561-562.
[4]Aleman TS, Garrity ST, Brucker AJ. Retinal structure in vitamin A deficiency as explored with multimodal imaging[J]. Doc Ophthalmol, 2013, 127(3):239-243.
[5]Paterniti I, Impellizzeri D, Di PR, et al. Docosahexaenoic acid attenuates the early inflammatory response following spinal cord injury in mice:in-vivoandin-vitrostudies[J]. J Neuroinflammation, 2014, 11:6.
[6]胡晓晶,耿文静,焦波,等. EPA、DHA对脂多糖刺激大鼠系膜细胞的保护作用[J]. 中国病理生理杂志, 2010, 26(3):513-517.
[7]Joffre C, Nadjar A, Lebbadi M, et al. n-3 LCPUFA improves cognition: the young, the old and the sick[J]. Prostaglandins Leukot Essent Fatty Acids, 2014, 91(1-2):1-20.
[8]Paine A, Eiz-Vesper B, Blasczyk R, et al. Signaling to heme oxygenase-1 and its anti-inflammatory therapeutic potential[J]. Biochem Pharmacol, 2010, 80(12):1895-1903.
[9]Koskela A, Reinisalo M, Hyttinen JM, et al. Pinosylvin-mediated protection against oxidative stress in human retinal pigment epithelial cells[J]. Mol Vis, 2014, 20:760-769.
[10]Li Z, Dong X, Liu H, et al. Astaxanthin protects ARPE-19 cells from oxidative stress via upregulation of Nrf2-regulated phase II enzymes through activation of PI3K/Akt[J]. Mol Vis, 2013, 19:1656-1666.
[11]Dasari B, Prasanthi JR, Marwarha G, et al. The oxysterol 27-hydroxycholesterol increases beta-amyloid and oxidative stress in retinal pigment epithelial cells[J]. BMC Ophthalmol, 2010, 10:22.
[12]Morse D, Pischke SE, Zhou Z, et al. Suppression of inflammatory cytokine production by carbon monoxide involves the JNK pathway and AP-1[J]. J Biol Chem, 2003, 278(39):36993-36998.
[13]Florczyk U, Jazwa A, Maleszewska M, et al. Nrf2 regulates angiogenesis: effect on endothelial cells, bone marrow-derived proangiogenic cells and hind limb ischemia[J]. Antioxid Redox Signal, 2014, 20(11):1693-1708.
[14]Ramchani-Ben OK, Cercy C, Amri M, et al. Dietary supplement enriched in antioxidants and omega-3 protects from progressive light-induced retinal degeneration[J]. PLoS One, 2015, 10(6):e0128395.
[15]Johansson I, Monsen VT, Pettersen K, et al. The marine n-3 PUFA DHA evokes cytoprotection against oxidative stress and protein misfolding by inducing autophagy and NFE2L2 in human retinal pigment epithelial cells[J]. Autophagy, 2015, 11(9):1636-1651.
[16]林晓萍,李雯,沈华浩. 抗氧化应激转录因子-Nrf2的研究进展[J]. 中国病理生理杂志, 2011, 27(6):1234-1239.
(责任编辑: 林白霜, 罗森)
Docosahexaenoic acid protects human retinal pigment epithelial cells against oxidative stress-induced apoptosis
LIU Yue-feng1, LUO Wei-min2, ZHANG Yong1, ZHONG Xiao-dong1
(1DepartmentofOphthalmology,2DepartmentofCardiothoracicSurgery,TaiheHospitalofShiyanAffiliatedtoHubeiUniversityofMedicine,Shiyan442000,China.E-mail:weiminluo120@163.com)
[ABSTRACT]AIM: To observe the effect of docosahexaenoic acid (DHA) on H2O2-induced apoptosis in human retinal pigment epithelium cells and its molecular mechanism. METHODS: Human retinal pigment epithelium cell line ARPE-19 was cultured in vitro, and 12.5 mmol/L H2O2 was used to mimic the oxidative stress condition. The cells were treated with 30~100 μmol/L DHA for 4~24 h. The expression of heme oxygenase-1 (HO-1) at mRNA and protein levels was detected by real-time PCR and Western blot, respectively. The enzymic activity of HO-1 was measured by colorimetry. Production of reactive oxygen species (ROS) was determined by fluorescent probe. Activation of NF-E2-related factor 2 (Nrf2) was examined by immunofluorescence method. Apoptosis of ARPE-19 cells was analyzed by flow cytometry. RESULTS: The mRNA and protein expression and the enzymic activity of HO-1 were significantly increased in the ARPE-19 cells after DHA treatment. Meanwhile, nuclear translocation of Nrf2 was also observed. Apoptosis appeared and ROS was produced upon H2O2 incubation. In contrast, DHA at 100 μmol/L significantly abrogated H2O2-induced apoptosis and ROS production. Furthermore, silencing of HO-1 by specific siRNA, or treatment with ZnPP, an inhibitor of HO-1, partly counteracted the protective effect against H2O2-induced apoptosis and ROS production. CONCLUSION: DHA protects retinal pigment epithelial cells against oxidative stress via induction of heme oxygenase-1 expression after Nrf2 activation.
[KEY WORDS]Docosahexaenoic acid; Retinal pigment epithelial cells; Heme oxygenase-1
doi:10.3969/j.issn.1000- 4718.2016.03.019
[中图分类号]R363
[文献标志码]A
通讯作者△Tel: 0719-8801710; E-mail: weiminluo120@163.com
*[基金项目]十堰市科学技术研究与开发项目(No. 14Y40)
[收稿日期]2015- 09- 15[修回日期] 2016- 02- 04
[文章编号]1000- 4718(2016)03- 0504- 06
杂志网址: http://www.cjpp.net
