甜樱桃试管苗移栽过程中根系活力、叶片光合特性及超微结构的变化
2016-04-14李福慧毛娟陈佰鸿米宝琴谢永东
李福慧,毛娟,陈佰鸿,米宝琴,谢永东
(1.甘肃农业大学园艺学院,甘肃 兰州 730070; 2.四川农业大学园艺学院,四川 雅安 625014)
甜樱桃试管苗移栽过程中根系活力、叶片光合特性及超微结构的变化
李福慧1,毛娟1,陈佰鸿1,米宝琴1,谢永东2
(1.甘肃农业大学园艺学院,甘肃 兰州730070; 2.四川农业大学园艺学院,四川 雅安625014)
摘要:【目的】 阐明甜樱桃试管苗在炼苗移栽过程中发生的适应性变化.【方法】 研究了甜樱桃试管苗闭瓶炼苗5 d、开瓶炼苗10 d、移栽10 d、移栽25 d、移栽80 d时的叶片光合特征参数、叶绿素荧光特性及叶绿体超微结构,叶绿素含量、根系活力等生理特征的变化.【结果】 甜樱桃幼苗在炼苗过程中叶片叶绿素含量、根系活力、最大净光合速率、以及PSⅡ的最大光化学效率不断升高,而在移栽后10 d均出现了显著的下降;移栽过程中,初期由于对外界环境的不适应,出现缓苗等情况,使得根系活力下降,叶片光合能力降低,但移栽80 d时叶绿体内淀粉粒和嗜饿小体体积变大,片层结构清晰、完整且有序,根系活力和叶绿素含量均在移栽80 d时显著增大.【结论】甜樱桃试管苗在炼苗移栽过程中叶片光合特性、超微结构及根系活力随着移栽时间的延长,其叶片的光合效率明显提高,并有大量的光合产物积累;同时根系吸收水分、养分的能力及抗逆能力都明显增强,到移栽80 d时试管苗已完全适应大田环境.
关键词:甜樱桃;试管苗;移栽;叶绿素荧光;光合特性
甜樱桃(PrunusaviumL)属于蔷薇科樱桃属典型樱桃亚属植物,原产亚洲西南部和欧洲南部的古老落叶果树种,果实成熟最早,为“百果之先”,具有极高的经济价值[1-2].甜樱桃是欧洲甜樱桃和欧洲酸樱桃及其杂交种的总称,成熟时颜色鲜红,玲珑剔透,味美形娇,营养丰富,医疗保健价值颇高,又有“含桃”的.樱桃的种子萌发率低,实生苗易感染病毒,扦插繁殖系数低,因而在生产实践的应用中受到很大的限制,采用茎尖、茎段外植体进行樱桃快速繁殖,可以提高优良品种的繁殖系数和抗病能力,培育优良砧木,而组织培养进行果树无性系快速繁殖其关键取决于试管苗的移栽成活率[3].
试管苗的驯化移植是组培快繁工作的重要技术环节之一,移栽成活率的高低直接影响经济效益.若稍有疏忽,则会造成大批幼苗死亡,使整个组培操作前功尽弃,造成巨大的损失.试管苗的驯化过程是试管苗由弱光、恒温、近饱和湿度、无菌环境逐渐向自然环境条件转化的过程,驯化过程较为复杂,技术难度较大[4].甜樱桃脱毒试管苗的驯化移栽就是其中之一,具有较高的试管苗移栽成活率才能使甜樱桃脱毒苗组培快速繁育技术实用化.由于光合作用是植物进行生命活动的关键[5-7],所以近些年,对不同植物受到生物胁迫或非生物胁迫时MDA[8]、叶绿素、光合速率、根系活力[9]、荧光系数[10]等的研究受到越来越多的重视,而叶绿体又是其进行的主要场所,所以随着超微电镜技术[11-13]的发展,研究其内部结构的变化与叶片光合功能改变之间的联系,从而有效提高光合效率变的尤为重要.本试验拟通过对甜樱桃试管苗移栽过程中的生理指标、叶片超微结构变化的探究,以期为甜樱桃无性繁殖及移栽提供一定的理论依据.
1材料与方法
1.1植物材料
甜樱桃试管苗(早大果)由天水市果树研究所提供.
1.2甜樱桃试管苗的接种、炼苗驯化及移栽
1.2.1试管苗闭瓶炼苗在MS+0.02 mg/L IAA大樱桃试管苗继代培养60 d后的试管苗在培养架上长好后,迅速转移到日光温室中,将温度控制在15~25 ℃,光照强度为90~100 μmol/ m2/ s,每天中午在瓶苗周围喷洒多次雾水,闭瓶炼苗5 d,让试管苗逐渐接受强光照射.
1.2.2试管苗开瓶锻炼试管苗经过5 d的生长,将瓶口的绳子除去,将覆盖在瓶口的塑料薄膜轻轻松动,不可一次性揭除,应慢慢透气,逐步除去,待2~3 d后全部揭除,经过10 d的生长,部分幼苗长出瓶口,适时移栽.
1.2.3试管苗的处理、移栽及管理移栽至花盆前,轻取苗子,清洗根部的培养基并用多菌灵800倍液进行漂洗.移栽时花盆应浇透水,然后将小拱棚用塑料薄膜盖紧,保证湿度控制在95%以上,次日早晨将拱棚揭开小口通风5~10 min;中午若光照过强,应在大棚上加盖遮阳网,若温度过高,可用喷雾方法在小拱棚上洒水降温;晚上继续通风5~10 min.移栽后前3 d必须控制温度在20~25 ℃,湿度在90%以上,以后逐渐延长通风时间,1周后每隔2 d喷洒1次稀薄营养液,1个多月后就可揭去小拱棚上的薄膜.
1.3甜樱桃试管苗移栽前后生理指标及超微结构的测定
1.3.1根系活力的测定根系活力采用氯化三苯基四氮唑(TTC)法测定[14].
1.3.2叶绿素含量的测定采用日本柯尼美能达公司生产的SPAD-502 Plus叶绿素仪进行叶绿素含量的测定.由于其含量与SPAD值之间极显著的正相关性,可直接采用SPAD值来估计叶片中暗绿素浓度.
1.3.3叶绿素荧光参数的测定采用LI-6400系列便携式光合仪分别测定继代培养60 d、闭瓶炼苗5 d、开瓶炼苗10、移栽后10、25、80 d植株中间偏上位置健康叶片的叶绿素荧光参数,测定前叶片在LI-6400系列便携式光合仪匹配的暗适应夹中适应 25~30 min,测得其稳定光下荧光产量(Fs)、光下最大荧光产量(Fm')、光下最小荧光产量(Fo’)、初始荧光(F0)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm).
1.3.4叶片光合速率的测定采用LI-6400系列便携式光合仪测定叶片光合速率.
1.3.5叶片超微结构的测定用不锈钢刀片将甜樱桃叶片切为大小约1 mm×2 mm小块,放入盛有2.5%戊二醛的清洁小瓶中进行前固定;3 h后用pH值为7.2的缓冲液清洗3次,每次10 min,再用1.0%四氧化锇后固定;样品变黑后1.5 h,再用缓冲液清洗3次,每次15 min;用丙酮进行系列脱水,每次45 min;在装有样品的玻璃瓶里先倒入1/5的丙酮,再倒入1/5的环氧树脂,浸透2 h;Epon812包埋72 h;对包埋好的样品进行修块,使组织暴露出来;在德国Leica EMUC 7超薄切片机上将修好的组织作1~2 μm的半薄片;经2%乙酸双氧鈾及6%柠檬酸铅染色;在日立H-600 IV型透射电子显微镜下观察并拍照.
1.4数据处理
运用Excel 2003及SPSS 17.0对数据进行统计及方差分析,采用邓肯氏新复极差法对不同处理的平均数间进行比较.
2结果与分析
2.1甜樱桃试管苗移栽过程中根系活力的变化
由图1可知,从6月7日到6月22日,根系活力逐渐增强,各处理时间下的值差异均显著;而7月2日即移栽后的第10天,发现根系活力出现了明显的下降,这表明刚移栽的根系对新环境也许有一个适应的过程;但随着移栽时间的延长,根系活力与7月2日相比,均出现显著地增加,在9月12日时达到最大,表明此时根系处于活跃状态,这一系列变化的过程,与后面叶绿素、荧光系数、光合效率及细胞超微结构的变化趋势一致,说明根系的生长、代谢和活力变化可直接影响到地上部的生长发育,根系活力强,能更好的促进叶绿素的合成、叶片对光能的利用,从而提高光合效率.
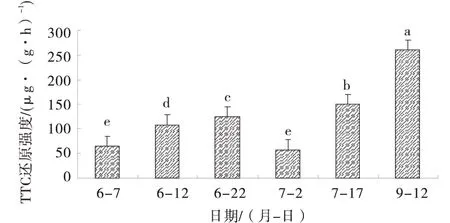
继代培养60 d试管苗(6月7日);闭瓶炼苗5 d(6月12日);开瓶炼苗10 d(6月22日);移栽后10 d(7月2日);移栽后25 d(7月17日);移栽后80 d(9月12日).图1 不同时期根系活力的变化Fig.1 The change of root vitality in different period
2.2甜樱桃试管苗移栽过程中叶片叶绿素含量的变化
叶绿素是光合作用的重要色素,其含量在一定程度上能反映植株的光合强度、营养水平及健康状况.由图2可知,从6月7日到6月22日,甜樱桃试管苗随着炼苗时间的延长及接受的光照强度的不同,叶绿素的含量逐渐增加,且测定值之间差异显著;7月2日即移栽后第10天,叶绿素含量略有降低,出现短暂的对外界环境的适应状态;之后随着移栽时间的延长,到7月17日、9月12日测定时,其含量又逐步增加,结合图1,说明移栽的植株已逐步适应了外界环境,根系活力逐渐升高,光合能力增强.
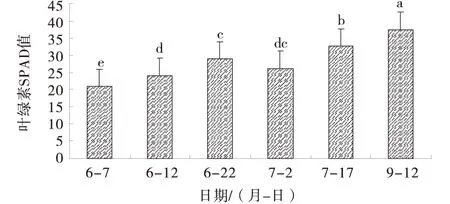
图2 不同时期叶绿素含量的变化Fig.2 The change of chlorophyll content in different period
2.3甜樱桃试管苗移栽过程中叶片叶绿素荧光参数的变化
由表1可知,Fv/Fm在炼苗过程中量子产量有缓慢上升趋势,但差异不显著;7月2日即移栽后第10天其明显下降,与移栽前相比差异显著,之后随着移栽时间延长又呈现不明显的增加趋势,并在移栽80 d时达到最大.表明移栽后由于环境不适应,试管苗可能出现短暂的缓苗时期,使得根系活力下降,光合作用也呈现下降的趋势,也可能是PSⅡ将光能转变为电势能的能力明显减弱.随着试管苗移栽后对环境的适应,根系活力逐渐上升,PSⅡ将光能转变为电势能的能力逐渐增强.说明在移栽驯化过程中叶片光活化酶的催化作用逐渐增强,PSⅡ反应中心的能量捕获效率不断提高,这将促进叶片光合能力的提高.

表1 不同时期叶绿素荧光参数的变化
2.4甜樱桃试管苗移栽过程中叶片光合速率的变化
光合作用是衡量植物糖合成的重要生理指标,蒸腾速率反映叶片对水分散失的调控能力.由表2可以看出,在炼苗过程中,随着光照时间的延长,光合速率增加,6月7日与6月22日测定差异显著;7月2日即移栽后第10天,光合速率出现短暂的降低,7月17日测定,光合速率又出现上升,但不显著,说明移栽驯化过程中幼苗对外界光能和CO2的利用能力不断提高,9月22日即移栽后80天时,光合速率达到最大,说明幼苗已完全适应新环境,开始积累光合产物.而蒸腾速率则在开瓶炼苗(6月22日)时出现了显著地上升,移栽后又出现显著下降,随着移栽时间的延伸,出现不显著的下降.

表2 不同时期气体交换参数的变化
2.5甜樱桃试管苗移栽过程中叶片超微结构的变化
由图3可以看出,从试管苗到移栽整个过程中,细胞之间有疏松-紧密-疏松-紧密的变化趋势,细胞壁逐渐增厚;栅栏组织在试管苗时排列整密,炼苗期间变得紊乱,移栽后又恢复整密;随着移栽时间的延长,甜樱桃幼苗叶片叶绿体形状逐渐趋于丰满,这是试管苗逐渐适应环境的表现,其中移栽25 d时叶绿体形状最饱满,可以更有利于进行光合作用;继代培养60 d的试管苗中无淀粉粒,随着炼苗出现少量淀粉粒、线粒体,移栽后淀粉粒明显增多,叶绿体数量明显增多,体积也明显增大,且细胞中出现少量嗜锇小体,数量并逐步增加,说明随着移栽时间的延长,叶绿体逐渐发育成熟,光合机构向着最有利于光合作用的方向变化,光合积累也逐渐增多.

A1-A4:未炼苗;B1-B4:闭瓶炼苗5 d;C1-C4:开瓶炼苗10 d;D1-D4:移栽后10 d;E1-E4:移栽后25 d;F1-F4:移栽后80 d.Chl:叶绿体;G:叶绿体类囊体;sg:淀粉粒;os:嗜饿颗粒;chM:叶绿体质膜;TH:基质类囊体;V:液泡;Mch:线粒体;CW:细胞壁.图3 不同时期不同倍镜下叶片细胞的电镜照片Fig.3 The photos of leaf cells from different electron microscope in the different period
3讨论与结论
一直以来,试管苗的驯化移栽都是一个重要的问题,因此,研究其在整个过程中的光合作用与叶片超微结构变化之间的联系尤为重要[15].本试验利用对比分析法分析甜樱桃试管苗以及移栽后大田苗各阶段生理指标及细胞超微结构,发现移栽后的大田苗与试管苗相比在各方面有了明显的变化.
光合作用是衡量植物合成功能的重要生理指标,叶绿体又是光合作用的主要部位,光合作用的实现依赖于叶绿素对光能的吸收,环境直接影响到叶绿素的合成[16].叶绿体数量、结构和叶片形态特征是叶片乃至整个植株正常生长发育的基本条件[17-19].叶绿体中基粒片层和基质片层结构的完整有序是光能转换正常有效进行的保证[20],植物叶片的叶绿体内基粒和基粒片层越多、片层排列越整齐致密,叶片光合能力就越强[21].本试验结果也表明,试管苗从驯化炼苗、移栽到适应自然的环境条件这整个过程中,观察其超微结构的变化,发现叶绿体、淀粉粒数量逐渐增多,体积也逐渐变大并出现嗜饿颗粒,叶绿体形状由靠近细胞壁一面凸起的狭长型逐渐变为面向中央液泡一面凸起的丰满型.这很可能是在移栽驯化过程中叶绿体逐渐发育成熟,并与外界进行有效的气体交换,其形状的改变为光合效率的提高提供了有力的保证,这与濮晓珍[22]、蔺经[23]等人的研究结果相似;由于淀粉粒是叶绿体的基质中所储藏的光合产物,所以其数目和体积发生的变化说明幼苗已适应大田环境,进入同化产物的积累期,这与韩艳婷[24]等人的研究结果相符;通常认为嗜锇小体是类囊体降解以及脂质类降解物聚集的结果,它的产生可提高细胞质浓度、降低渗透势、保证水分和无机盐类营养的吸收[25].同时结合根系活力(图1)、叶绿素含量(图2)、叶绿素荧光参数(表1)以及光合速率(表2),发现在炼苗期间叶绿素含量、根系活力均出现了显著地增加,随之光合速率也呈现增加趋势,这与曹刚[26]的研究结果相似,说明试管苗叶片在驯化过程中对光的利用能力逐渐增强,且对弱光也能很好的利用;由于刚移栽后对根系的伤害以及植株从恒温、高湿、弱光、无菌环境转为由于受到太阳光直接照射而引起的温差大、蒸腾作用强等各种逆境环境,使得根系活力、叶绿素含量显著下降,从而光合速率也大幅度降低;随后经过短暂的缓苗后,试管苗适应移栽后的环境,又开始出现上升趋势;叶片荧光参数的变化也是呈现先上升后降低再上升的趋势,随着炼苗时间的延长,叶片具有较高的叶绿素含量、叶绿体紧贴细胞壁、个体大、片层清晰、排列有序,而移栽后10 d,外界环境造成逆境条件,使得叶绿体个体相对较小、片层结构垛叠紧密,从移栽后25 d到80 d时,已逐步适应逆境环境,所以其含量又逐步上升.这些都与电镜里所观察到的淀粉粒、叶绿体等的变化相符合,表明这些生理指标变化的一致性以及相关性.
综上所述,组培苗净光合速率很低,而且刚出瓶的试管苗气孔导度较大、蒸腾失水快,因此,移栽初期保持环境高的相对湿度是防止试管苗过度失水、保证其移栽成活的关键.但随光照强度的增加,刚出瓶的试管苗的气孔导度和蒸腾速率有降低趋势,说明甜樱桃试管苗的气孔虽无关闭功能,却有一定的调节能力,这与柏新富在一品红试管苗上的试验结果相似.随着出瓶移栽驯化时间的延长和环境光照强度的增加,其净光合速率、荧光产量逐渐升高,由此可以认为,甜樱桃试管苗移栽后光合性能迅速提高、气孔导度和蒸腾速率大幅下降是其由半自养半异养向完全自养的转化期,也是其气孔恢复调节功能的重要时期,此期在保持适当湿度的情况下,逐渐增加光照是甜樱桃试管苗移栽成活的关键,即在移栽驯化初期减少水分散失、增强光合能力对提高试管苗的移栽成活率具有重要意义.
本研究探讨了甜樱桃试管苗在炼苗移栽过程中叶片光合特性、超微结构及根系活力发生的一系列适应性的变化,发现随着移栽时间的延长,甜樱桃叶片的光合效率明显提高,并有大量的光合产物积累;同时根系吸收水分、养分的能力及抗逆能力都明显增强,到移栽 80 d时试管苗已完全适应大田环境.
参考文献
[1]Uraiwan A,Gaelle C,Veronoque D,et al.Linkage disequilibrium in French wild cherry germplasm and worldwide sweet cherry germplasm[J].Tree Genetics & Genomes,2012,8:737-755
[2]王计平,侯思宇,孙朝霞,等.欧洲大樱桃的组织培养与快速繁殖[J].安徽农业科学,2007,35(16):4809-4810
[3]周宇.中国樱桃“对樱桃”试管苗移栽影响因子研究[J].中国农学通报,2006,22(5):134-136
[4]夏国海,叶霞,赵冰梅,等.樱桃组织培养研究进展[J].中国果树,2003(3):46-50
[5]Xu J Z,Yu Y M,Peng S Z,et al.A modified nonrectangular hyperbola equation for photosynthetic light-response curves of leaves with different nitrogen status[J].Photosynthetica,2014,52 (1):117-123
[6]Mamoru N,Miwa S.Photosynthesis and artificial photosynthesis research [J].Research on Chemical Intermediate,2014,40:3163-3168
[7]Asaph B C,Matt J,Andrewd B L.Photosynthesis and the environment [J].Photosynthesis Research,2014,119:1-2
[8]汪月霞,孙国荣,王建波,等.NaCl胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系[J].生态学报,2006,26(1):122-129
[9]魏道智,宁书菊,林文雄.小麦根系活力变化与叶片衰老的研究[J].应用生态学报,2004,15(9):1565-1569
[10]温国胜,田海涛,张明如,等.叶绿素荧光分析技术在林木培育中的应用[J].应用生态学报,2006,17(10):1973-1977
[11]Rafaqat A G,Lili Z,Basharat A,et al.Chromium-induced physiochemical and ultrastructural changes in four cultivars ofBrassicanapusL[J].Chemosphere,2015,120(2):154-164
[12]Moorea J P,Waldron M,Clindsey G G,et al.An ultrastructural investigation of the surface microbiota present on the leaves and reproductive structures of the resurrection plantMyrothamnusflabellifolia[J].South African Journal of Botany,2011,77(2):485-491
[13]Najeeb U,Xu L,Ali S,et al.Citric acid enhances the phytoextraction of manganese and plant growth by alleviating the ultrastructural damages inJuncuseffususL.[J].Journal of Hazardous Materials,2009,170:1156-1163
[14]ZOU Q.Guide for plant physiological experiment[M].Beijing China Agriculture Press,2000:173-174
[15]王爱勤,何龙飞,杨春林,等.芦荟组培苗移栽前炼苗及其结构与生理变化的研究[J].中国农学通报,2002,18(4):54-55
[16]Zeng X M,Shi X B,Shen Y G.Effects of truncated mutants of the ε subunit of chloroplast ATP synthase on the fast phase of millisecond delayed light emission of chloroplast and its ATP synthesis ability [J].Chinese Science Bulletin,2004,49(3):258-262
[17]Parida A K,Das A B.Salt tolerance and salinity effects on plants:a review [J].Ecotoxicology and Environmental Safety,2005,60(3):324-349
[18]秦玲,康文怀,齐艳玲,等.盐胁迫对酿酒葡萄叶片细胞结构及光合特性的影响[J].中国农业科学,2012,45(20):4233-4241
[19]杨江山,常永义,种培芳.3个樱桃品种光合特性比较研究[J].园艺学报,2005,32(5):773-777
[20]Johnson Z,Barber R T.The low-light reduction in the quantum yield of photosynthesis:potential errors and biases when calculating the maximum quantum yield [J].Photosynthesis Research,2003,75(1):85-95
[21]孙璐,周宇飞,李丰先,等.盐胁迫对高粱幼苗光合作用和荧光特性的影响[J].中国农业科学,2012,45(16):3265-3272
[22]濮晓珍,尹春英,周晓波,等.铁皮石斛组培苗移栽驯化过程中叶片光合特性、超微结构及根系活力的变化[J].生态学报,2012,32(13):4114-4122
[23]蔺经,杨青松,王中华,等.梨杂种苗童区和成年区叶片光合荧光特征及超微结构研究[J].果树学报,2011,28(5):750-754
[24]韩艳婷,杨国顺,石雪晖,等.不同镁营养水平对红地球葡萄叶绿体结构及光合响应的影响[J].果树学报,2011,28(4):603-609
[25]Wei C X,Wang J J,Wang J B,et al.Effects of Na2CO3stress on the ultrastructure of mesophyII cells inPuccinelliatenuiflora[J].Acta Ecologica Sinica,2006,26(1):108-114
[26]曹刚.不同LED光质对黄瓜和结球甘蓝苗期生长、光合特性及内源激素的影响[D].兰州:甘肃农业大学,2013
(责任编辑李辛)
Changes in root vigor,photosynthetic properties and ultrastructures ofPrunusaviumtube seedlings during transplantation
LI Fu-hui1,MAO Juan1,CHEN Bai-hong1,MI Bao-qin1,XIE Yong-dong2
(1.College of Horticulture,Gansu Agricultural University,Lanzhou 730070,China;2.College of Horticulture,Sichuan Agricultural University,Yaan 625014,China)
Abstract:【Objective】 To explore the adaptation changes of Prunus avium tissue culture seedlings to field environment.【Method】 Tissue-cultured plantlets were avoid to the air for 5 days,exposure to the air for 10 days and 10 days,25 days,80 days after transplanting,the changes in photosynthesis parameters,chlorophyll fluorescence characteristics,ultrastructure,chlorophyll content,as well as root vigor in the course of transplant acclimation were determined.【Result】 The chlorophyll content,root vigor,the maximum photosynthetic rate and the PS II maximum photochemical efficiency gradually increased during the period of hardening-seedling,but decreased significantly after transplanting 10 days.In the early of the process of transplanting,because of the P.avium did not adapt to the external environment,a slow seeding recovering was appeared,made the root activity dropped and lower photosynthetic capacity.Internal structure of chloroplasts at 80 days after transplanting,for example,the volume of starch grains and osmiophilic material became larger,lamellar structure appeared clear,orderly and complete.At this time,the root vigor and chlorophyll content increased obviously.【Conclusion】 During smelting seedling and transplanting,the photosynthetic characteristics,ultrastructure and root activity of P.avium tube seedlings increased as the extension of transplanting time,the leaf photosynthetic efficiency obviously improved,and a large number of photosynthetic product accumulated.Root system's capacity to absorb moisture,nutrients and resilience enhanced obviously,the tube seedlings adapted to the field environment when transplanting 80 days.
Key words:Prunus avium;test-tube seedling;transplant;chlorophyll fluorescence;photosynthetic properties
通信作者:陈佰鸿,男,教授,主要研究方向为果树生理与生物技术.E-mail:bhch@gsau.edu.cn
基金项目:甘肃省农牧厅农业科技创新项目(GNCX-2013-38)
收稿日期:2015-04-15;修回日期:2015-05-25
中图分类号:S 662.5
文献标志码:A
文章编号:1003-4315(2016)01-0077-07
第一作者:李福慧(1984-),男,硕士研究生,研究方向果树栽培生理.E-mail:714234378@qq.com
