饲粮粗蛋白质水平对肉仔鸡肠道PepT1和bo,+AT mRNA表达的影响
2016-04-14唐德富刘醒醒刘国华郝生燕
唐德富,刘醒醒,刘国华,郝生燕
(1.农业部饲料生物技术重点开放实验室,北京 100081;2.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;
3.甘肃省农业科学院,甘肃 兰州 730070)
1717
饲粮粗蛋白质水平对肉仔鸡肠道PepT1和bo,+AT mRNA表达的影响
唐德富1,2,刘醒醒2,刘国华1,郝生燕3
(1.农业部饲料生物技术重点开放实验室,北京100081;2.甘肃农业大学动物科学技术学院,甘肃 兰州730070;
3.甘肃省农业科学院,甘肃 兰州730070)
摘要:【目的】 研究饲粮粗蛋白质水平对肉仔鸡肠道PepT1和bo,+AT mRNA表达的影响.【方法】选用240只21 d‘科宝’肉公鸡,随机分为3组,分别饲喂粗蛋白质水平为16%(16%CP组),18%(18%CP组)和20%(20%CP组)的3种饲粮,每组设8个重复,每个重复10只鸡,42 d测定肠道PepT1和bo,+AT mRNA含量.【结果】 16%CP组平均日增质量、氮利用率和代谢能值均显著低于其他2组(P<0.05),而料肉比显著高于其他2组(P<0.05).PepT1 mRNA表达以空肠最高,十二指肠次之,回肠最低,且空肠显著高于十二指肠和回肠(P<0.05);bo,+AT mRNA表达以回肠最高,十二指肠次之,空肠最低,而回肠显著高于十二指肠和空肠(P<0.05),十二指肠显著高于空肠(P<0.05).随着饲粮粗蛋白质水平的增加,饲粮干物质消化率、粗蛋白质消化率和消化能值均有提高,但未达到显著性水平(P>0.05).肉仔鸡小肠各肠段PepT1 mRNA和bo,+AT mRNA的表达均随饲粮粗蛋白质水平的提高而有不同程度的改善,16%CP组PepT1 mRNA在十二指肠和空肠的表达显著低于20%CP组(P<0.05),其在空肠的表达显著低于18%CP组(P<0.05).20%CP组bo,+AT mRNA在十二指肠和空肠的表达显著高于16%CP组(P<0.05).【结论】适宜的饲料粗蛋白质水平有利于PepT1和bo,+AT mRNA的表达.
关键词:粗蛋白质水平;肉仔鸡;PepT1;bo,+AT
蛋白质作为动物生长的必需营养物质之一,密切参与组织器官的生长发育,饲粮中蛋白质不足或过量均会影响肉仔鸡养分消化利用和生产性能[1].家禽采食的蛋白质,必须被胃肠道消化酶分解成小分子物质如氨基酸、小肽后方可被肠道吸收进入体内,而这类小分子物质的吸收是通过肠道上皮转运载体的作用得以实现[2-4].PepT1是一种重要的小肽转运载体,在动物组织中的分布具有差异性,主要在肠道中表达[5-6].PepT1具有质子依赖性特征,其表达量受多种因素的调控,如肠道中氨基酸的种类、动物生产水平、饲料营养水平和环境因素等[7-9].氨基酸的转运被称为“系统转运”,每类转运系统由多个转运机制不同的转运载体组成,肠道对于碱性氨基酸的吸收主要是通过肠道上皮细胞膜上的氨基酸转运系统[10-11].肠道中存在的碱性氨基酸转运系统包括y+、b0,+、y+L.系统b0,+主要在肠道和肾小管上皮细胞顶端表达,主要功能为从肠腔面吸收碱性氨基酸和胱氨酸,转出中性氨基酸,其重链为rBAT,轻链为SLC7A9[4].Elizabeth等[8]报道肉仔鸡饲粮中使用高品质蛋白饲料豆粕显著上调PepT1和bo,+AT mRNA的表达丰度.因此,本试验旨在研究饲粮粗蛋白质水平对肉仔鸡肠道PepT1和bo,+AT mRNA表达的影响,以期为完善蛋白质营养理论体系提供一定的参考.
1材料与方法
1.1动物试验
1.1.1试验动物与试验设计选用240只体质量接近一致,健康的21 d‘科宝’肉公鸡供试,随机分为3组(组的安排考虑位置效应),饲喂粗蛋白质水平分别为16%、18%和20%的饲粮,每组设8个重复,每个重复10只鸡.试验期为21 d,1~21 d所有试鸡采食商业饲料.试验饲粮为玉米-豆粕型,营养水平参照《中华人民共和国农业行业标准鸡饲养标准,NY/T 33-2004》推荐的营养水平配制,计算配方时,饲料原料中粗蛋白质、钙和磷的含量用实测值,其他指标参考中国饲料数据库2012年饲料成分及营养价值表.饲粮组成及营养水平见表1.
1.1.2饲养管理及免疫试鸡采用3层叠笼饲养,免疫程序参照商业公司推荐的方案,机械通风,24 h连续光照,自由饮水,自由采食.及时清理粪便,定期消毒,以保证鸡舍内环境卫生良好.准确记录处理组各重复日采食量和死淘情况.
1.1.3样品采集于38~41 d进行代谢试验,每天收集粪尿样(剔除鸡毛、饲料、皮屑等污染物)称质量后混匀,然后取20% 的鲜粪尿样,按100 g鲜粪尿加入10%盐酸10 mL充分混匀后置于样品袋中,4 ℃冷藏,最后将4 d内所取样品充分混合,置于65 ℃烘箱烘干,空气中回潮24 h,称质量.
于42 d末以重复为单位,采用放血法屠宰全部试鸡,迅速分离回肠,收集回肠内容物,-20 ℃保存,经冷冻干燥处理后制样,待测.并从每个重复挑选2只接近平均体质量的鸡分离肠道,沿纵向剖开,用4 ℃预冷的磷酸缓冲液(PBS)冲洗,再用吸水纸吸干.分别从十二指肠U状弯曲,空肠和回肠中部处向下取3 cm 肠段,放入1.5 mL 离心管中,置液氮速冻,-70 ℃冷冻保存.

表1 饲粮组成及营养水平(风干基础)
预混料向每千克饲料提供Mn 110 mg,Cu 10 mg,I 0.5 mg,VA 8 000 IU,VD 31 600 IU,VE 5 IU,VK 30.5 mg,泛酸2.5 mg,VB63.0 mg,生物素0.1 mg,叶酸0.25 mg,VB120.04 mg,烟酸20 mg.
1.1.4测定指标与分析分别在试验开始及结束时以重复为单位,称量试鸡体质量,统计平均日增质量、平均日采食量、料质量比和死淘率.待测样品中常规营养养分的测定参考《饲料分析及饲料质量检测技术》[12]的方法进行,二氧化钛含量的测定参照Short等[13]报道方法.
1.2小肠PepT1和bo,+AT mRNA的相对定量
1.2.1样品总RNA的提取将冷冻的肠道组织样加液氮研磨成粉,移入微量离心管中,每100 mg样品中加入1 mL TRIzol试剂,充分混匀,按试剂盒说明用TRIzol一步法提取总RNA.用1%琼脂糖凝胶电泳鉴定RNA质量,核酸蛋白浓度测定仪测定D260/280值及浓度.若RNA有明显的28S和18S 2条带,核酸蛋白浓度测定仪测定D260/280值均在1.8~2.0之间,表明RNA质量好,备存用于反转录.
1.2.2反转录反转录反应体系为20 μL:2 μg RNA,1 μL oligo(dT)20,1 μL dNTP,加DEPC水至12 μL,混合物在65 ℃加热5 min后,迅速置于冰上冷却,短暂离心后,加入4 μL 5×First Strand Buffer,1 μL 0.1 mol/L DTT,1 μL RNase Inhibitor,1 μL M-MLV,混合后于PCR 仪上进行反转录,反应条件为37 ℃ 60 min,70 ℃ 15 min,获得cDNA第1链.
1.2.3引物设计、合成和PCR条件从GenBank里搜索鸡PepT1和bo,+AT mRNA 序列,用Primer 5.0 软件设计引物,由生工生物工程(上海)股份有限公司合成(引物参数见表2),其中β-actin作为内参基因.
PCR反应体系参照王维民等[14]报道结果,即为25 μL:12.5 μL PCR Master Mix,上下游引物各0.8 μL,1 μL cDNA,10 μL ddH2O.反应条件为94 ℃预变性3 min;94 ℃变性30 s,退火30 s(退火温度见表2),72 ℃延伸30 s,35个循环;最后72 ℃延伸7 min.进行PCR扩增时,同时以不加模板的体系作对照,以排除试剂污染和基因组DNA污染引起假阳性的可能.1%琼脂糖凝胶电泳检测PCR产物.
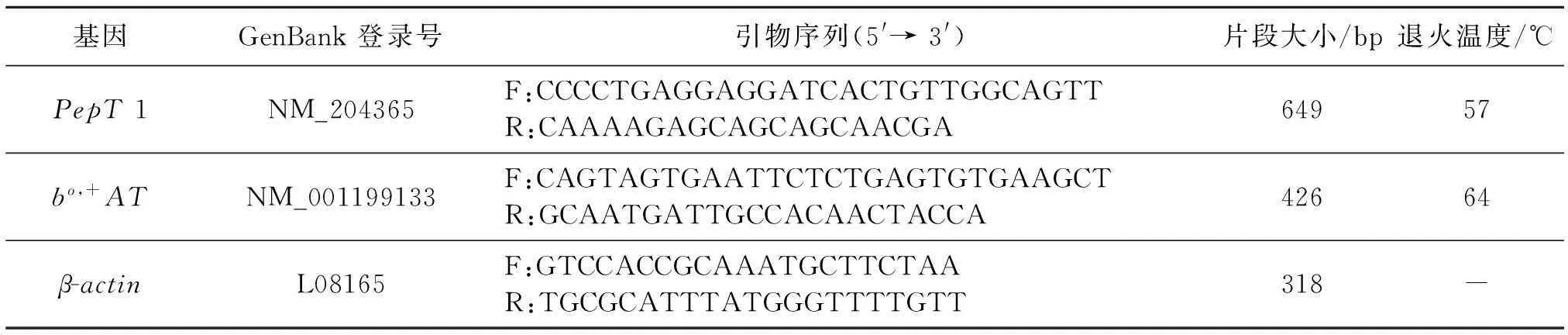
表2 PepT 1、bo,+AT和β-actin基因引物参数
1.3数据处理

2结果与分析
2.1粗蛋白质水平对肉仔鸡生产性能的影响
本试验中,仅有2只试鸡死亡或淘汰,且均非处理效应所致,所以表3中未列该项.由表3可以看出,饲粮粗蛋白质水平对肉仔鸡平均日采食量无显著影响(P>0.05).16%CP组平均日增质量显著低于其他2组(P<0.05),而料肉比显著高于其他2组(P<0.05).

表3 日粮粗蛋白质水平对肉仔鸡生产性能的影响
同列数据小写字母表示差异不显著(P>0.05).
2.2粗蛋白质水平对肉仔鸡养分消化和利用的影响
由表4可见,随着饲粮粗蛋白质水平的增加,干物质消化率、粗蛋白质消化率和消化能均有提高,但未达到显著性水平(P>0.05).16%CP组氮利用率和代谢能值显著低于其他两组(P<0.05).其他指标各组间差异均不显著(P>0.05).
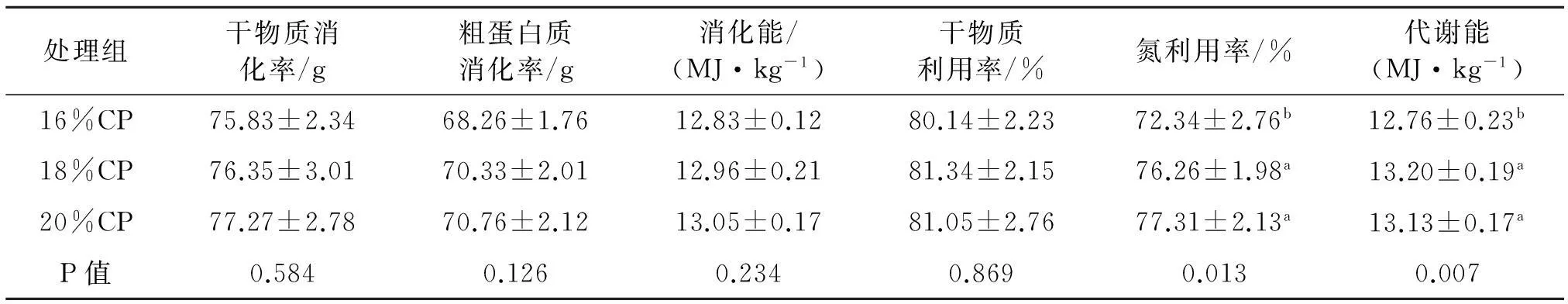
表4 日粮粗蛋白质水平对肉仔鸡养分消化利用的影响
2.3粗蛋白质水平对肉仔鸡小肠各肠段PepT1和bo,+AT mRNA表达的影响
2.3.1RNA质量的检测由图1可见,从肉仔鸡小肠中提取的总RNA在1%琼脂糖凝胶电泳中28S RNA、18S RNA条带明亮可见,而5S RNA条带灰暗,说明样品总RNA完整,降解量较少.另取少量RNA稀释,进行紫外检测,所有样品的D260/280均在1.8~2.0之间,说明RNA的样品满足后续上机测定要求.

图1 肠道总RNA提取鉴定结果Fig.1 The identification result of total RNA extracted from intestinal
2.3.2肉仔鸡小肠各肠段PepT1和bo,+AT mRNA的表达差异待测基因与内参基因光密度比值的大小可直接反映基因表达的丰度.由表5可以看出,PepT1与β-actin的光密度比值以空肠最高,十二指肠次之,回肠最低,且其值在空肠显著高于十二指肠和回肠(P<0.05).bo,+AT与β-actin的光密度比值以回肠最高,十二指肠次之,空肠最低,其值在回肠显著高于十二指肠和空肠(P<0.05),且十二指肠显著高于空肠(P<0.05).
2.3.3粗蛋白质水平与PepT1和bo,+AT mRNA的表达由表6可见,随着饲粮粗蛋白质水平的提高,肉仔鸡小肠各肠段PepT1与β-actin的光密度比值均有不同程度的增加,且16%CP组的十二指肠和空肠光密度比值显著低于20%CP组(P<0.05),其空肠比值显著低于18%CP组(P<0.05).高蛋白水平改善了肠道bo,+AT mRNA的表达,即20%CP组的十二指肠和空肠bo,+AT与β-actin的光密度比值显著高于16%CP组(P<0.05,表7).

表5 肉仔鸡小肠各肠段PepT1 、bo,+AT与β-actin的光密度比值
同行肩标小写字母表示差异显著(P<0.05).
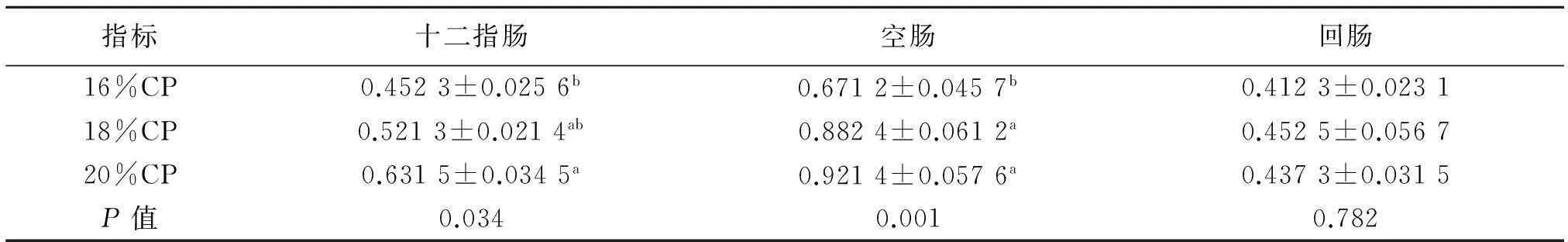
表6 粗蛋白质水平对肉仔鸡小肠各肠段PepT1与β-actin的光密度比值的影响

表7 粗蛋白质水平对肉仔鸡小肠各肠段bo,+AT与β-actin的光密度比值的影响
3讨论与结论
3.1粗蛋白质水平对肉仔鸡生产性能和养分消化利用的影响
蛋白质营养在动物营养中占有非常重要的地位,动物高效利用饲料蛋白质一直是动物营养学研究的热点之一.家禽对饲粮粗蛋白质的变化比较敏感,柏明娜等[15]报道,AA+肉仔鸡后期饲粮蛋白质水平从18%降低到16.5%,肉仔鸡体增质量显著降低,该结果与本试验结果相一致,说明肉仔鸡饲粮粗蛋白质的配制范围较窄,提高饲粮配制的精确性十分有必要.本试验中,处理组间饲粮氮利用率和代谢能值的显著差异导致饲料转化率的显著变化,其根本原因在于饲粮能氮比的变异.在能氮比失衡的情况下,血液中转氨酶活性、血脂、游离脂肪酸和酮体含量升高,造成机体代谢机能紊乱,养分利用率下降,饲料转化率降低[16-17].采食量与日粮组成及营养水平密切相关,家禽的进食量很大程度取决于能量和蛋白质的需要量.早期研究发现,随着日粮粗蛋白质水平增加,家禽的采食量下降[17].本试验中肉仔鸡采食量未出现显著变化,其原因不明,可能是由于肉仔鸡以满足饱腹感为首要采食需要,不同于蛋鸡、鸭子等其他家禽“以能为食”的理论.
3.2粗蛋白质水平对肉仔鸡肠道PepT1和bo,+AT mRNA表达的影响
肠道是动物消化吸收养分的重要场所,肠上皮细胞作为肠道重要的功能结构基础,直接参与食物的消化、吸收及内外分泌.肠上皮细胞营养物质转运载体的表达丰度直接影响养分的吸收.小肽和氨基酸转运载体的表达具有组织特异性,且同一组织在不同发育阶段表达丰度各不相同[6].PepT1和bo,+AT mRNA表达丰度越高,与之相联系的氨基酸吸收较好.谭会泽等[4]报道结直肠bo,+AT的mRNA 表达丰度极显著低于十二指肠、空肠和回肠,其在回肠表达丰度高于空肠、十二指肠,差异不显著.Gilbert等[18]报道PepT1和bo,+AT分别在十二指肠和回肠的表达丰度最高.PepT1在肉仔鸡出壳前后的组织表达谱差异较大,如孵化18日龄时在小肠上皮的表达以空肠最高,而出壳后3日龄以十二指肠最高[19].本试验中,关于bo,+AT的mRNA 表达结果与谭会泽等[4]和Gilbert等[18]报道结果一致,但PepT1的表达丰度以空肠最高,可能与肉仔鸡的日龄、日粮类型、营养水平、生理状况等因素相关,也说明碱性氨基酸主要吸收部位在回肠,而小钛主要在空肠.
Chen等[20]研究结果表明肉仔鸡饲喂12%粗蛋白质水平组饲粮肠道PepT1 mRNA的表达丰度显著低于18%和24%处理组,且日龄和粗蛋白质水平间有显著的交互作用.本试验中,随着饲粮粗蛋白质水平的提高,肉仔鸡肠道PepT1和bo,+AT的表达均有提高,部分结果与Chen等[20]报道一致.就其原因可能有2个方面:一方面饲粮蛋白质水平的提高使得内源消化蛋白质的酶量相应增加,促进了肠道载体的表达[21-22];另一方面蛋白质的消化产物氨基酸和肽同样对载体的表达具有调控作用,如肠道中甘氨酸-谷氨酰胺二肽的增加可促进PepT1 mRNA的表达和甘氨酸-肌氨酸二肽的吸收[22].
综上所述,饲粮粗蛋白质水平影响肉仔鸡肠道PepT1和bo,+AT mRNA的表达,适宜的粗蛋白质水平有助于基因的表达.
参考文献
[1]柏明娜,崔宇,田颖,等.日粮蛋白质水平对AA+肉鸡生产性能及血清生化指标的影响[J].饲料工业,2013,34(20):37-40
[2]Leibach F H,Ganapathy V.Peptide transporters in the intestine and kidney[J].Annu Rev Nutr,1996,16:99-119
[3]Chen H,Wong E A,Webb K E.Tissue distribution of a peptide transporter mRNA in sheep,dairy cows,pigs,and chickens[J].J Anim Sci,1999,77:1277-1283
[4]谭会泽,王修启,苏海林,等.鸡不同肠段碱性氨基酸转运载体mRNA表达的差异性研究[J].畜牧兽医学报,2007,38(3):247-252
[5]Gilbert E R,Li H F,Emmerson D A,et al.Dietary protein quality and feed restriction influence abundance of nutrient transporter mRNA in the small intestine of broiler chicks[J].J Nutr,2008,138:262-271
[6]黄薪蓓,许庆彪,刘建新,等.肠道氨基酸和小肽转运载体的基因表达、影响因素与分子调控机制[J].动物营养学报,2015,27(1):21-27
[7]Shiraga T,Miyamoto K,Tanaka H,et al.Cellular and molecular mechanisms of dietary regulation on rat intestinal H/peptide transporter PepT1[J].Gastroenterology,1999,116:354-362
[8]Nielsen,C U,Amstrup J,Steffansen B,et al.Epidermal growth factor inhibits glycylsarcosine transport and h/PepT1 expression in a human intestinal cell line[J].Am J Physiol,2001,281:191-199
[9]Ihara T,Tsujikawa T,Fujiyama Y,et al.Regulation of PepT1 peptide transporter expression in the rat small intestine under malnourished conditions[J].Digestion,2000,61:59-67
[10]Devs R,Boyd CAR.Transporters for cationic amino acids in animal cells:discovery,structure,and function[J].Physiol Rev,1998,78:487-539
[11]Kanai Y,Segawa H,Chairoungdua A,et al.Amino acid transporters:molecular structure and physiological roles[J].Nephrol Dial Transplant,2000,15(6):9-10
[12]张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2007
[13]Short F J,Gorton P,Wiseman J,et al.Determination of titanium dioxide added as an inert marker in chicken digestibility studies[J].Anim Feed Sci Tech,1996,59:215-221.
[14]王维民,胡庭溪,李发弟,等.绵羊RARG基因在发情不同阶段卵巢中的mRNA表达[J].中国农业科学,2014,47(15):3069-3076
[15]柏明娜,崔宇,田颖,等.日粮蛋白质水平对AA+肉鸡生产性能及血清生化指标的影响[J].饲料工业,2013,34(20):37-40
[16]李伟忠,李焕江.饲粮中适宜能量蛋白比选择的研究进展[J].饲料博览,2003,4:20-22
[17]Smith E R,Pesti G M.Infulence of broilers train cross and dietary protein on the performance of broilers[J].Poultry Sci,1998,77:276-281
[18]Gilbert E R,Li H,Emmerson D A,et al.Developmental regulation of nutrient transporter and enzyme mRNA abundance in the small intestine of broilers[J].Poultry Sci,2007,86:1739-1753
[19]Zwarycz B, Wong E A.Expression of the peptide transporters PepT1,PepT2,and PHT1 in the embryonic and posthatch chick[J].Poultry Sci,2013,92:1314-1321
[20]Chen H,Pan Y X,Wong E A,et al.Dietary protein level and stage of development affect expression of an intestinal peptide transporter (cPepT1) in chickens[J].J Nutr,2005,135:193-198
[21]Noy Y,Sklan D.Digestion and absorption in the young chick[J].Poultry Sci,1995,74:366-373
[22]Walker,D,Thwaites,D T,Simmons,N L,et al.Substrate upregulation of human small intestinal peptide transporter,h/PEPT1[J].J Physiol,1998,507:696-706
(责任编辑李辛)
Effect of crude protein level of diets on mRNA expression of PepT1 and bo,+AT at intestinal of broilers
TANG De-fu1,2,LIU Xing-xing2,LIU Guo-hua1,HAO Sheng-yan3
(1.Key Laboratory of Feed Biotechnology,The Ministry of Agriculture of the People′s Republic of China,Beijing 100081,China;2.College of Animal Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;3.Gansu Academy of Agricultural Sciences,Lanzhou 730070,China)
Abstract:【Objective】 To assess the effect of dietary crude protein level on mRNA expression of intestinal PepT1 and bo,+AT of broilers.【Method】 240 male Cobb broilers were selected and assigned randomly into three groups,each with 8 repeats and 10 birds for per repeat,and were fed the three diets with the protein level of 16% (16%CP),18% (18%CP) and 20% (20%CP),respectively.【Result】 The average daily body weight gain,n utilization rate and metabolizable energy of 16% CP was higher than those of others (P<0.05),but the reverse case for Feed/Gain (P<0.05).There was the highest expression of PepT1 mRNA at jejunum,and the lowest at ileum,as well as jejunum was significantly higher than that at the duodenum and ileum (P<0.05).Bo,+AT mRNA expression was highest in the ileum,and lowest at jejunum,and ileum was significantly higher than that in the duodenum and jejunum(P<0.05),and duodenum was significantly higher than that of the jejunum (P<0.05).With increasing of dietary crude protein level,dry matter digestibility,crude protein digestibility and digestible energy of diets w ere increased as well,but did not reach to the significant level (P>0.05).The expression of PepT1 and bo,+AT mRNA were improved with increasing of dietary crude protein level.The expression of PepT1 mRNA at both duodenum and jejunum of 16%CP was significantly lower than those of 20%CP (P<0.05),and the jejunum of it was significantly lower than that of 18%CP (P<0.05).20%CP group had the higher expression of bo,+AT mRNA in the duodenum and jejunum than that of 16%CP (P<0.05).【Conclusion】 The results indicate that the expression of PepT1 and bo,+AT mRNA could be improved by suitable dietary crude protein level.
Key words:crude protein level;broiler;PepT1;bo,+AT
通信作者:刘国华,男,研究员,主要从事家禽营养研究.E-mail:liuguohua@caas.cn
基金项目:农业部饲料生物技术重点开放实验室开放课题.
收稿日期:2015-03-02;修回日期:2015-09-28
中图分类号:S 831.92
文献标志码:A
文章编号:1003-4315(2016)01-0001-06
第一作者:唐德富(1982-),男,讲师,主要从事动物营养与畜产品品质研究.E-mail:tangdf@gsau.edu.cn
