豌豆离体再生体系建立及遗传稳定性研究
2016-04-14刘本家杨晓明
刘本家,杨晓明
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃省农业科学院
作物研究所,甘肃 兰州 730070)
豌豆离体再生体系建立及遗传稳定性研究
刘本家1,杨晓明2
(1.甘肃农业大学生命科学技术学院,甘肃 兰州730070;2.甘肃省农业科学院
作物研究所,甘肃 兰州730070)
摘要:【目的】 提高速豌豆诱伤组织和不定芽的诱导率,建立豌豆高效离体再生体系.【方法】 以半无叶型豌豆品种‘陇豌1号’和蔓生型豌豆品种‘S3008’的茎段为外植体,研究不同基因型、培养基激素配比对愈伤组织诱导、分化的影响.【结果】 ‘陇豌1号’茎段愈伤组织诱导率和分化率较高,分别达到88.7%和76.7%,‘S3008’茎段最高愈伤组织诱导率和分化率分别为86.7%和74.7%.诱导愈伤组织最适培养基是MS+2 mg/L TDZ+0.2 mg/L 2,4-D;诱导不定芽形成的最适培养基为MS+2 mg/L TDZ+1 mg/L 6-BA,平均不定芽数为4.3;在不定芽诱导生根培养基(1/2MS+20 g/L蔗糖+1.5 mg/L ABT)上,生根率为74.0%,移栽后再生植株成活率达86.0%.两个豌豆品种都能得到再生植株且繁殖系数高.【结论】 本培养体系适宜豌豆离体再生.通过染色体分析,再生植株染色体数和供体亲本材料一致,初步表明再生植株遗传稳定.
关键词:豌豆;茎段;愈伤组织;离体再生;染色体鉴定
豌豆(Pisumsativum)属于豆科、豌豆属一年生或越年生草本植物[1],是一种兼有粮食、饲料、蔬菜、肥料和医药等多种用途的农作物.豌豆具有丰富而均衡的营养,蛋白质含量比小麦、玉米高2~3倍[2].近年,豌豆在畜牧业和可持续农业发展中起着重要作用,种植面积和市场需求不断扩大,但由于病虫害以及干旱、低温等不利条件的影响,产量很不稳定.利用常规育种方法进行豌豆品种改良周期长且效率低.转基因技术具有时间短见效快的特点,但转基因技术必须以高效稳定再生体系为基础[3].豌豆的组培离体再生研究国内外已有报道.Schroeder等[4]以豌豆未成熟种子的下胚轴为外植体进行豌豆的转化和再生.Bean等[5]以干种子为起始材料,利用未成熟的幼胚直接获得转基因的芽,没有通过中间的愈伤组织阶段.苏承刚等[6]发现,在激素对豌豆茎和真叶诱导愈伤组织及芽分化研究中,不同浓度的BA,KT与NAA组合中均未成功诱导豌豆茎和真叶愈伤组织分化出不定芽.已有的相关研究结果普遍存在重复性差、培养条件要求严格、再生频率低等问题,一定程度上制约了依靠基因工程方法对豌豆进行种质改良.为了提高愈伤组织和不定芽的诱导率,建立高效豌豆离体再生体系,本试验选取豌豆幼苗的茎段为外植体,进行组织培养及植株的再生研究,以期为豌豆的离体快繁和遗传转化等工作奠定基础.
1材料与方法
1.1试验材料
本试验选用半无叶型豌豆品种‘陇豌一号’和蔓生型豌豆品种‘S3008’为材料.两品种均由甘肃省农科院作物所提供.
1.2方法
1.2.1无菌苗的准备将豌豆种子用水浸泡6~8 h,在流动的水中冲洗30 min,用无菌水冲洗1次,然后于超净工作台上用75%酒精消毒30 s,再用1%的“84”消毒液浸泡10 min,最后转入0.1%的升汞溶液消毒8~10 min,无菌水冲洗4~6遍.将消毒好的豌豆种子接种于不含任何生长激素的MS培养基上.7~10 d后得到无菌苗.
1.2.2外植体诱导愈伤组织切取无菌苗的茎段约1 cm为外植体.外植体分别接种至含不同质量浓度 2,4-D(0、0.2、0.5 mg/L)和TDZ(0.5、1.0、2.0 mg/L)的愈伤组织诱导培养基上(表1).25 d后开始计算愈伤组织诱导率,得出最佳愈伤组织诱导培养基.

1.2.3不定芽的诱导将第一步中得到的愈伤组织切成约0.5 cm×0.5 cm的小块,接种到不同激素配比的MS分化培养基上(表 2).20 d后观察记录不定芽分化结果.
1.2.4带芽愈伤组织的继代培养将含有芽的愈伤组织切成小块,接种到MB5(含有MS培养基的盐和B5培养基的维生素和烟酸)培养基上,GA3、6-BA和IAA配比见表3.25 d后统计不同培养基中不定芽的生长情况.
1.2.5生根和驯化移栽将培养到2~3 cm的不定芽剪下,把切口插入到以1/2MS为基本培养基,附加20%的蔗糖及不同浓度的ABT或NAA培养基上(表4),进行不定芽生根培养.统计生根率.当试管苗的根伸长约3 cm时,进行驯化,移栽至温室.
以上各项试验处理都为3次重复,每个重复含有外植体50个.基本培养基为MS培养基.培养基中附加3%蔗糖和0.45%琼脂, pH调至5.8~6.0,常规高压灭菌,培养温度(22±2)℃,光周期为12 h光/12 h暗,光照强度2 000~3 000 lx.
1.2.6根尖染色体观察以两个豌豆品种的再生植株和亲本材料根尖为试验材料.采用低温预处理的方法[7],在4 ℃条件下处理24 h.预处理后的根尖于卡诺固定液(无水乙醇∶冰醋酸=3∶1)中固定20~24 h,固定后的根尖用蒸馏水反复冲洗后,放入1 mol/L的盐酸中,在60 ℃下解离10 min,经解离的根尖用蒸馏水反复冲洗, 再用改良的石炭酸品红染液染色10 min后压片,用普通光学显微镜镜检.
2结果与分析
2.1不同激素组合对豌豆愈伤组织形成的影响
由表1看出,不同激素配比的培养基均能诱导出愈伤组织,随着2,4-D浓度的增加,茎段愈伤组织诱导率呈上升趋势.其中,外植体茎段在MS+TDZ2 mg/L+2,4-D 0.2 mg/L中培养5~7 d后,
两端膨大,25 d后‘陇豌一号’和‘S3008’茎段外植体的出愈率分别达到88.7%和86.7%.在MS+TDZ 2 mg/L+2,4-D 0.5 mg/L组合中平均愈伤组织诱导率达到90%以上.但形成愈伤组织的质地不一样,前者愈伤组织质地较后者紧实,大多为浅绿色或者绿色,可进行芽分化,而后者愈伤组织过于膨大和松散,呈淡黄色,表面有白色颗粒,不利于分化芽.
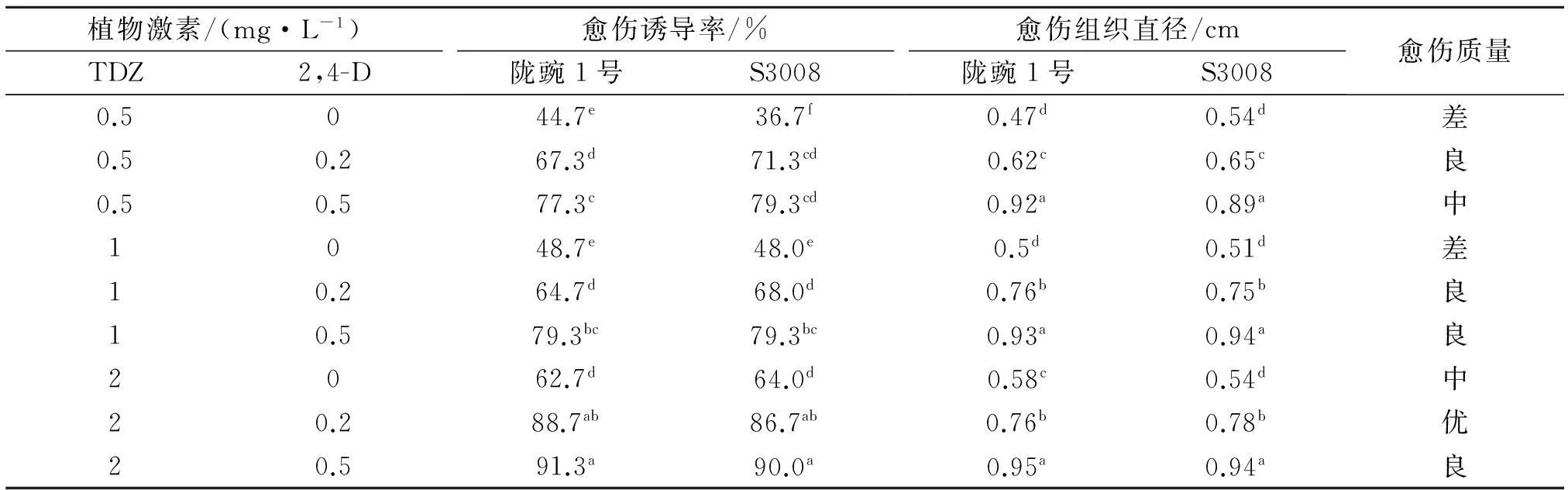
表1 不同培养基对愈伤组织诱导的影响
同一列中小写字母不同者差异显著(P<0.05).下同.
2.2不同激素养组合对不定芽诱导的影响
愈伤组织在分化培养基上培养14 d后,愈伤组织开始分化形成不定芽,培养20 d后统计不定芽的分化情况(表2).在添加2 mg/L TDZ和1 mg/L 6-BA的分化培养基处理中,平均诱导率为75.7%,高于其他激素配比处理,且长势良好.但是在单一添加6-BA的培养基中不定芽诱导率较低.当 6-BA浓度固定时,TDZ浓度在1~4 mg/L范围内,分化形成不定芽的数量随浓度的增加而增加.当TDZ浓度为4 mg/L时,每块愈伤组织平均含有7.9个芽,但芽变得越来越纤细,叶子也很小.这说明高浓度的TDZ对不定芽的增值有利,但大量的不定芽之间会产生竞争,抑制不定芽的生长,不利于后期完整植株的构建.
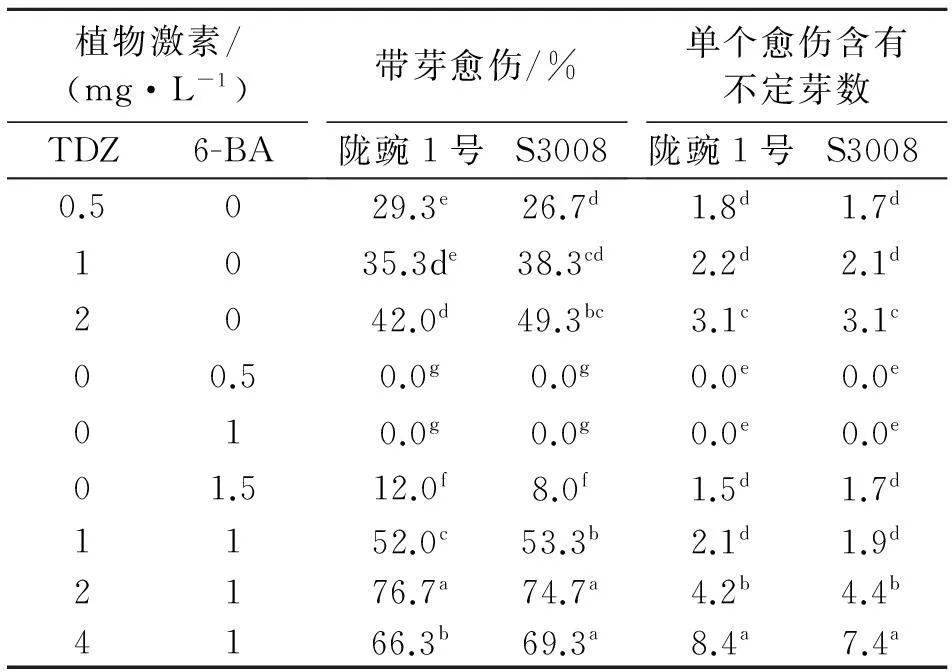
表2 不同激素组合对不定芽诱导的影响
2.3不同激素对不定芽继代培养的影响
不定芽在继代培养基中培养15 d后,19.3%~69.3%的外植体存活,当同时使用6-BA和IAA这两种激素时得到了较高的存活率,6-BA的加入有利于增加不定芽的数量.GA3的添加与否得到了两种形态的不定芽.添加GA3时得到细长且颜色较浅的不定芽(图1-A);缺少GA3时得到了短粗且颜色较深的不定芽(图1-B).在添加1 mg/L 6-BA和IAA继代培养基处理中,两个豌豆品种的外植体存活和外植体芽数高于其他激素配比处理,且生长状况良好.因此 MB5+1 mg/L 6-BA+1 mg/L IAA是不定芽的继代培养最佳培养基.

A:添加GA3;B:不添加GA3图1 不同激素组合对不定芽继代培养的影响Fig.1 Effects of different plant growth regulator combinations on the subculture of adventitious bud
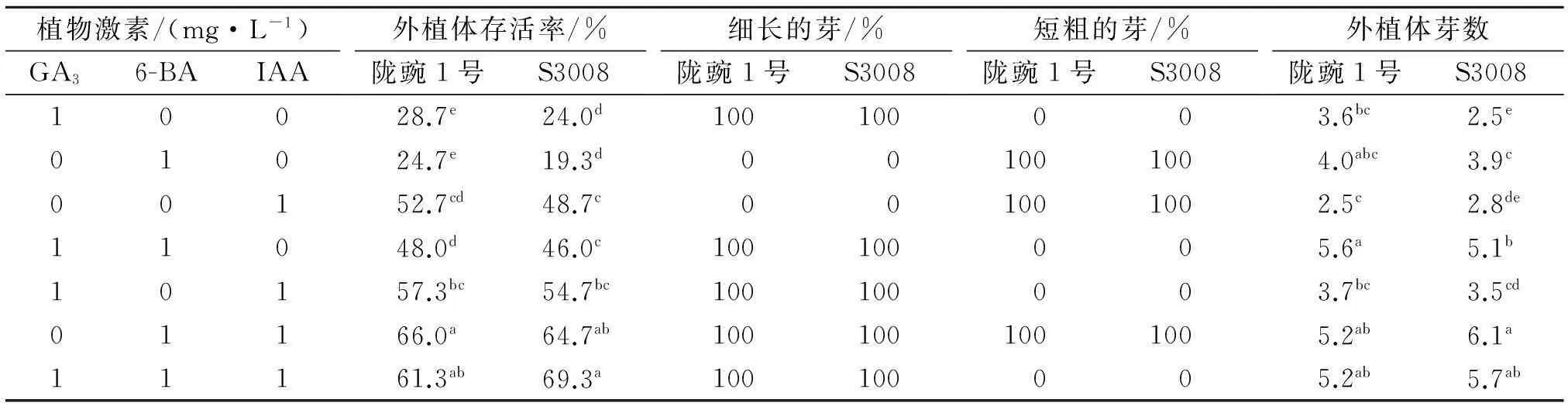
植物激素/(mg·L-1)GA36-BAIAA外植体存活率/%陇豌1号S3008细长的芽/%陇豌1号S3008短粗的芽/%陇豌1号S3008外植体芽数陇豌1号S300810028.7e24.0d100100003.6bc2.5e01024.7e19.3d001001004.0abc3.9c00152.7cd48.7c001001002.5c2.8de11048.0d46.0c100100005.6a5.1b10157.3bc54.7bc100100003.7bc3.5cd01166.0a64.7ab1001001001005.2ab6.1a11161.3ab69.3a100100005.2ab5.7ab
2.4生根和驯化移栽
将长度为2~3 cm的不定芽接种到生根培养基中,接种培养20 d后观察统计,结果见表4.以豌豆茎段为外植体获得的再生植株见图2.在附加不同浓度ABT的培养基上生根效果较好.最适生根培养基为蔗糖质量浓度20 g/L的1/2MS+ABT 1.5 mg/L,不定芽的生根率达到74%以上,平均每个不定芽生根4.2条,且试管苗长势旺盛.而在附加有不同浓度的NAA培养基中,不定芽基部易形成膨大的愈伤组织,但生根效果较差.当试管苗的根伸长约4 cm时,打开瓶塞驯化3 d后,取出试管苗用自来水将根部培养基冲洗干净.转移到灭菌的培养土中,一周后成活率达到86%以上.
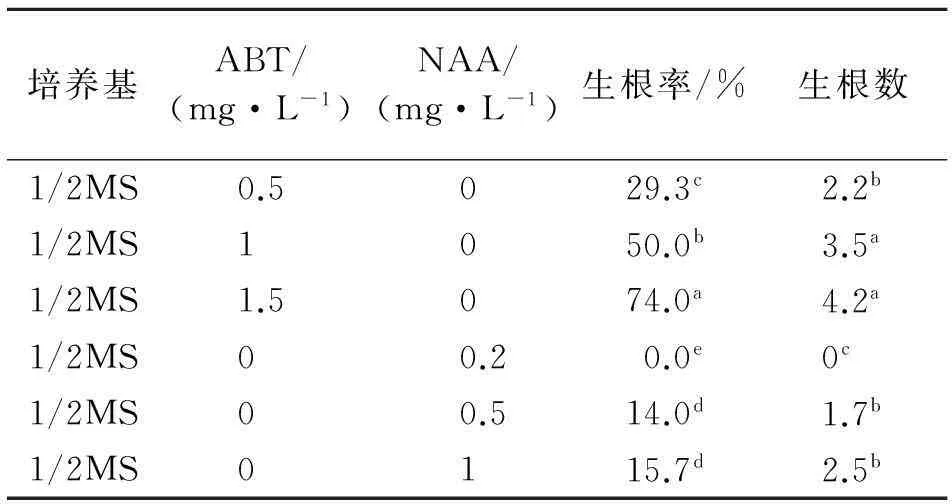
表4 培养基和植物生长调节剂对不定芽生根的影响

a:通过种子获得的豌豆幼苗;b:茎段外植体在培养3周后诱导的愈伤组织;c:愈伤组织在MS+TDZ 2 mg/L+6-BA 1 mg/L培养2周分化的不定芽;d:不定芽继代培养;e:再生芽在1/2MS+20 g/L蔗糖+1.5 mg/L ABT培养25 d后的生根情况;f:再生植株的驯化移栽.图2 豌豆茎段组织培养及植株再生Fig.2 Tissue culture and plant regeneration from stems of peas
2.5根尖染色体观察
从图3看出,两个豌豆品种的再生植株和供体亲本植株根尖染色体数目相同(2n=2x=14),再生植株倍性稳定和供体亲本材料的染色体数一致.
3讨论
3.1外植体的选择
研究表明,对于同一组织和器官来说,幼年时期比成年期更容易培养和再生植株[8].本研究选取培养7~10 d无菌苗的茎段为外植体,筛选出豌豆离体再生的最佳激素配比组合,通过5个步骤获得了再生植株(图2).前人对豌豆茎段外植体已有研究.张晨等[9]以山野豌豆的嫩茎为材料,对再生苗的影响因素进行研究,通过器官发生途径获得了再生苗.Tzitzikas等[10]以豌豆茎段为外植体,只添加细胞分裂素直接诱导出带芽组织.但前人研究中并未提及不定芽在茎段上的分化位点.本试验发现,在愈伤组织诱导不定芽分化过程中,不定芽的分化位点多集中在茎段的节和分蘖部位.因此,应尽量切取带节或带分蘖部位茎段进行培养,成功率较高.
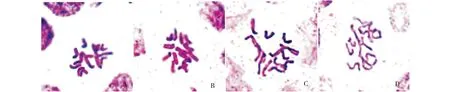
A:陇豌1号再生植株;B:供体亲本材料;C:S3008再生植株;D:供体亲本材料图3 供体亲本和再生植料染色体Fig.3 Chromosomes of the donor plants and the regenerated plants
3.2植物激素对植株再生能力的影响
在豌豆组织培养中,激素种类和浓度是最重要的影响因素,不同浓度的激素配比,对愈伤组织诱导和分化有明显差异.调节植物再生并不是单一种或某几种激素的作用,而是内源激素和外源激素共同作用的结果,它们共同控制着各种营养物质的代谢而影响植物的再生[11].前人研究表明,2,4-D预培养可以显著提高不定芽形成率[12].本试验中2,4-D的浓度是诱导胚性愈伤的关键.在只附加TDZ的情况下,外植体不能增殖或增殖缓慢,颜色逐渐变浅发黄.较低浓度的2,4-D能显著提高愈伤组织诱导率,若2,4-D浓度过高,愈伤组织生长旺盛呈水渍状,后期愈伤组织底部褐化,表面出现大量白色颗粒状突起,不利于不定芽的分化.说明过低或过高浓度的2,4-D均不利于愈伤组织诱导.
在不定芽的诱导过程中,发现在激素浓度相同的情况下,无论不定芽再生率,还是平均再生不定芽数,TDZ均优于6-BA.马光等[13]同样发现TDZ比6-BA更适于诱导芜菁不定芽的再生,而且TDZ比6-BA能够诱导芜菁产生不定芽的浓度范围大.同时添加两种激素比单一使用一种激素效果好,说明TDZ和6-BA组合对豌豆不定芽的诱导有一定的促进作用.这与Khalafalla等[14]报道的在MS+2 mg/L TDZ+2 mg/L 6-BA培养基上,蚕豆平均再生不定芽数最大的结果基本一致.
3.3外植体褐化及抑制
在愈伤组织继代和不定芽分化培养过程中,容易出现褐化现象.有资料表明[15],在外植体接种前进行低温处理,或刚开始在弱光下培养,褐化现象可被明显抑制,在培养基中加入PVP、活性碳一类的吸附剂可以吸附醌类物质,减轻对外植体的毒害作用,此外,VC、柠檬酸等抗氧化剂对褐化也有抑制作用.
参考文献
[1]郑卓杰,王述民,宗绪晓.中国食用豆类学[M].北京:中国农业出版社,1997
[2]杨晓明,任瑞玉.国内外豌豆生产和育种研究进展[J].甘肃农业科技,2005(8):3-5
[3]罗志娜,赵桂琴,刘欢.燕麦成熟胚的组织培养及植株再生[J].甘肃农业大学学报,2012,47:60-68
[4]Schroeder H E,Schotz A H,Wardley-Richardson T,et al.Transformation and regeneration of two cultivars of pea (PisumsativumL.)[J].Plant Physiology,1993,101(3):751-757
[5]Bean S J,Gooding P S,Mullincaux P M,et al.A simple system for pea transformation[J].Plant Cell Reports,1997,16(8):513-519
[6]苏承刚,吴学科,郑占伟,等.食荚型豌豆组织培养和植株再生研究[J].西南师范大学学报:自然科学版,2007,32(4):30-32
[7]杨起简,周禾,孙彦,等.豌豆染色体制片技术的比较研究[J].北京农学院学报,2003,18(3):172-173
[8]高金辉,王玲,张厚良,等.山葡萄组织培养方法[J].东北林业大学学报,2007,35(7):37-39
[9]张晨,王巍,赵溦,等.山野豌豆组织培养及无性系建立的研究[J].黑龙江科学,2012,3(3):8-11
[10]Tzitzikas E N,Bergervoet M,Raemakers K,et al.Regeneration of pea (PisumsativumL.) by a cyclic organogenic system[J].Plant cell Reports,2004,23(7):453-460
[11]那光宇,张姝媛,郭娜,等.什锦丁香花芽分化过程中植物内源激素的变化[J].内蒙古农业大学学报:自然科学版,2012,Z1:58-61
[12]Radke S E,Turner J C,Facciotti D.Transformation and regeneration ofBrassicarapausingAgrobacteriumtumefaciens[J].Plant Cell Reports,1992,11(10):499-505
[13]马光,周波,李玉花.芜菁高频率再生体系的建立及优化[J].园艺学报,2008,35(6):833-840
[14]Khalafalla M M,Hattori K.Differentialinvitrodirect shoot regeneration responses in embryo axis and shoot tip explants of faba bean[J].Breeding Science,2000,50(2):117-122
[15]吴琼.油莎豆再生体系的建立及多倍体诱导[D].兰州:兰州大学,2009
(责任编辑胡文忠)
Regeneration and genetic stability of peas (PisumsativumL.)invitro
LIU Ben-jia1,YANG Xiao-ming2
(1.College of Life Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;2.Institute of Crop Research,Gansu Academy of Agricultural Sciences,Lanzhou 730070,China)
Abstract:【Objective】 To increase the rate of callus inductive and adventitious bud induction,and to set up new regeneration system.【Method】 The stems of semi-leafless peas cultivars ‘Longwan NO.1’ and vining peas cultivar ‘S3008’ were used as explants,the effect of different genotypes,hormone types and the ratio of medium were studied on callus induction,callus differentiation and rooting.【Result】 The higher frequency of callus initiation and differentiation from stems of ‘Longwan NO.1’ was 88.7% and 76.7%.The frequency of callus initiation and differentiation from stems of ‘S3008’ was 86.7% and 74.7%.The optimal medium for callus induction was MS+2 mg/LTDZ+0.2 mg/L 2,4-D.The appropriate medium for adventitious bud induction was MS+2 mg/L TDZ+1 mg/L 6-BA,the adventitious bud number per explants was 4.3.The adventitious bud on rooting induction medium were 1/2MS+20 g/L sucrose+1.5 mg/L ABT,the rooting rates was 74% and the survival rates of regenerated plants were 86%.【Conclusion】 The two cultivars tested are all able to produce regeneration plant and propagate coefficient is high,shows that this new regeneration system could be applicable to regeneration of peas in vitro.By chromosome analysis,chromosome number of the regenerated plants are same to the donor plants,which is suggested that the regenerated plants are genetic stable.
Key words:peas;stems;callus;in vitro regeneration;chromosome identification
通信作者:杨晓明,男,研究员,硕士生导师,主要从事作物遗传育种、病虫害防控和分子生物学的研究.E-mail:yangxm04@hotmail.com
基金项目:现代农业食用豆产业技术体系项目(CARS-09-G8);国家自然科学基金项目(31460382).
收稿日期:2015-03-10;修回日期:2015-03-31
中图分类号:S 643.3
文献标志码:A
文章编号:1003-4315(2016)01-0040-05
第一作者:刘本家(1987-),男,硕士研究生,研究方向为植物学.E-mail:liu.benjia@163.com
