原发性开角型青光眼与SOD2基因多态性相关性分析
2016-04-14刘祥琴
刘祥琴
(四川省医学科学院·四川省人民医院检验科,四川 成都 610072)
原发性开角型青光眼与SOD2基因多态性相关性分析
刘祥琴
(四川省医学科学院·四川省人民医院检验科,四川 成都610072)
[摘要]目的:本实验拟研究锰超氧化物歧化酶(SOD2)变异在原发性开角型青光眼(POAG)中的作用。方法:以750例散发青光眼患者和1 500例正常对照者,对rs6917589、rs2842980、rs5746136、rs4880的SOD2单核苷酸多态性(SNP)位点用SNaPshot法进行基因分型。采用χ2检验对等位基因频率进行分析。结果:等位基因关联分析表明,rs6917589和rs5746136与POAG有相关性(P=0.023和P=0.026)。rs2842980和rs4880与POAG无相关性(P=0.064和P =0.703)。由这4个SNP组成的单倍体型ATGT有POAG的趋势(P=0.003 2)。结论:我们的结果显示SOD2与POAG的发生存在相关性,表明SOD2可能在POAG发展过程中发挥重要作用。
[关键词]超氧化物歧化酶2;原发性开角型青光眼;单核苷酸多态性
青光眼是全球第二大导致失明的疾病,全世界6 700万人罹难该病[1]。其特点是视野缺陷、视网膜神经节细胞死亡、视神经逐步退化[2]。原发性开角型青光眼(primary open angle glaucoma,POAG)是原发性青光眼的主要类型,表现为无明显原因且虹膜角膜角开放,视神经纤维损失通常伴随着典型的视野的缺损,常见眼压(intraocular pressure,IOP)升高,进展通常是无痛性视力和明显视野缺失直到有明显的、不可逆的视野缺损,最终可能导致失明。
青光眼是一种由多种基因和环境因素等引起的多因素疾病[3]。家系研究发现MYOC、OPTN、WDR36这3个基因的突变会导致该病的发生[4-5]。迄今为止,已报道了超过20个基因或位点与POAG的致病相关[6],例如CAV1、CAV2、CDKN2B-AS1、CDKN2A、CDKN2B、TMCO1[7-8]。然而,这些已发现与POAG有关的变异不超过10%的青光眼病例[9,6],且POAG与这些基因的机理尚不清楚。
氧化应激已在多个方面证实为青光眼发生的风险因素[10-11],它反映了机体的活性氧(reactive oxygen species,ROS)失衡。ROS作为第二信使,调节蛋白质的功能,参与视网膜神经节细胞死亡信号通路。在青光眼病理中,抗氧化酶活性和低分子量抗氧化剂水平证实了氧化应激反应[12]。青光眼患者眼睛内,氧化和抗氧化的失衡可能会导致大量的分子变化从而导致这种眼部疾病的发展。抗氧化酶如超氧化物歧化酶(orgotein superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)被发现存在于房水。同时,青光眼患者的眼房水也发现SOD2表达的变化[13-17],青光眼患者的血清样本也表现SOD活性降低[18]。
SOD2基因编码锰依赖超氧化物歧化酶,它是一种线粒体抗氧化酶,负责清除线粒体ROS,防止氧化应激反应。以前的研究已经证明,在沙特人群中SOD2的基因多态性(SNP rs4880)与POAG有关联[19]。在本研究中,我们拟研究SOD2基因多态性与POAG的关系。
1材料和方法
1.1研究对象本研究采集2012—2015年到四川省人民医院就诊的750例青光眼患者和1 500例正常对照者。经四川省人民医院伦理委员会审核通过,并签署知情同意书。所有的研究对象都是汉族人,且3代以上亲属都是汉族人口。原发性开角型青光眼病患纳入的诊断标准为:眼压(IOP)>22 mmHg,虹膜角膜角开放(Shaffer等级Ⅲ级或Ⅳ级);视神经损伤,杯盘比高于0.5,视神经盘出血,神经纤维层和焦损失;视野变化特征测试通过标准化自动视野测量[1];排除先天性青光眼以及任何形式的继发性青光眼,如表皮脱落综合征或眼外伤史。正常对照人群来源于本院正常体检人群,排除了其他眼睛方面疾患。病例组和对照组性别、年龄大致匹配。病例组患者年龄32~84岁,平均52.22±7.91岁;对照组年龄35~90岁,平均51.2±9.5岁。对照组眼压12.05~19.82 mmHg,平均杯盘比对照组0.32;病例组患者组眼压是23.0~37.5 mmHg,平均杯盘比是0.80。
1.2SOD2基因单核苷酸多态性分析在该研究中,我们通过国际人类基因组单体型图计划项目网站(www.hapmap.org)选择了SOD2基因的4个标签SNP:rs6917589、rs2842980、rs5746136和rs4880[20],然后对每个样本进行了4个SNP位点分型。具体方法是将静脉血用乙二胺四乙酸(EDTA)抗凝,用酚氯仿抽提乙醇沉淀法提取基因组DNA,采用Takara公司PCR试剂盒进行PCR反应,再采用ABI公司的单碱基末端延伸法(SNaPshot法)并利用ABI公司的ABI 3130遗传分析仪和Genemapper软件对SOD2基因的4个SNP位点进行基因分型。
1.3统计学分析通过Hardy-Weinberg平衡(HWE)公式对每个SNP的多态性进行检测。病例组和对照组等位基因和基因型频率采用χ2检验进行统计分析得到P值、优势比(OR值)和95%可信区间(CI),并通过Bonferroni进行校正。P值<0.012 5(0.05/4)被认为差异存在统计学意义。采用统计分析软件SPSS15.0。通过软件Haploview4.2进行SNP之间连锁不平衡检验和单倍型分析,得到D′和r2值[21]。
2结果
2.1等位基因分布的单核苷酸多态性分析所有SNP的等位基因分型结果符合Hardy-Weinberg平衡(P>0.05),表明单核苷酸多态性基因型分型结果没有明显的错误,并且所选择的研究对象随机性好,无地域、人群种族偏差。4个标签SNP的等位基因和基因型的分布和相关性分析结果如表1所示。

表1 SOD2和POAG相关性分析
相关性分析结果未发现这4个SNP与POAG存在显著相关(P>0.012 5)。关联分析显示 rs6917589和rs5746136等位基因的分布可能与POAG相关,存在相关性趋势(rs6917589的P=0.023,OR=0.86,95%CI:0.76~0.97,rs5746136的P=0.026,OR=0.86,95%CI=0.76~0.98)。而rs2842980和rs4880位点与POAG的发生没有相关性(P=0.064和P=0.703)。rs6917589和rs5746136等位基因G在病例组合对照组中频率存在较明显差异,病例组中分别为0.462和0.528,而对照组为0.574和0.563。
此外,我们还分别按照隐形和显性遗传模式分析了这4个SNP与POAG的相关性。由于统计模型在这项研究中应用,有意义的P值应该是<0.004 2[0.05/(4个snp×3模型)]。只有在隐性模式下rs6917589和rs5746136与POAG有显著性相关(P=0.001 8和0.000 6,OR=0.73和0.71,95%可信区间为0.60~0.89和0.58~0.86)。见表2。另外2个SNP:rs2842980和rs4880的显性和隐性遗传模式没有发现与POAG存在相关性。
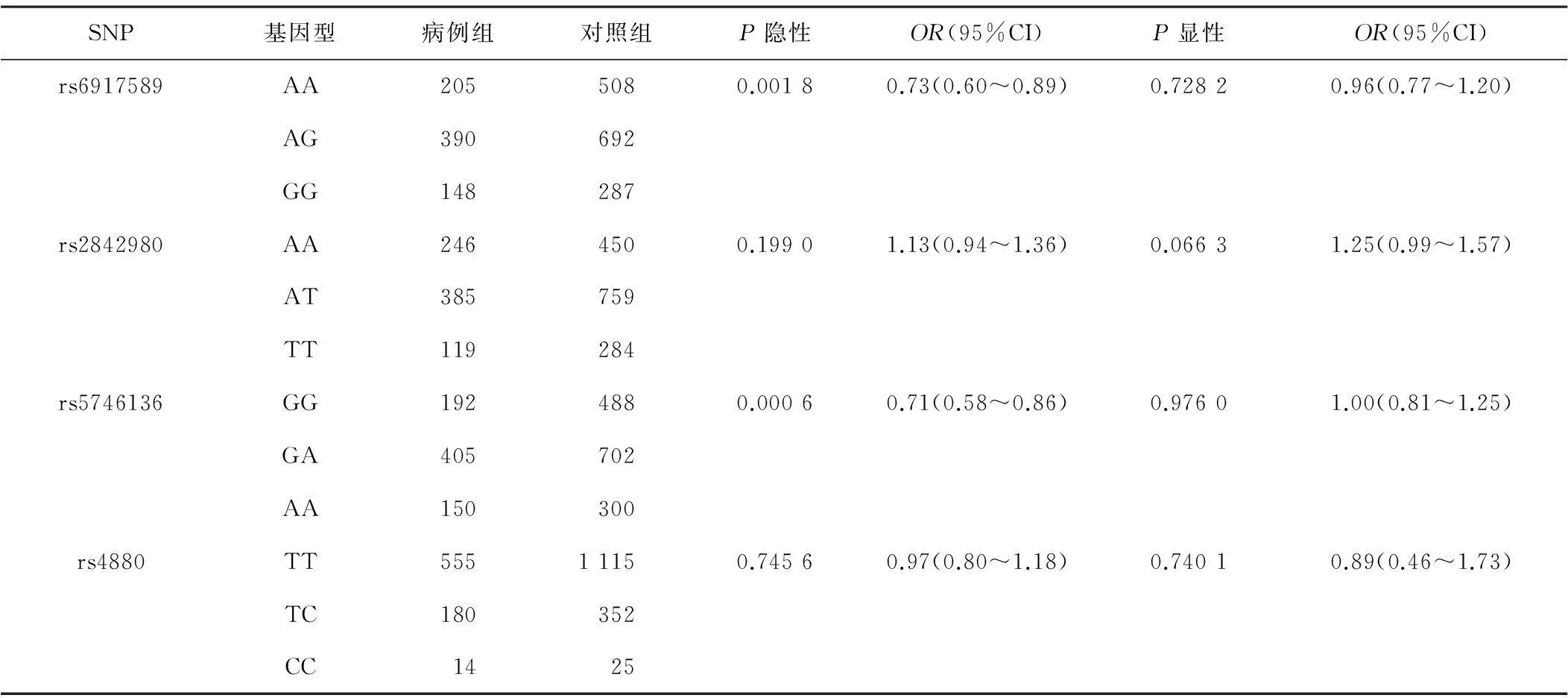
表2 隐性和显性遗传模式下4个SOD2基因上SNP和POAG相关性分析
2.2连锁不平衡和单倍体相关性分析经Haploview软件进行分析,SNP之间两两配对连锁不平衡显示rs6917589和rs5746136有很强的连锁不平衡性(D’=0.98,r2=0.94),其他的SNP之间连锁度不高。见图1。

图1 SOD2中4个SNP位点的连锁不平衡关系
4个SNP产生的单体型ATGT是POAG的风险单倍体,与POAG有关联,P值为0.003 2。然而,其他单体型与POAG没有明显的关联。
3讨论
SOD2基因和POAG之间的相关性研究目前较新,除了欧洲和沙特外[22,19],目前中国人群的相关性研究还很少。在本研究中,我们根据文献报道[23],研究了4个SOD2基因与POAG患者相关的SNP。本研究结果显示,在我们所研究的对象中,rs6917589和rs5746136等位基因频率与POAG有轻微的相关性。P值分别为0.023和0.026。rs6917589和rs5746136与隐性遗传模式的POAG有显著性相关性,P值为0.001 8和0.000 6。这4个SNP所组成的单体型ATGT也与POAG的发生有相关性趋势(P=0.003 2)。这些结果表明,SOD2基因的多态性可能是导致青光眼的发病机理。同时,rs4880与POAG之间没有非常明显的关联性也与以前的文献报道一致[19,22]。
人类SOD2基因位于6号染色体q25.3,编码的SOD2蛋白属于铁/锰超氧化物歧化酶家族。它编码一个线粒体蛋白质形成同源四聚体,并且每个亚基结合一个锰离子。SOD2蛋白结合的氧化磷酸化过程中的生成的超氧化物,并将它们转换成过氧化氢和2价氧分子。据报道,SOD2主要在线粒体中清除活性氧(ROS),防止氧化应激反应。由于人类的眼睛对氧化应激特别敏感,过度光照、紫外线辐射和环境污染都会导致活性氧的生成失控,抗氧化机理失败,ROS就可引起眼组织脂质、蛋白质和核酸损伤。迄今为止,氧化应激是青光眼的病因之一[24-25,13],青光眼患者房水SOD2基因的表达增加[26,11]。此外已证明在POAG患者中,主要的抗氧化酶包括SOD2活性有所改变[27,14]。但是,迄今为止POAG患者为防止氧化应激反应导致SOD2活性下降的原因还未确定,也不清楚SOD2基因的SNP突变与类型相关联。尽管已有一些SOD2基因多态性与POAG等多种疾病的风险相关性研究报告,由于研究对象种族的不同,SOD2多态性的基因型分布与疾病的风险相关性可能不同。此外,SOD2基因的多态性导致青光眼易感的确切机理还不清楚。直到现在,我们所知,除了3个先前的研究外,还没有更多的有关SOD2多态性和青光眼发生风险的研究报道[19,22-23]。
在一项爱沙尼亚人群中的SOD2基因多态性与青光眼的病例-对照相关性研究中,共有病例239例,对照185例研究。研究发现SNP rs2842980与青光眼发生有显著相关性而其他5个SNP(包括rs6917589、rs5746136和rs4880)等位基因频率没有显著差异。此外,另一个由226例开角型青光眼、139例原发性闭角型青光眼(PACG)患者和403例正常对照组成沙特阿拉伯人群的研究也证明了SNP rs4880和POAG及PACG无显著相关性[28,22]。2015年,Zhou等[23]进行了中国人群中416例病例和997例正常对照的SOD2与POAG相关性研究,我们的结果与之接近,但是在隐性遗传模式下,Zhou等研究结果表明rs6917589与POAG相关性不明显,而我们的结果显示rs6917589在与隐性模型的POAG存在关联性,这可能与我们的样本数增加有关系。
通过关联分析,我们的研究印证了SOD2基因和POAG存在一定的相关性。POAG和正常对照中,s6917589和rs5746136的等位基因分布频率差异较大。SNP rs5746136与隐性遗传模式POAG有显著联系(P=0.003 155)。然而,为了避免多重检验造成的误差我们经过Bonferroni校正后,rs6917589和rs5746136在青光眼和对照组之间无显著性差异(P> 0.012 5)。连锁不平衡(LD)分析表明,这2个SNP高度连锁,这与国际人类基因组单体型图计划项目中国人群的SNP数据库结果相同。在本项研究中,rs2842980和rs4880未发现与POAG相关性。但rs2842980与爱沙尼亚人群的青光眼发生有显著相关(P=0.03)[19]。对照我们和以前的结果来看,SOD2多态性与POAG的关系还是有所不同。这可能是由于人群不同,SNP等位基因频率有所差异。因此,相关性研究还需要进一步在不同群体间增加样本量。为了确定SOD2突变可能对青光眼的风险,我们进行了单体型分析。研究结果表明,ATGT这种单体型与POAG的发生有关联(P=0.003 2)。因此,为了避免漏掉真正POAG易感基因,SOD2在青光眼的发病机理中所起的作用需要进行更多的动物模型和人类遗传流行病学研究。
综上所述,我们的研究结果证明, SOD2多态性可能在原发性开角型青光眼发病机理中发挥重要作用。我们将在今后的研究中增加研究样本并从SOD2基因的功能方面研究其多态性导致POAG的原因。
参考文献:
[1]QUIGLEY H A, BROMAN A T. The number of People with glaucoma worldwide in 2010 and 2020[J]. British Journal of Ophthalmology, 2006, 90(3): 262-267.
[2]SHARTS-HOPKO N C. Glynn-Milley C.primary open-angle glaucoma[J]. Am J Nurs, 2009, 109(2): 40-47.
[3]BRON A, CHAINE G, VILLAIN M, et al. Risk factors for primary open-angle glaucoma[J]. J Fr Ophtalmol, 2008, 31(4): 435-444.
[4]BERGEN A A, LESCHOT N J, HULSMAN C A, et al. From gene to disease; primary open-angle glaucoma and three known genes: MYOC, CYP1B1 and OPTN[J]. Ned Tijdschr Geneeskd, 2004, 148(27): 1343-1344.
[5]PASUTTO F, MARDIN C Y, MICHELS-RAUTENSTRAUSS K, et al. Profiling of WDR36 missense variants in German patients with glaucoma[J]. Invest Ophthalmol Vis Sci, 2008, 49(1): 270-274.
[6]TAKAMOTO M, ARAIE M. Genetics of primary open angle glaucoma[J]. Jpn J Ophthalmol, 2014, 58(1): 1-15.
[7]THORLEIFSSON G, WALTERS G B, HEWITT A W, et al. Common variants near CAV1 and CAV2 are associated with primary open-angle glaucoma[J]. Nat Genet, 2010, 42(10): 906-909.
[8]BURDON K P, MACGREGOR S, HEWITT A W, et al. Genome-wide association study identifies susceptibility loci for open angle glaucoma at TMCO1 and CDKN2B-AS1[J]. Nat Genet, 2011, 43(6): 574-578.
[9]KWON Y H, FINGERT J H, KUEHN M H, et al. Primary open-angle glaucoma[J]. N Engl J Med, 2009, 360(11): 1113-1124.
[10]FERREIRA S M, LERNER S F, BRUNZINI R, et al. Time course changes of oxidative stress markers in a rat experimental glaucoma model[J]. Invest Ophthalmol Vis Sci, 2010, 51(9): 4635-4640.
[11]FERREIRA S M, LERNER S F, BRUNZINI R, et al. Oxidative stress markers in aqueous humor of glaucoma patients[J]. Am J Ophthalmol, 2004, 137(1): 62-69.
[12]ASLAN M, CORT A, YUCEL I. Oxidative and nitrative stress markers in glaucoma[J]. Free Radic Biol Med, 2008, 45(4): 367-376.
[13]KOLIAKOS G G, BEFANI C D, MIKROPOULOS D, et al. Prooxidant-antioxidant balance, peroxide and catalase activity in the aqueous humour and serum of patients with exfoliation syndrome or exfoliative glaucoma[J]. Graefes Archive for Clinical and Experimental Ophthalmology, 2008, 246(10): 1477-1483.
[14]GHANEM A A, ARAFA L F, EL-BAZ A. Oxidative stress markers in patients with primary open-angle glaucoma[J]. Curr Eye Res, 2010, 35(4): 295-301.
[15]ABU-AMERO K K, KONDKAR A A, MOUSA A, et al. Decreased total antioxidants in patients with primary open angle glaucoma[J]. Curr Eye Res, 2013, 38(9): 959-964.
[16]ABU-AMERO K K, AZAD T A, MOUSA A, et al. Total antioxidant level is correlated with intra-ocular pressure in patients with primary angle closure glaucoma[J]. BMC Res Notes, 2014, 7: 163.
[17]BAGNIS A, IZZOTTI A, CENTOFANTI M, et al. Aqueous humor oxidative stress proteomic levels in primary open angle glaucoma[J]. Exp Eye Res, 2012, 103: 55-62.
[18]ENGIN K N, YEMICI B, YIIT U, et al. Variability of serum oxidative stress biomarkers relative to biochemical data and clinical parameters of glaucoma patients[J]. Mol Vis, 2010, 16: 1260-1271.
[19]CELOJEVIC D, NILSSON S, KALABOUKHOVA L, et al. Genetic variation of superoxide dismutases in patients with primary open-angle glaucoma[J]. Ophthalmic Genet, 2014, 35(2): 79-84.
[20]GABRIEL S B, SCHAFFNER S F, NGUYEN H, et al. The structure of haplotype blocks in the human genome[J]. Science, 2002, 296(5576): 2225-2229.
[21]BARRETT J C, FRY B, MALLER J, et al. Haploview: analysis and visualization of LD and haplotype maps[J]. Bioinformatics, 2005, 21(2): 263-265.
[22]ABU-AMERO K K, KONDKAR A A, MOUSA A, et al. Association of Mn-SOD mutation (c.47T>C) with various POAG clinical indices[J]. Ophthalmic Genet, 2014, 35(2): 85-90.
[23]ZHOU Yu, SHUAI Ping, LI Xiulan, et al. Association of SOD2 polymorphisms with primary open angle glaucoma in a Chinese population[J]. Ophthalmic Genet, 2015, 36(1): 43-49.
[24]IZZOTTI A, BAGNIS A, SACCS C. The role of oxidative stress in glaucoma[J]. Mutation research. Reviews in mutation research, 2006, 612(2): 105-114.
[25]IZZOTTI A, SACCS C, CARTIGLIA C, et al. Oxidative deoxyribonucleic acid damage in the eyes of glaucoma patients[J]. Am J Med, 2003, 114(8): 638-646.
[26]ZANON-MORENO V, MARCO-VENTURA P, LLEO-PEREZ A, et al. Oxidative stress in primary open-angle glaucoma[J]. J Glaucoma, 2008, 17(4): 263-268.
[27]MAJSTEREK I, MALINOWSKA K, STANCZYK M, et al. Evaluation of oxidative stress markers in pathogenesis of primary open-angle glaucoma[J]. Exp Mol Pathol, 2011, 90(2): 231-237.
[28]ABU-AMERO K K, AZAD T A, MOUSA A, et al. Association of SOD2 mutation (c.47T > C) with various primary angle closure glaucoma clinical indices[J]. Ophthalmic Genet, 2015, 36(2): 180-183.
Correlation Analysis of SOD2 and Primary Open Angle Glaucoma
LIU Xiangqin
(Institute of Laboratory Medicine,Sichuan Academy of Medical Sciences and Sichuan People’s Hospital,Sichuan Chengdu610072,China)
[Abstract]Objective:To investigate SOD2 variants whether playing a important role in POAG.Methods:This study included 750 POAG patients and 1 500 control subjects.Four SOD2 tag single nucleotide polymorphisms(SNPs): rs6917589,rs2842980,rs5746136 and rs4880 were gottengenetic typing by SNaPshot method in POAG.The genotype and allele frequencies were evaluated with χ2 tests.Results:Allelic correlation analysis showed that there were the statisticaldifferences in the allelic distributions between POAG cases and controls in rs6917589 and rs5746136(P=0.023 and P=0.026, respectively); The allele and genotype frequency in SNPs rs2842980 and rs4880 showed no statistically significant difference between POAG cases and controls(P=0.064 and P=0.703,respectively). Haplotype ATGT generated from the four SNPs had a trend of association with POAG (P=0.003 2).Conclusion:SOD2 is relevant to POAG and may play a important role in the development of POAG.
[Keywords]SOD2;POAG;SNPs
(收稿日期:2016-02-23)
[中图分类号]R775.2
[文献标识码]A
DOI:10.11851/j.issn.1673-1557.2016.02.008
优先数字出版地址:http://www.cnki.net/kcms/detail/51.1688.R.20160315.1416.004.html
E-mail:liuxiaoqi76@163.com
