熵最小算法解析中药挥发油GC-MS谱中同分异构体的研究
2016-04-13杜芳黎张华俊
杜芳黎,卢 波,张华俊,2*
(1.广西科学院 非粮生物质酶解国家重点实验室 国家非粮生物质能源工程技术研究中心 广西生物炼制重点实验室,广西 南宁 530007;2.苏州云溪分析技术有限公司,江苏 苏州 215123)
熵最小算法解析中药挥发油GC-MS谱中同分异构体的研究
杜芳黎1,卢 波1,张华俊1,2*
(1.广西科学院 非粮生物质酶解国家重点实验室 国家非粮生物质能源工程技术研究中心 广西生物炼制重点实验室,广西 南宁 530007;2.苏州云溪分析技术有限公司,江苏 苏州 215123)
采用以熵最小算法为基本原理的化学计量学方法,结合气相色谱-质谱联用分析法,对玫瑰精油及茉莉花挥发油中的2对同分异构体重叠峰进行重建分析,并分别得到各组分的重建质谱,同时采用NIST数据库相似度检索、质谱碎片信息比对及程序升温指数对分析得到的各组分进行定性分析。通过分析,分别从玫瑰精油和茉莉花挥发油的GC-MS重叠峰中分离得到1对同分异构体。分析结果显示,采用熵最小算法可以成功地对重叠峰中的各组分进行定性分析。该研究为类似同分异构体混合物中各组分的测定提供了参考。
化学计量学;重叠信号;同分异构体;熵最小算法
挥发油是中药材的一类重要成分,是由烃类、萜类、脂肪族和芳香族化合物等组成的复杂体系,具有丰富的生物活性[1-5]。中国药典将挥发油作为中药质量控制研究的重要指标,挥发油的成分及含量直接影响中药材的品质和疗效,因此对挥发油进行分析研究具有十分重要的意义。中药挥发油通常采用气相色谱-质谱联用(GC-MS)技术进行分析[6],但在挥发油体系中,存在大量同分异构体,其分子量相同,结构相似,极性相当,质谱图相似度也较高,通过谱库检索并不能给出化合物的准确信息。但同分异构体的药理活性并不完全相同,需对其加以区分。
目前对同分异构体的分析方法可归纳为两种[7]:一种是借助于现代分析仪器(高效液相色谱、气相色谱-质谱联用、逆流液相色谱仪、毛细管电泳法等)实现完全分离[8-10],在实际使用过程中,现代仪器实现的分离,虽然效果客观,但因工作量大,耗时久,且需优化实验条件及参数,从而导致资金投入相对增加。随着计算技术和色谱仪自动化程度的提高,第二种分析方法即数学方法(包括信息理论、多元统计分析法、数学最优法等)正被大量地应用于分析化学中,这同时也为同分异构体的分离提供了方便可行的方法,借助于数学方法实现同分异构体的分离,被越来越多的研究者所关注。
熵最小算法作为一种数学运算方法,最早被应用于分辨MS[11],IR[12]和UV-Vis[13]重叠光谱中所包含的纯组分,并取得显著效果。后来逐渐发展到分析GC-MS重叠谱中的纯组分[14-15],但对于采用熵最小算法分析同分异构体的研究却相对空白。本文采用熵最小算法对玫瑰精油和茉莉花挥发油GC-MS谱中的同分异构体重叠峰进行分离分析,并结合程序升温保留指数对分离得到的两对异构体进行定性,该法可对一次实验结果直接进行分析。通过对该方法的研究,探讨了数学运算方法对同分异构体重叠信号的解析能力,并为今后同分异构体的分离检测提供了参考。
1 实验部分
1.1 仪器与材料
安捷伦7820A-5977E质谱联用仪及自带的NIST标准质谱库;HP-5MS(30 m×0.25 mm×0.25 um)毛细管柱;新鲜采摘的玫瑰花、茉莉花。
1.2 实验方法
1.2.1 挥发油提取 分别称取玫瑰花及茉莉花85 g置于1 000 mL圆底烧瓶中,加水至800 mL,参照《中国药典》2010版挥发油提取法对挥发油进行提取。
1.2.2 色谱条件 进样器温度:260 ℃,柱温:初始温度40 ℃,保持1 min,以5 ℃/min升至280 ℃,保持10 min。辅助加热器:250 ℃。载气:氮气,流量1 mL/min,分流比100∶1,进样量0.2 μL。
MS:电子能量:70 eV;采集模式:全扫描;扫描范围50~250 Da;离子源温度230 ℃;四极杆温度150 ℃。
1.2.3 数据处理及方法原理 所有的数据处理均在MATLAB软件下进行。
熵最小算法的基本原理为:某样品经过GC-MS分析,得到该样品的质谱分析数据,对其中某一共流出峰区间进行数据分析,导出该区间的数据。
①对于该共流出峰的区间,其数字信息经采集后得到一组数据Ak×υ,对GC-MS联用仪而言,k是在不同保留时间的采样点的数目,υ是在不同荷质比(m/z)的采样点的数目。
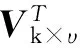
(1)
⑤算法将首先生成1个随机向量T1×j。通过方程(2)得到1个与纯谱有关的向量aest。aest将根据T的变化而变化,直至优化方程结束,最后得到的aest即为目标纯谱。其中,BTEM不使用S,而tBTEM使用S。
(2)
⑥将aest用锁定的峰或区间中的最高峰,用方程(3)将aest单位化。式中a′和a″是锁定的峰和区间。这一步为锁峰,其中BTEM只锁住1个峰,而tBTEM锁住2个峰。
(3)
(4)
(5)
⑧检测目标函数的值,如果达到优化终点,则输出纯谱aest和重建Ck×1。其中,aest为重建纯谱,Ck×1为重建的伪浓度。如果未达到优化终点,将由优化方法重新生成1个T1×j,返回到步骤⑤~⑧重新计算,直至优化结束。
⑨BTEM和tBTEM方法每次计算,会得到1个重建纯谱。对不同的峰进行锁峰计算,有时会得到相同的重建纯谱,将混合物中的主要成分均重建出来后,通过对这些重建纯谱和原始数据进行计算[16],得到各个重建纯谱相对应的重建浓度(方程6),式中,n是混合物中的主要成分数。
(6)
将重建纯谱的质谱数据和NIST数据库进行比对分析,得到该重建纯谱所代表的物质的结构信息等。
从以上熵最小算法可以看出,与常用的化学计量法不同,熵最小算法无任何峰形拟合和组分数的猜测等,仅凭借数据本身,发现共流出峰中的“未知组分”。
2 结果与讨论
2.1 玫瑰精油挥发油中同分异构体的解析
对玫瑰精油的GC-MS数据进行分析时,发现了如图1a所示的重叠色谱峰,其丰度仅为整个样品谱图最高丰度的6%左右,从峰形来看,在保留时间为1 443~1 447 s间的谱图部分明显包埋,若在该区域不同的位置采样,出现的碎片信息并无明显差异,仅仅是丰度不同(如图2所示),因此初步判断这可能是一个包含同分异构体的重叠峰,采用熵最小算法进行解析。
首先,利用Matlab程序导出重叠色谱峰的二维质谱数据,共有27个在不同保留时间的采样点,每个质谱的采样范围为50~250 Da,采样间隔为1Da,数据通道201个,以此得到矩阵A27×201(步骤2),通过观察不同的VT,提取其中不同的质谱碎片峰信息分别进行锁峰计算(步骤③)。
通过对质谱碎片峰m/z107和119,以及m/z109和204的锁峰运算,得到3个不同的重建纯谱,其次经过步骤⑨的运算,得到每个组分的重建浓度,结果如图1所示。其中曲线e为背景线,无法做NIST比对,因很多背景成分有烷烃基团,其质谱碎片在较小的m/z范围内和峰中的主要成分会有相同的质谱碎片,导致其中的浓度计算偏离实际,浓度曲线呈小的凸起峰。将解析得到的纯组分的信号加和后的解析结果总离子流浓度(曲线b),与实验得出的总离子流浓度(曲线a)相比,可以发现解析出的信号总强度与实验得出的信号无明显差异。组分2的峰形(曲线d)失真,为不对称峰形,与理论有偏差,其原因在于共流出峰中,各同分异构体相同m/z的碎片很多(见图3),从而导致计算共流出峰中所包含的各个同分异构体的浓度面临一定的困难。对于这种体系,熵最小算法有一定的难度,所以重建浓度的峰形会与理想峰形有一定差距;但根据经验,在熵最小算法的应用中,重建浓度和理想峰形的偏差,正是判断是否有同分异构体的一个佐证。
当重叠色谱峰中所包含的每一个组分的纯色谱曲线和质谱均被解析出来后,可使用NIST标准库进行相似度检索,以对各组分进行定性分析,检索结果见表1。

表1 解析得到组分的信息Table 1 The information of resolved components
从表1可以看出,通过熵最小算法,可以成功地从重叠色谱峰中分离出1对同分异构体α-法呢烯(α-Farnesene)和β-甜没药烯(β-Bisabolene)。为了判别解析结果的准确性,用解析后得到的纯质谱与NIST质谱库中存在的质谱信息进行了比较,结果如图3所示(图中平衡线上部分的碎片信息表示解析得到的碎片信息,下部分表示NIST数据库中存在的碎片信息),从图3可以发现,解析后得到的质谱与NIST质谱库中存在的质谱碎片信息(碎片位置和丰度比例)基本吻合,由此可以判断熵最小算法解析后的结果较准确。此外,解析得到的两个同分异构体的质谱碎片峰大部分重合,例如m/z=69,79,93,109等。通过锁峰运算,熵最小方法能够在这样的体系上分辨出两个同分异构体,说明其在运算过程中的精准性。
2.2 茉莉花挥发油中同分异构体的解析
同样,对茉莉花挥发油中保留时间为516~522 s的1组同分异构体重叠色谱峰(图4曲线f)进行解析。选择熵最小算法中的tBTEM锁峰运算,提取各组分中不同丰度的碎片离子或只存在于某一组分中的特征碎片离子进行锁峰,对其二维数据进行解析。
在导出重叠色谱峰的二维质谱数据时,共有18个在不同保留时间的采样点,每个质谱的采样范围为50~250 Da,采样间隔为1Da,数据通道201个,得到矩阵A18×201(步骤②),通过观察不同的VT,提取其中不同的质谱碎片信息峰分别进行锁峰计算(步骤③),结果如图4所示。
从图4可以看出,经过熵最小算法解析后,共得到3个重建浓度,根据步骤⑨分析可以得出,曲线j为背景线。曲线h代表的谱峰对称性好,而曲线k代表的色谱峰相对较扁平,两个色谱峰的峰宽时间跨度接近5 s与同一实验谱图中丰度相近的纯色谱峰的峰宽一致,间接说明了解析结果的准确性。提取解析得到两个组分(组分3和4)的纯质谱数据并进行NIST数据库相似度检索,发现两组分分别为 顺式氧化芳樟醇(cis-Linaloloxide)和顺式-α,α-5-三甲基-5-乙烯基四氢化呋喃-2-甲醇(cis-α,α-5-Trimethyl-5-ethenyltetraphydrofuran-2-methanol)同分异构体,具体信息见表2。
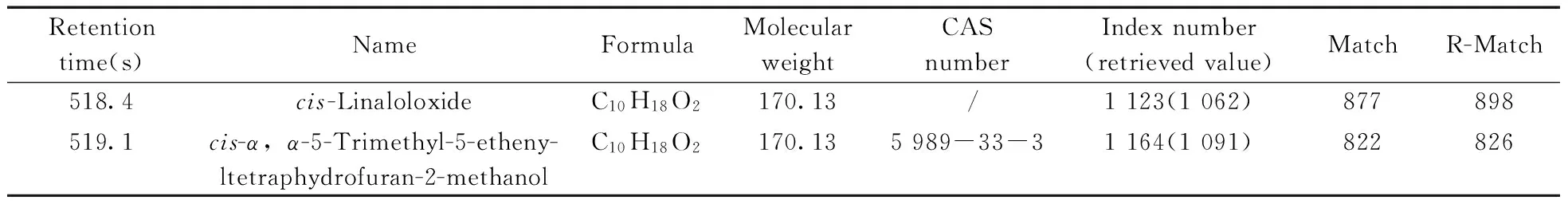
表2 解析得到纯组分的信息Table 2 The information of resolved components
通过两个纯组分的保留指数可判断先流出的化合物为顺式氧化芳樟醇,后流出的化合物为顺式-α,α-5-三甲基-5-乙烯基四氢化呋喃-2-甲醇。
3 结 论
关于同分异构体重叠信号的解析一直是分析化学领域具有挑战性的研究,目前已报道了大量的化学计量学方法来解析同分异构体重叠信号[17-19],但在实际运算过程中均存在一定的问题。本文提出用熵最小算法对GC-MS重叠信号进行解析,弥补了其他化学计量法的一些不足。经解析后,从玫瑰精油中分离得到1组同分异构体α-法呢烯和β-甜没药烯从茉莉花挥发油中得到1组同分异构体顺式氧化芳樟醇和顺式-α,α-5-三甲基-5-乙烯基四氢化呋喃-2-甲醇。分析结果表明,熵最小算法可以准确地鉴别出同分异构体间的微小质谱差异,提高定性的准确度。熵最小算法作为一种数学运算方法,仅从重叠信号数据本身出发,即能将未知组分的纯谱从重叠信号中重建出来,无需猜测组分数目,无需优化色谱实验条件,无需做任何模拟(如各组分浓度峰的峰形等),避免花费大量时间,并能较好地解析组分数较多的重叠色谱峰,因此其应用前景广阔。
[1] Martuccia J F,Gende L B,Neira L M,Ruseckaite R A.Ind.Crop.Prod.,2015,71:205-213.
[2] Cui S Q,Wang J,Yang L C,Wu J F,Wang X L.J.Pharm.Biomed.,2015,102:64-77.
[3] Qi Y P,Qu L P,Wu Y T,Fan G R.J.Ethnopharmacol.,2011,137:487-494.
[4] Peng C,Xie X F,Wang L,Guo L,Hu T L.Phytomedicine,2009,16:25-34.
[5] Arrigoni-Blank M F,Antoniolli A R,Caetano L C,Campos D A,Blank A F,Alves P B.Phytomedicine,2008,15:334-339.
[6] Liang Y Z,Xu Q S.InstrumentalAnalysisofComplexSystems.Beijing:Chemical Industry Press(梁逸曾,许青松.复杂体系仪器分析.北京:化学工业出版社),2012:267-268.
[7] Fang H W.SimultaneousDeterminationButeneDiacidandTolualdehydeIsomersbyChemomtricsMethods-UitravioletSpectrophotometry.Taiyuan:Taiyuan University of Technology(方慧文.化学计量学用于紫外分光光度法同时测定丁烯二酸和甲基苯甲醛同分异构体的研究.太原:太原理工大学),2008.
[8] Zhou L L,Wu Y,Johnson B D.J.Chromatogr.A,2000,866(2):281-292.
[9] Cécile A,Ben A,Anwar G.J.Pharm.Biomed.,2014,100:254-261.
[10] Sekar R,Kailasa S K,Li W S,Wu H C.Chin.Chem.Lett.,2013,24(9):833-836.
[11] Zhang H J,Garland M,Zeng Y Z,Wu P.J.Am.Soc.MassSpectrom.,2003,14:1295-1305.
[12] Zhang H J,Chew W,Garland M.Appl.Spectrosc.,2007,61(12):1366-1372.
[13] Gao F,Zhang H J,Guo L F,Garland M.Chemom.Intell.Lab.,2009,95:94-100.
[14] Zhang H J,Ji X W,Lu B,Sun L,Gu X Y,Su Y X.Comput.Appl.Chem.(张华俊,冀晓雯,卢波,孙靓,谷筱玉,苏翼雄.计算机与应用化学),2015,32(2):223-225.
[15] Lin G C,Zhang H J,Long H R,Ji X W,Lu B,Gu X Y.J.Chin.Spectrom.Soc.(林光川,张华俊,龙海荣,冀晓雯,卢波,谷筱玉.质谱学报),2015,36(5):448-453.
[16] Zeng Y Z,Garland M.Anal.Chim.Acta,1998,359:303-310.
[17] Wu Z Y,Zeng Z D,Marriott P J.J.Chromatogr.A,2010,1217(49):7759-7766.
[18] Manne R,Shen H L,Liang Y Z.Chemom.Intell.Lab.,1999,43:171.
[19] Shao X G,Liu Z C,Cai W S.Chin.J.Chromatogr.(邵学广,刘智超,蔡文生.色谱),2009,27(5):648-654.
Analysis of Isomers on Volatile Oil GC-MS Mixture Spectra for Traditional Chinese Medicine Using Entropy Minimization Algorithms
DU Fang-li1,LU Bo1,ZHANG Hua-jun1,2*
(1.Guangxi Key Laboratory of Biorefinery,National Engineering Research Center for Non-Food Biorefinery, State Key Laboratory of Non-Food Biomass Enzyme Technology,Guangxi Academy of Sciences,Nanning 530007,China;2.Suzhou Chemopower Technology Co.Ltd.,Suzhou 215123,China)
In this work,entropy minimization algorithms was used to deal with two GC-MS co-eluted peaks got from rose andArabianjasmineessential oils,and the pure spectra of components inside co-eluted peaks were obtained.Identification of those reconstructed components was done by NIST library matching,retention index comparison and MS fragments analyses.Two isomers’ pure spectra were found from each co-eluted peak from rose essential oil andArabianjasmineessential oil.The results showed that the unknown isomers were successfully identified from the mixture spectra using the entropy minimization algorithm,and the study is very helpful for analyzing isomers in different mixtures.
chemometrics;co-eluted peaks;isomers;entropy minimization algorithms
2016-03-25;
2016-04-20
广西科学研究与计划开发项目(桂科合15104001-5)
10.3969/j.issn.1004-4957.2016.11.019
O657.63;TQ460.72
A
1004-4957(2016)11-1476-05
*通讯作者:张华俊,博士,研究员,研究方向:GC-MS与LC-MS快速检测分离,Tel:0512-58735993,E-mail:George@ChemoPower.com
