赤点石斑鱼促性腺激素及其受体基因的克隆和表达模式分析
2016-04-12洪万树陈仕玺张其永
陈 原,洪万树,陈仕玺,王 琼,张其永
(厦门大学海洋与地球学院,福建厦门361102)
赤点石斑鱼促性腺激素及其受体基因的克隆和表达模式分析
陈原,洪万树*,陈仕玺,王琼,张其永
(厦门大学海洋与地球学院,福建厦门361102)
摘要:鱼类脑垂体分泌的促性腺激素( GtHs)与分布在性腺中的促性腺激素受体( GtHRs)所形成的信号通路,在性腺发育过程中发挥了重要作用.为了解GtH/GtHR信号通路在雌性先熟雌雄同体鱼类性腺发育过程中的作用,本文克隆了赤点石斑鱼( Epinephelus akaara) GtHsβ亚基( FSHβ和LHβ)及其受体GtHRs( Fshr和Lhcgr)基因的序列,并分析了它们在性腺发育过程中的表达模式.结果表明: FSHβ和LHβ具有糖蛋白激素家族成员保守的结构特征; Fshr和Lhcgr具有糖蛋白激素受体亚家族保守的结构特征; FSHβ和LHβ基因仅在脑垂体表达,而Fshr和Lhcgr基因仅在性腺表达;在性逆转早期( ET)阶段FSHβ表达量处于低水平,但在性逆转后期( LT)阶段和雄性阶段表达量升高; LHβ的表达模式与FSHβ相似,但从ET阶段到LT阶段,与FSHβ相比其表达量的升高幅度较低;性腺中Fshr和Lhcgr在雌性和ET阶段表达量都很低,LT阶段明显上升,雄性阶段达到最高水平,但Fshr表达量远远高于Lhcgr.研究结果提示,GtH/GtHR通路参与了赤点石斑鱼的性腺发育过程,其中FSH信号通路在这过程中可能发挥更主要的作用.
关键词:赤点石斑鱼;促性腺激素基因;促性腺激素受体基因;克隆;表达;性腺发育
性逆转是一种有趣的生物学现象,存在于硬骨鱼的一些种类中,包括雌性先熟的雌雄同体鱼类和雄性先熟的雌雄同体鱼类[1].血清类固醇性激素17β-雌二醇( E2)和雄性激素是调控鱼类性逆转的关键因子[2-3].与其他脊椎动物一样,在鱼类中调控类固醇性激素的合成和分泌主要是脑垂体产生的促性腺激素( GtHs),包括促滤泡激素( FSH)和促黄体激素( LH).FSH和LH都是糖蛋白激素家族成员,该家族由相同的α亚基和各激素特异的β亚基构成[4].目前,已在14个目的56种鱼类中克隆得到了GtHs基因的序列.鱼类FSH主要在性腺发育的早期阶段发挥作用,促进性腺分泌E2和睾酮( T)等类固醇性激素,调节性腺发育和配子形成;而LH促进性腺分泌17α,20β-双羟孕酮( DHP),对配子的最后成熟和产卵行为起作用[5-6].
FSH和LH在性腺中与各自相应的促性腺激素受体( GtHRs)结合调控类固醇性激素生成和配子形成.促滤泡激素受体( Fshr)和促黄体激素受体( Lhcgr)属于糖蛋白激素受体亚家族,在脊椎动物中具有保守的结构特征,包括1个大的胞外区、7个跨膜区和1个羧基端胞内区[7].在大西洋鲑鱼( Salmo salar)[8]、尖齿胡鲶( Clariasga riepinus)[9]、斑马鱼( Danio rerio)[10]、日本鳗鲡( Anguilla japonica)[11]、黑鲷( Acanthopagrus schlegeli)[12]、冲绳磨塘鳢( Trimma okinawae)[13]、牙汉鱼( Odontesthes bonariensis)[14]以及斜带石斑鱼( Epinephelus coioides)[15]等不同种类的鱼类中都已克隆到2种GtHRs基因序列.在鱼类中,Fshr主要在雌鱼的鞘膜细胞和颗粒细胞以及雄鱼的Sertoli细胞中表达;而Lhcgr主要在雌鱼的颗粒细胞和雄鱼的莱氏细胞中表达[16-17].但也有研究发现,日本鳗鲡和尖齿胡鲶的莱氏细胞中也有Fshr表达[18-19].上述表达模式表明2种糖蛋白激素在调控性腺发育中起重要作用.冲绳磨塘鳢性腺中同时存在精巢和卵巢,在相对个体大小引起的性逆转过程中,首先发生GtHRs基因表达的变化[13].雌性先熟的蜂巢石斑鱼( Epinephelus merra)在自然条件下由雌性向雄性逆转过程中,Fshr表达量升高[20].在甲基睾酮( MT)诱导的斜带石斑鱼性逆转过程中,LHβ和Lhcgr表达量升高[15].这些结果都表明GtH/ GtHR通路参与了性逆转过程.但在不同石斑鱼种类之间、自然性逆转和人工诱导性逆转过程中,促性腺激素及其受体基因表达模式并不一致,因此开展赤点石斑鱼( Epinephelus akaara)促性腺激素及其受体基因表达模式的研究,能更深入地了解GtH/GtHR通路在鱼类性逆转过程中的作用.
赤点石斑鱼属于雌性先熟的雌雄同体鱼类,其性腺发育过程可分为雌性阶段、性逆转阶段和雄性阶段.本研究分别克隆了赤点石斑鱼GtHsβ亚基及其受体GtHRs基因的cDNA序列,研究了自然性腺发育过程中GtHsβ在脑垂体中和GtHRs在性腺中的表达模式,讨论了GtH/GtHR通路在赤点石斑鱼性腺发育过程中的作用.研究结果可为赤点石斑鱼人工繁育提供参考资料.
1材料与方法
1. 1实验鱼及其取样
2012年5月—2013年6月,分批次从福建省漳州市漳浦县养殖场购买自然海区种苗养殖的赤点石斑鱼共36尾.实验鱼1~4龄,用0.01%(质量分数)的间氨基苯甲酸乙酯甲磺酸盐( MS222,Sigma)麻醉,进行生物学测量(体长9.5~30.5 mm,体质量24.1~791.6 g).解剖取性腺称重,计算性腺成熟指数( GSI,GSI = m性腺/m体×100%).取垂体和一部分性腺组织于液氮速冻后-80℃保存,用于基因表达分析研究;另一部分性腺组织于波恩氏固定液,用于性腺发育组织学观察.
1. 2 GtHsβ亚基和GtHRs基因的克隆
取性成熟的赤点石斑鱼脑垂体用于克隆GtHsβ亚基基因的cDNA序列,性腺用于克隆GtHRs基因的cDNA序列.采用RNAzol试剂盒( MRC)提取RNA,cDNA第一链利用反转录试剂盒( Thermo)合成.根据已经发表的鱼类GtHsβ亚基及GtHRs基因序列分别设计简并引物(表1),以cDNA为模板,用Taq酶( TaKaRa)于25 μL反应体系进行PCR扩增.产物经1%(质量分数)琼脂糖凝胶电泳后,用凝胶纯化试剂盒( Qiagen)纯化,再与pMD-19T载体( TaKaRa)连接,转化大肠杆菌( Escherichia coli) DH5α菌体( Promega).阳性克隆委托广州Invitrogen公司测序.
根据已知的中间片段分别设计cDNA 5'末端快速扩增( 5'-RACE)和3'-RACE特异性的外侧引物和内侧引物(表1).参照TaKaRa试剂盒说明书进行两轮PCR扩增.纯化、连接、转化及测序步骤同上.

表1赤点石斑鱼促性腺激素β亚基及其受体基因克隆引物Tab.1 Primers used for cloning GtHsβ andGtHRs genes in E.akaara
中间片段及RACE产物拼接后,靠近5'末端及3'末端设计全序列引物扩增得到GtHsβ亚基及GtHRs基因的cDNA全序列.
1. 3 GtHsβ亚基和GtHRs基因序列分析
使用NCBI网站( http:∥www.ncbi.nlm.nih.gov) BLAST软件进行同源性搜索,使用ExPASy网站( http: ∥www.expasy.ch/tools/dna.html)相关软件进行开放阅读框的搜索和氨基酸序列的推断.氨基酸的序列比对和同源性分析分别使用Megalign软件和ClustalW软件( DNASTAR).
1. 4 GtHsβ亚基和GtHRs基因mRNA的组织分布及性腺发育过程中的表达检测
分别从4尾赤点石斑鱼取头肾、肝、肾、脑、脑垂体、胃、肠、心脏、脾和性腺组织;另取其他不同发育阶段的性腺组织.RNAzol试剂盒提取总RNA,取1.5 μg进行反转录制备cDNA模板.设计荧光定量PCR引物(表2 ),在7500快速荧光定量系统( Applied Biosystems)进行PCR,以2-ΔΔCT法[21]分析结果.

表2赤点石斑鱼促性腺激素β亚基及其受体基因表达分析引物Tab.2 Primers used for expression analyses of GtHsβ and GtHRs genes in E.akaara
1. 5组织学分析
性腺固定于波恩氏液,冰浴过夜,梯度脱水后包埋于石蜡( Leica)中.切片厚度5 μm,苏木精-伊红染色后观察性腺发育过程.
1. 6数据分析
数据以平均值±标准差的形式表示,采用GraphPad Prism 4软件绘制图表.采用one-way ANOVA方法进行差异显著性分析,显著性水平为p<0.05.
2结果
2. 1 GtHsβ亚基和GtHRs基因克隆和序列分析
通过RACE方法获得的FSHβ、LHβ和Fshr基因全长序列以及Lhcgr基因的部分序列( GenBank登陆号分别为KJ534537、KJ534538、KJ534535和KJ534536).
FSHβ的cDNA全长共561 bp,包括开放阅读框363 bp(包括终止密码),5'非编码区110 bp,3'非编码区88 bp,包含poly( A)尾;编码120个氨基酸,包含21个氨基酸的信号肽及12个保守的半胱氨酸残基(图1 ( a) ).LHβ的cDNA全长共582 bp,开放阅读框447 bp(包括终止密码),5'非编码区32 bp,3'非编码区103 bp,包含poly( A)尾;编码148个氨基酸,包含33个氨基酸的信号肽及12个保守的半胱氨酸残基(图1 ( b) ).赤点石斑鱼的FSHβ和LHβ都属于糖蛋白激素,具有保守的半胱氨酸残基.
Fshr的cDNA全长共3 540 bp,开放阅读框2 106 bp(包括终止密码),5'非编码区198 bp,3'非编码区1 236 bp,包含poly( A)尾;编码701个氨基酸,包含20个氨基酸的信号肽,有一个由376个氨基酸构成的大的氨基端胞外区、7个跨膜区和一个由62个氨基酸构成的羧基端胞内区(图1( c) ).Lhcgr的cDNA部分序列1 774 bp,3'非编码区220 bp,包含poly( A)尾;编码517个氨基酸.
同源性分析表明鱼类FSHβ和LHβ氨基酸序列属于两个不同的分支,赤点石斑鱼与蜂巢石斑鱼( E.merra)和黑边石斑鱼( E.fasciatus)的FSHβ和LHβ氨基酸序列有较高同源性(图2).鱼类相应受体氨基酸序列也属于两个不同的分支,赤点石斑鱼与斜带石斑鱼( E.coioides)的Fshr和Lhcgr氨基酸序列有较高同源性(图3).
2. 2 GtHsβ亚基和GtHRs基因mRNA的组织分布
通过荧光定量PCR方法,对赤点石斑鱼GtHsβ亚基和GtHRs基因mRNA在不同组织的表达进行了分析.结果(图4)显示:在所检测的组织中,FSHβ与LHβ仅在脑垂体中表达,其他所检测组织,即头肾、肝、肾、脑、胃、肠、心脏、脾和性腺中均无表达; Fshr和Lhcgr仅在性腺中表达.
2. 3 GtHsβ亚基和GtHRs基因mRNA在性腺发育过程中的表达模式
对每尾赤点石斑鱼的性腺逐一进行组织学观察,根据切面中卵巢和精巢部分所占比例以及两部分中生殖细胞及体细胞的发育状态,将性腺发育分为7个阶段( FⅠ、FⅡ、FⅢ、FⅣ、ET、LT和M),其中FⅠ、FⅡ、FⅢ和FⅣ阶段为雌性阶段,ET和LT阶段为性逆转阶段,M阶段为雄性阶段(表3).
通过荧光定量PCR方法,研究了赤点石斑鱼GtHsβ亚基和GtHRs基因mRNA在性腺发育过程中的表达模式.结果发现垂体中FSHβ在FⅠ阶段表达量较高,随后显著下降; FⅡ至FⅣ阶段,随着性腺中卵巢部分的发育,表达量逐渐上升; ET阶段的表达量显著下降,LT阶段表达量迅速上升(图5( a) ).垂体中LHβ的高表达量出现在FⅣ阶段(雌性成熟阶段)、LT阶段和M阶段(图5( b) ).性腺中的Fshr在FⅠ阶段表达量高,在FⅡ阶段至ET阶段表达量都很低,LT阶段表达量显著上升,M阶段表达量进一步升高并达到最高水平(图5( c) ).性腺中Lhcgr的表达模式与Fshr相似,但表达量远远低于Fshr(图5( d) ).

图1推导的赤点石斑鱼促性腺激素及其受体氨基酸序列Fig.1 Deduced amino acid sequences of GtHsβ and GtHRs in E.akaara
3讨论
在赤点石斑鱼的ET阶段,FSHβ基因的表达量处于低水平,但在LT阶段和M阶段表达量升高,这种表达模式与用MT诱导的斜带石斑鱼( E.coioides)性逆转,以及用芳香化酶抑制剂诱导的褐石斑鱼( E.bruneus)性逆转过程中FSHβ的表达模式相似.投喂MT的斜带石斑鱼,在ET阶段FSHβ表达量被显著抑制,而在M阶段表达量升高到MT处理前水平[15,22].芳香化酶抑制剂诱导的褐石斑鱼性逆转过程中,在ET阶段,卵巢组织退化伴随着血清11-酮基睾酮水平升高,但FSHβ表达量低; LT阶段精子发生过程中FSHβ表达量才显著升高[23].然而在蜂巢石斑鱼( E.merra)的研究中发现,ET阶段FSHβ表达量显著升高;此外,用分离纯化的牛FSH处理雌性蜂巢石斑鱼3周后发生性逆转,并伴随着内源性雄性激素水平和FSHβ表达量的上升[24].这些结果都表明FSH可能参与调控石斑鱼的性逆转,但FSHβ具体的表达模式在不同种类中有差异.此外,本研究观察到赤点石斑鱼性腺中Fshr基因表达量在自然性逆转过程中显著升高,这种表达模式与蜂巢石斑鱼自然性逆转性腺Fshr表达模式相似[20].然而在MT诱导的斜带石斑鱼性逆转过程中,Fshr的表达受抑制[15].从已有的研究结果看,FSH信号通路在不同石斑鱼种类自然性逆转和人工诱导的性逆转之间存在不同的调控机制.
在大多数的雌雄异体鱼类中,LHβ和Lhcgr基因的mRNA在性腺发育后期大量表达,提示其对配子的成熟以及产卵行为有重要作用[16].然而,目前对LH在雌雄同体鱼类性逆转过程中的作用还知之甚少.对雌性先熟的雌雄同体鱼,如杂斑盔鱼( Coris julis)[25]和蓝头濑鱼( Thalassoma bifasciatum)[26]的研究表明,人工注射人绒毛膜促性腺激素( HCG)可以诱导雌性到雄性的性逆转.LH或LH类似物可以诱导雌性先熟的雌雄同体鱼类,如黄鳝( Monopterus albus)提前发生性逆转[27].本文中自然性逆转的赤点石斑鱼在LT阶段和M阶段LHβ和Lhcgr表达量上升,与斜带石斑鱼MT诱导性逆转中的LHβ和Lhcgr表达模式一致,提示在赤点石斑鱼中,LH信号通路可能参与了性逆转的启动和随后的精子发生过程.然而,在芳香化酶抑制剂诱导的褐石斑鱼性逆转过程中,LHβ表达量一直处于低水平[23].蜂巢石斑鱼自然性逆转过程中LHβ表达量也没有显著变化;此外分离纯化的牛LH也不能有效诱导雌性蜂巢石斑鱼发生性逆转[24].在上述两项研究中,仅仅关注了LHβ表达量,而Lhcgr在性逆转过程中的表达模式未见研究报道.
本研究发现,在赤点石斑鱼性腺发育和性逆转过程中FSHβ与LHβ表达量差别不大,但从ET阶段到LT阶段,FSHβ表达量增加了7倍左右,而LHβ表达量仅增加3倍左右.此外,虽然性腺中Fshr与Lhcgr的表达模式相似,但Fshr的表达量远远高于Lhcgr的表达量.综合分析GtHs及其受体基因的表达量及表达模式,可以推测在赤点石斑鱼性腺发育过程中,相对于LH信号通路,FSH及其受体在性逆转过程中可能发挥更重要的作用.
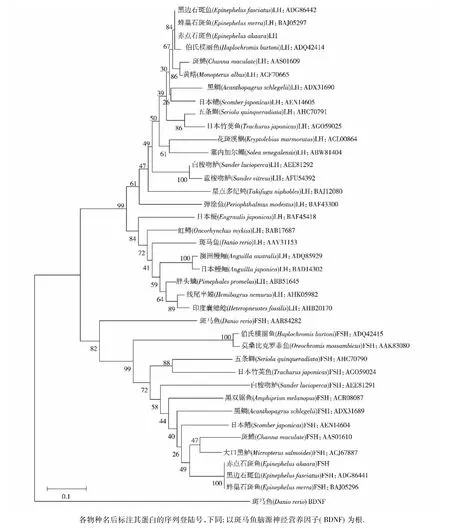
图2赤点石斑鱼和其他鱼类物种间促性腺激素β亚基氨基酸序列同源性分析Fig.2 Phylogenetic analysis of GtHsβ between E.akaara and other species

图3赤点石斑鱼和其他鱼类物种间促性腺激素受体氨基酸序列同源性分析Fig.3 Phylogenetic analysis of GtHRs between E.akaara and other species
参考文献:
[1]DE MITCHESON Y S,LIU M.Functional hermaphroditism in teleosts[J].Fish Fish,2008,9( 1) : 1-43.
[2]NAKAMURA M,BHANDARI R K,HIGA M.The role of estrogens plays in sex differentiation and sex changes of fish [J].Fish Physiol Biochem,2003,28( 1/2/3/4) : 113-117.
[3]WU G C,DU J L,LEE Y H,et al.Current status of genetic and endocrine factors in the sex change of protandrous black porgy,Acanthopagrus schlegeli ( Teleostean)[J].Ann N Y Acad Sci,2005,1040( 1) : 206-214.
[4]PIERCE J G,PARSONS T F.Glycoprotein hormones—structure and function[J].Annu Rev Biochem,1981,50( 4) : 465-495.
[5]PLANAS J V,SWANSON P.Maturation-associated changes in the response of the salmon testis to the steroidogenic actions of gonadotropins ( GTHⅠand GTHⅡ) in vitro[J].Biol Reprod,1995,52( 3) : 697-704.
[6]TYLER C R,POTTINGER T G,COWARD K,et al.Salmonid follicle-stimulating hormone ( GtHⅠ) mediates vitellogenic development of oocytes in the rainbow trout,Oncorhynchus mykiss[J].Biol Reprod,1997,57( 5) : 1238-1244.
[7]VASSART G,PARDO L,COSTAGLIOLA S.A molecular dissection of the glycoprotein hormone receptors[J].Trends Biochem Sci,2004,29( 3) : 119-126.
[8]MAUGARS G,SCHMITZ M.Molecular cloning and charac-terization of FSH and LH receptors in Atlantic salmon ( Salmosalar L.)[J].Gen Comp Endocr,2006,149 ( 1) : 108-117.
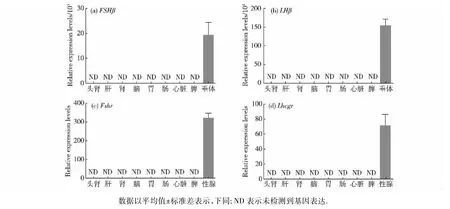
图4赤点石斑鱼促性腺激素β亚基及其受体基因在不同组织的表达Fig.4 Expression of GtHsβ and their receptor genes in different tissues in E.akaara

表3赤点石斑鱼性腺发育各阶段的组织学特征Tab.3 Histological characteristics of gonads at different stages of gonadal development in E.akaara
[9]VISCHER H F,BOGERD J.Cloning and functional characterization of a gonadal luteinizing hormone receptor complementary DNA from the African catfish ( Clarias gariepinus)[J].Biol Reprod,2003,68 ( 1) : 262-271.
[10]KWOK H F,SO W K,WANG Y J,et al.Zebrafish gonadotropins and their receptors: 1.cloning and characterization of zebrafish follicle-stimulating hormone and luteinizing hormone receptors-evidence for their distinct functions in follicle development[J].Biol Reprod,2005,72 ( 6) : 1370-1381.
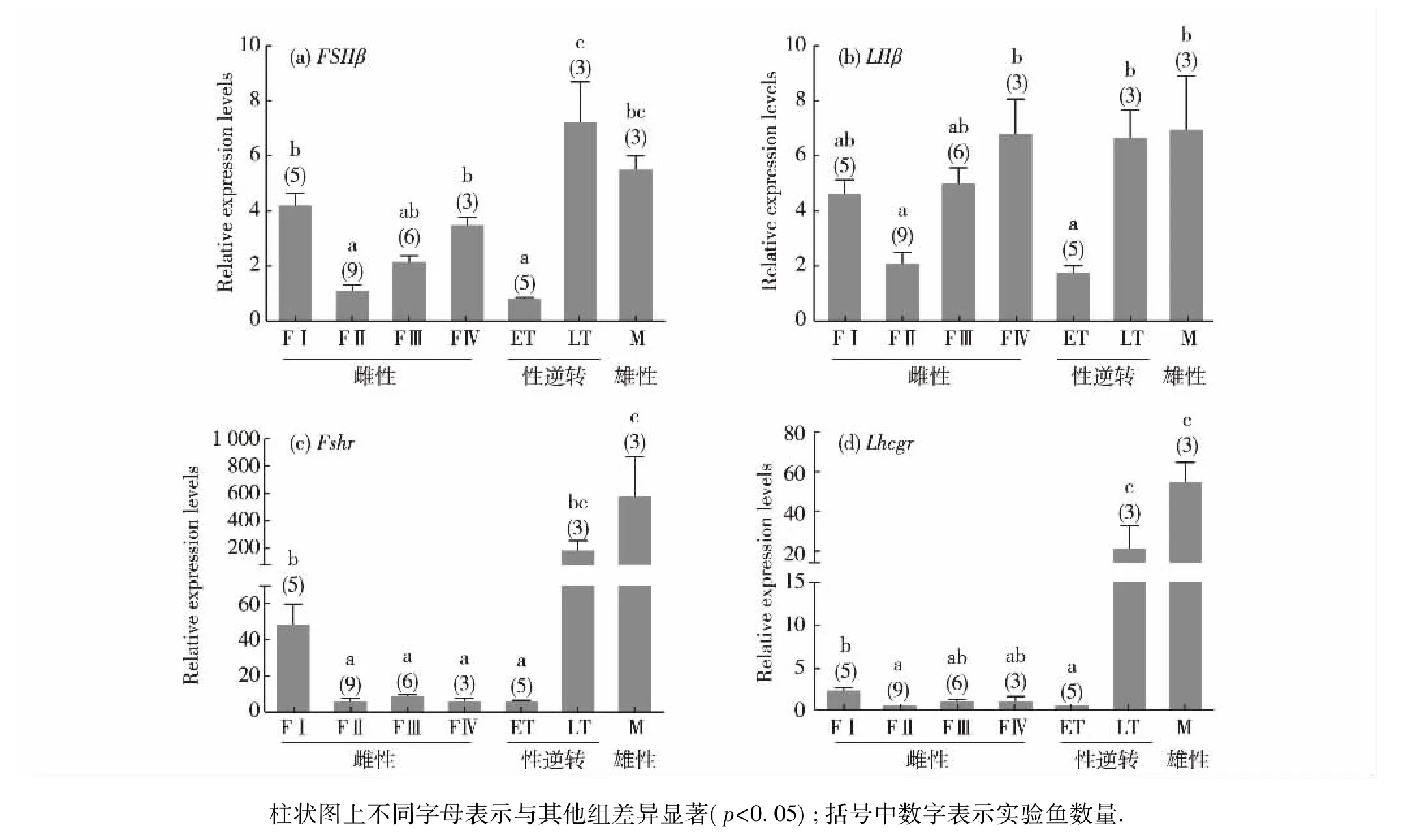
图5赤点石斑鱼促性腺激素β亚基及其受体基因在性腺发育各阶段的表达模式Fig.5 The expression patterns of GtHsβ and their receptor genes at different stages of gonadal development in E.akaara
[11]JENG S R,YUEH W S,CHEN G R,et al.Differential expression and regulation of gonadotropins and their receptors in the Japanese eel,Anguilla japonica[J].Gen Comp Endocr,2007,154( 1/2/3) : 161-173.
[12]AN K W,LEE K Y,YUN S G,et al.Molecular characterization of gonadotropin subunits and gonadotropin receptors in black porgy,Acanthopagrus schlegeli: effects of estradiol-17 beta on mRNA expression profiles[J].Comp Biochem Phys B,2009,152( 2) : 177-188.
[13]KOBAYASHI Y,NAKAMURA M,SUNOBE T,et al.Sex change in the gobiid fish is mediated through rapid switching of gonadotropin receptors from ovarian to testicular portion or vice versa[J].Endocrinology,2009,150( 3) : 1503-1511.
[14]SHINODA T,MIRANDA L A,OKUMA K,et al.Molecular cloning and expression analysis of fshr and Lhr in relation to fshb and lhb subunits during the period of temperaturedependent sex determination in pejerrey Odontesthes bonariensis[J].Mol Reprod Dev,2010,77( 6) : 521-532.
[15]HU X S,LIU X C,ZHANG H F,et al.Expression profiles of gonadotropins and their receptors during 17 alpha-methyltestosterone implantation-induced sex change in the orangespotted grouper ( Epinephelus coioides)[J].Mol Reprod Dev,2011,78( 6) : 376-390.
[16]LEVAVI-SIVAN B,BOGERD J,MANANOS E L,et al.Perspectives on fish gonadotropins and their receptors[J].Gen Comp Endocr,2010,165( 3) : 412-437.
[17]MIWA S,YAN L,SWANSON P.Localization of two gonadotropin receptors in the salmon gonad by in vitro ligand autoradiography[J].Biol Reprod,1994,50( 3) : 629-642.
[18]OHTA T,MIYAKE H,MIURA C,et al.Follicle-stimulating hormone induces spermatogenesis mediated by androgen production in Japanese eel,Anguilla japonica[J].Biol Reprod,2007,77( 6) : 970-977.
[19]GARCIA-LOPEZ A,BOGERD J,GRANNEMAN J C M,et al.Leydig cells express follicle-stimulating hormone receptors in African catfish[J].Endocrinology,2009,150 ( 1) : 357-365.
[20]ALAM M A,KOBAYASHI Y,HIRAI T,et al.Isolation,characterization and expression analyses of FSH receptor in protogynous grouper[J].Comp Biochem Phys A,2010,156 ( 3) : 364-371.
[21]SCHMITTGEN T D,LIVAK K J.Analyzing real-time PCR data by the comparative C-T method[J].Nat Protoc,2008,3( 6) : 1101-1108.
[22]ZHANG W M,ZHANG Y,ZHANG L H,et al.The mRNAexpression of P450 aromatase,gonadotropin beta-subunits and FTZ-F1 in the orange-spotted grouper ( Epinephelus coioides) during 17 alpha-methyltestosterone-induced precocious sex change[J].Mol Reprod Dev,2007,74 ( 6) : 665-673.
[23]HUR S P,LIM B S,HWANG I J,et al.Masculinization in juvenile longtooth grouper,Epinephelus bruneus,with aromatase inhibitor: changes in GtH subunit mRNA expression and steroids hormone levels[J].Anim Cells Syst,2012,16 ( 2) : 127-134.
[24]KOBAYASHI Y,ALAM M A,HORIGUCHI R,et al.Sexually dimorphic expression of gonadotropin subunits in the pituitary of protogynous honeycomb grouper ( Epinephelus merra) : evidence that follicle-stimulating hormone ( FSH) induces gonadal sex change[J].Biol Reprod,2010,82( 6) : 1030-1036.
[25]REINBOTH R,BRUSLESICARD S.Histological and ultrastructural studies on the effects of hCG on sex inversion in the protogynous teleost Coris julis[J].J Fish Biol,1997,51 ( 4) : 738-749.
[26]KOULISH S,KRAMER C R.Human chorionic gonadotropin ( hCG) induces gonad reversal in a protogynous fish,the bluehead wrasse,Thalassoma bifasciatum ( Teleostei,Labridae)[J].J Exp Zool,1989,252( 2) : 156-168.
[27]YEUNG W S,CHEN H,CHAN S T.Effects of LH and LHRH-analog on gonadal development and in vitro steroidogenesis in the protogynous Monopterus albus[J].Gen Comp Endocrinol,1993,89( 3) : 323-332.
Cloning,Characterization and Expression of Gonadotropins and Their Receptors Genes in Epinephelus akaara
CHEN Yuan,HONG Wanshu*,CHEN Shixi,WANG Qiong,ZHANG Qiyong
( College of Ocean&Earth Sciences,Xiamen University,Xiamen 361102,China)
Abstract:In teleost,signaling pathways between gonadotropins ( GtHs) in pituitary and gonadotropin receptors ( GtHRs) in gonad play important roles in gonadal development.To gain insights into the involvement of GtH/GtHR systems in the gonadal development and sex change process,cDNAs encoding GtHs and their receptors were firstly cloned from Epinephelus akaara,a protogynous hermaphrodite fish,and the expression profiles of GtHβ subunits ( FSHβ and LHβ) and their receptors ( Fshr and Lhcgr) were analyzed.Sequence analyses showed that FSHβ and LHβ were characterized by the glycoprotein hormones family,and Fshr and Lhcgr were characterized by the glycoprotein hormone receptors subfamily in E.akaara.FSHβ and LHβ were only expressed in pituitary,while Fshr and Lhcgr were only expressed in gonad.During the sex change,the expression of FSHβ was low at early transition ( ET) stage and increased at late transition ( LT) and male ( M) stages.The expression pattern of LHβ was similar to that of FSHβ,while from ET to LT stages,compared with FSHβ,LHβ expression levels showed a slower increase.The expression levels of both Fshr and Lhcgr were low from FⅠto ET stages,increased significantly at LT stage,and reached the highest level at M stage.The expression level of Fshr was much higher than that of Lhcgr.Taken together,our results suggest that GtH/ GtHR systems are involved in the process of gonadal development and sex change in E.akaara,among which the signaling pathway of FSH possibly plays more important roles than that of LH.
Key words:Epinephelus akaara; GtHs; GtHRs; cloning; expression; gonadal development
*通信作者:wshong@ xmu.edu.cn
基金项目:国家自然科学基金( 41276129) ;高等学校博士学科点专项科研基金( 20120121110029)
收稿日期:2015-01-16录用日期: 2015-06-12
doi:10.6043/j.issn.0438-0479.2016.01.008
中图分类号:Q 785; S 917.4
文献标志码:A
文章编号:0438-0479( 2016) 01-0037-09
引文格式:陈原,洪万树,陈仕玺,等.赤点石斑鱼促性腺激素及其受体基因的克隆和表达模式分析[J].厦门大学学报(自然科学版),2016,55( 1) : 37-45.
Citation: CHEN Y,HONG W S,CHEN S X,et al.Cloning,characterization and expression of gonadotropins and their receptors genes in Epinephelus akaara[J].Journal of Xiamen University( Natural Science),2016,55( 1) : 37-45.( in Chinese)
