活动期类风湿关节炎患者高密度脂蛋白胆固醇代谢特点
2016-04-11赵金石
赵金石,张 宁
(中国医科大学附属盛京医院第二风湿免疫科, 沈阳 110004)
ChinJAllergyClinImmunol,2016,10(4):377- 380
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性、全身性自身免疫性疾病,临床上常表现为侵蚀性、对称性的多关节炎,逐渐会发展为关节畸形及功能丧失。随着风湿病相关医疗技术的进步,RA患者的关节损伤率减低,而近年来大量流行病学研究发现,RA患者的心血管相关疾病的发病率和死亡率与普通人群相比增加一倍[1- 2],并且这些患者中,活动期患者的心血管不良事件发生率高于非活动期患者[3]。心血管疾病发生的一个主要因素是血脂代谢紊乱。胆固醇(total cholesterol,TC)成员之一,高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)具有抗动脉粥样硬化的作用,被认为是冠心病的保护因子。
近年来一些研究提示RA患者存在脂代谢异常,且以HDL-C异常为主,疾病活动度可能与之密切相关,而东北地区也是关节病和心血管疾病的好发地区。本项研究针对以上背景,通过测定和比较于本院就诊的RA患者HDL-C水平,分析活动期RA患者HDL-C与C反应蛋白(C reactive protein,CRP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)的相关性,探讨RA患者HDL-C的代谢特点及其与RA疾病活动的相关性。
资料和方法
临床资料
选择2013年1月至2016年1月就诊于中国医科大学附属盛京医院第二风湿免疫科RA患者86例为研究对象。RA的诊断标准符合2010年美国风湿病学会修订的标准[4]:有以下(1)(2)表现的患者,且A~D项目评分相加≥6/10,可明确诊断为RA。(1)有至少一个关节具有明确的临床滑膜炎(肿胀);(2)有滑膜炎,用其他疾病不能得到更好解释。评分A受累关节:1个大关节(0分);2~10大关节(1分);1~3小关节(有或没有大关节)(2分); 4~10小关节(有或没有大关节)(3分);超过10个关节(至少一个小关节)(5分)。B血清学(至少需要1项结果):RF和ACPA阴性(0分);RF和ACPA至少有一项是低滴度阳性(2分);RF和ACPA至少有一项滴度阳性(3分)。C急性期反应物(至少需要1项结果): CRP和ESR均正常(0分);CRP或ESR异常(1分)。D症状持续时间:<6周(0分);≥6周(1分)。其中根据28个关节疾病活动度评分(DAS28)>3.2分为疾病活动,将研究对象分为活动期RA患者56例(研究组),非活动期RA患者30例(对照组)。所有研究对象均除外可能引起继发性血脂异常的疾病如心脑血管疾病,其他自身免疫性疾病,感染性疾病、其他代谢性疾病等,且未曾应用过影响血脂代谢的药物如糖皮质激素、免疫抑制剂及降脂类药物等。
方法
记录研究对象的性别、年龄、病程等一般资料,HDL-C水平,压痛关节数(tender joint count,TJC),肿胀关节数(swollen joint count,SJC),计算DAS28评分,记录研究组CRP水平、ESR水平。所有研究对象均禁食水6 h,于清晨空腹采集静脉血,送本院检验科化验。
统计学处理
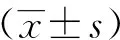
结 果
两组RA患者基本情况
两组患者性别、年龄和病程、类风湿因子阳性率及抗CCP抗体阳性率差异无统计学意义(P>0.05),具有可比性(表1)。
两组患者血脂水平比较
活动期RA患者(研究组)的HDL-C水平显著低于非活动期患者(对照组)(P<0.01)(表2)。
活动期RA患者HDL-C与CRP、ESR的相关性分析
经Pearson直线分析法进行相关性分析,活动期RA患者的HDL-C水平与CRP、ESR水平均呈负相关(r=-0.302,P<0.05;r=-0.273,P<0.05)(图1)。
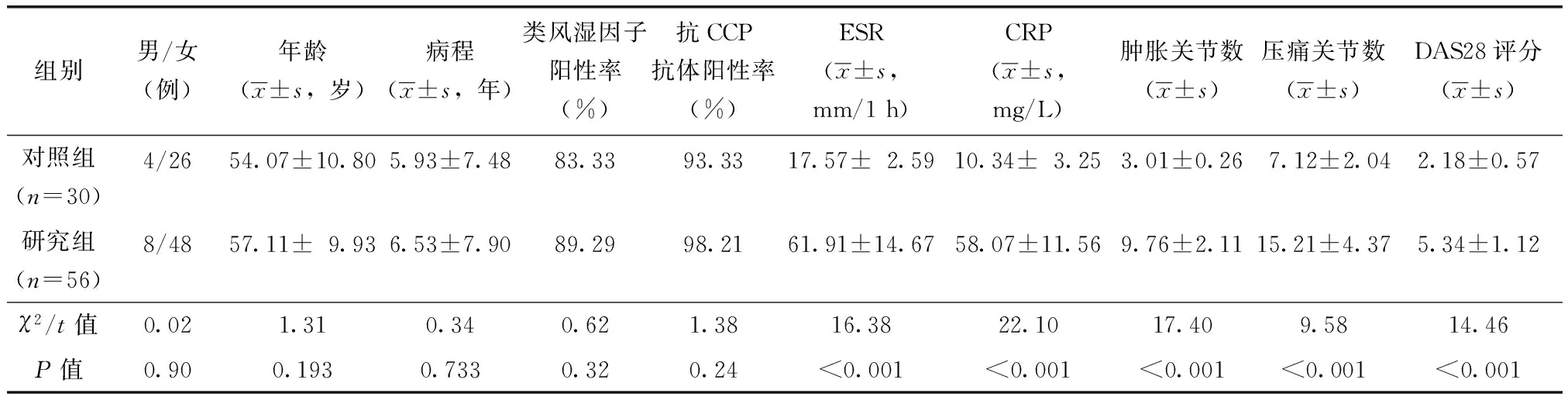
表1 两组类风湿关节炎患者基本情况比较Table 1 Comparison of basic information in two groups of patients with RA
ESR:红细胞沉降率;CRP:C反应蛋白;DAS28:RA疾病活动分数评分;CCP:环瓜氨酸
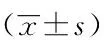
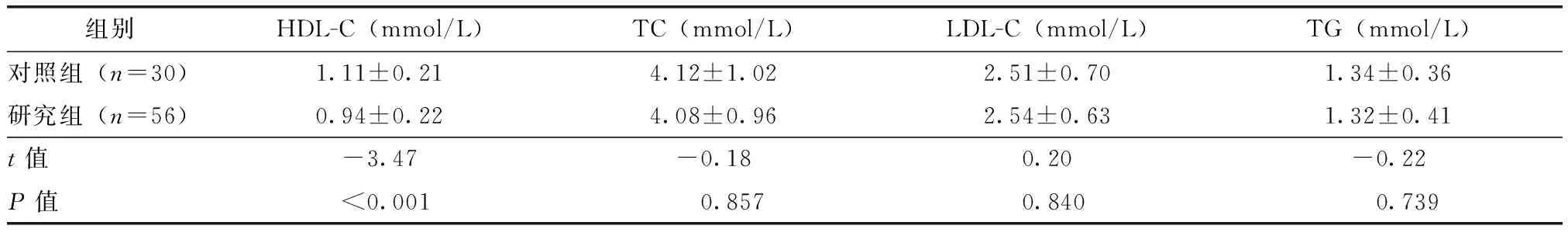
组别HDL-C(mmol/L)TC(mmol/L)LDL-C(mmol/L)TG(mmol/L)对照组(n=30)1.11±0.214.12±1.022.51±0.701.34±0.36研究组(n=56)0.94±0.224.08±0.962.54±0.631.32±0.41t值-3.47-0.180.20-0.22P值<0.0010.8570.8400.739
HDL-C:高密度脂蛋白胆固醇;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;TG:三酰甘油
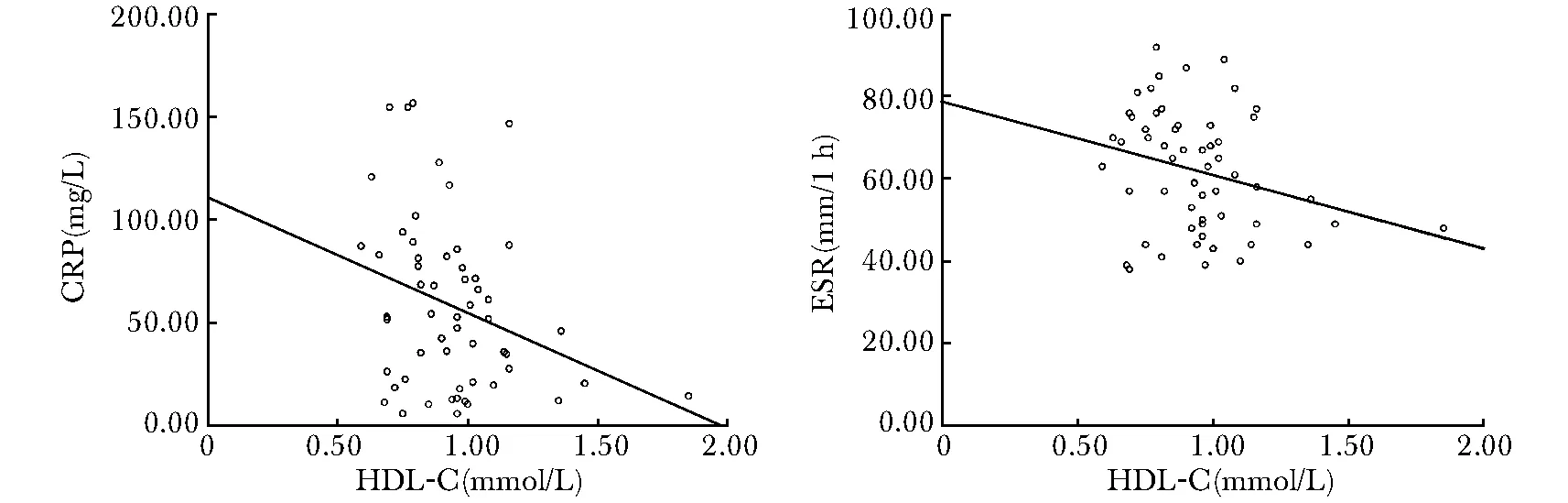
图1活动期RA患者HDL-C与CRP、ESR的相关性
Fig1Relationship between HDL-C and CRP or ESR in patients with active RA
HDL-C:高密度脂蛋白胆固醇; CRP:C反应蛋白; ESR:红细胞沉降率
讨 论
大量流行病学研究显示,RA患者的心血管相关疾病发生率及死亡率明显增加[5]。RA患者中普遍存在血脂异常[5- 8],RA疾病活动度也影响着血脂代谢[9],而血脂代谢紊乱又被认为是心血管不良事件发生的重要因素之一[10]。HDL-C的抗动脉粥样硬化作用逐渐被认可,HDL-C水平与心血管疾病呈负相关。其机制是其可将人体内多余的总胆固醇由外周组织运输到肝脏进行代谢消耗,并阻止单核吞噬细胞在血管内皮细胞的黏附及减少血小板的聚集[11]。而近年有新的研究显示血脂与炎症反应密切相关,在慢性炎症性相关疾病中,炎症反应导致低HDL-C水平,从而促使了动脉粥样硬化的形成[12]。
活动期RA患者常伴有全身的严重的炎症反应。研究表明,活动期RA患者HDL-C浓度的降低可能与抗炎时的HDL-C持续消耗有关[13]。HDL-C主要由肝脏合成。活动期RA患者炎症反应增强,产生了多种相关炎性因子如白细胞介素1(interleukin- 1,IL- 1)、16- 6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等,这些炎症因子导致细胞的分解代谢作用增强,影响肝脏功能,从而抑制HDL-C的产生[14- 16]。另有研究,炎症因子通过抑制葡萄糖转运来加速脂肪分解,增加了血游离脂肪酸水平,与过氧化物酶增殖活化受体(peroxisome Proliferator-activated receptor γ,PPAR)对血脂的作用产生拮抗,从而减少HDL-C的生成[17]。另外,RA患者体内单核-巨噬细胞系统功能异常,影响了肠道合成HDL-C功能,导致其合成减少。本研究结果也证实,与非活动期RA患者相比,活动期RA患者呈现了更低水平的HDL-C,并且活动期RA患者的HDL-C水平与CRP及ESR这些提示疾病活动性的指标水平呈负相关,由此进而明确HDL-C与RA疾病活动的相关性。
活动期RA患者在伴有多种炎症因子增加的同时,HDL-C水平显著降低,这可能是活动期RA患者发生心血管不良事件的风险明显增高的原因之一。本研究选择对象较局限,仍需大样本研究进一步分析探讨RA患者血脂代谢特点,欧洲抗风湿病联盟指南中,推荐所有RA患者每年进行心血管疾病相关评估[18]。在临床上,对于确诊的RA患者,积极控制疾病活动,观察血脂变化,可能对预防RA患者的心血管不良事件的发生具有重要意义。
[1]Avina-Zubieta JA, Choi HK, Sadatsafavi M, et al. Risk of cardiovascular mortality in patients with rheumatoid arthritis:a meta-analysis of observational studies[J]. Arthritis Rheum, 2008, 59: 1690.
[2]Avina-Zubieta JA, Thomas J, Sadatsafavi M, et al. Risk of incident cardiovascular events in patients with rheumatoid arthritis: meta-analysis of observational studies[J]. Ann Rheum Dis, 2012, 71: 1521.
[3]Avouac J, Meune C, Chenevier-Gobeaux C, et al. Inflammation and disease activity are associated with high circulating cardiac markers in rheumatoid arthritis independently of traditional cardiovascular risk factors[J]. J Rheumatol, 2014, 41: 248- 255.
[4]中华医学会风湿病学分会. 类风湿关节炎诊断及治疗指南[J]. 中华风湿病学杂志, 2010, 14: 265- 270.
[5]常文静, 蔡辉. 类风湿关节炎患者心血管风险的管理[J]. 中华临床免疫和变态反应杂志, 2014, 8: 155.
[6]Choy E, Sattar N. Interpreting lipid levels in the context of high-grade inflammatory states with a focus on rheumatoid arthritis: challenge to conventional cardiovascular risk actions[J]. Ann Rheum Dis, 2009 68: 460- 469.
[7]Steiner G, Urowitz MB. Lipid profiles in patients with rheumatoid arthritis:mechanisms and the impact of treatment[J]. Semin Arthritis Rheumm, 2009, 38: 372- 381.
[8]Nurmohamed MT. Atherogenic lipid profiles and its management in patients with rheumatoid arthritis[J]. Vasc Health Risk Manag, 2007, 3: 845- 852.
[9]Welty FK. How do elevated triglycerides and low HDL-Cholesterol affect inflammation and atherothrombosis[J]. Curr Cardiol Rep, 2013, 15: 400.
[10] Popa CD, Arts E, Fransen J, et al. Atherogenic index and high-density lipoprotein cholesterol as cardiovascular risk determinants in rheumatoid arthritis:the impact of therapy with biologicals[J]. Mediators Inflamm, 2012, 2012: 785946.
[11] 张嵩, 刘桂玲, 郑岚. 类风湿关节炎患者血脂变化及临床意义[J]. 临床医学, 2011, 36: 156.
[12] Marsche G, Saemann MD, Heinemann A, et al. Inflammation alters hdl composition and function: Implications for hdl-raising therapies[J]. Pharmacol Ther, 2013, 137: 341- 351.
[13] Yalçin B, Gür G, Artüz F, et al. Prevalence of metabolic syndrome in Behçet disease: a case-control study in Turkey[J]. Am J Clin Dermatol, 2013, 14: 421- 425.
[14] 孔梅, 王坤, 田松平, 等. 活动期类风湿关节炎血脂水平变化相关性研究[J].中华全科医学, 2009, 7: 768.
[15] 臧谋圣, 徐胜前. 瘦素和瘦素受体在类风湿性关节炎及骨质疏松发病机制中的研究进展[J]. 中国医药, 2010, 5: 281.
[16] 闫慧明, 王永福. 不同年龄类风湿关节炎患者临床特征分析[J]. 中国全科医学, 2012, 15: 2259.
[17] 张莉, 杨永健. 过氧化物酶体增值物激活受体抗动脉粥样硬化研究进展[J]. 中国心血管杂志, 2012, 17: 76- 78.
[18] Peters MJ, Symmons DP, McCarey D, et al. Eular evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis[J]. Ann Rheum Dis, 2010, 69: 325- 331.