青霉素过敏及诊断方法
2016-04-11王良录
孟 娟,王良录
(四川大学华西医院耳鼻咽喉头颈外科过敏性鼻炎诊治中心, 成都 610041)
ChinJAllergyClinImmunol,2016,10(4):412- 420
青霉素属β内酰胺类抗生素,是人类历史上发现的第一种抗生素,杀菌力强,在各类抗生素中毒副作用较低,且价格低廉,但因其可引发过敏反应甚至过敏性休克造成死亡,在临床上的应用受到了很大限制。如果患者自述有青霉素过敏(包括青霉素皮肤试验阳性)史,医师在药物选择上往往会避开青霉素类药物。由于可能存在交叉反应,通常会对自述青霉素过敏的患者避免使用所有的β内酰胺类药物,而改用其他类抗生素作为替代,如大环内酯类、喹诺酮类及糖肽类抗生素等。据国外文献报道,在普通人群中,自述青霉素过敏的比例高达10%~20%[1- 3],但其中经过临床检测确诊为青霉素过敏的比例只有5%~10%[4- 6]。错误的青霉素过敏诊断会导致不必要的抗生素用药升级,使医疗费用增加,细菌耐药概率增加。因此应用正确的检测方法和流程进行诊断,排除伪青霉素过敏具有重大而深远的临床及卫生经济学意义。然而我国目前普遍使用的青霉素过敏检测诊断方法、理念与欧美国家的指南及临床操作流程有很大差距。本文旨在回顾青霉素过敏的免疫学及药理学基础,介绍国外青霉素过敏的诊断流程和方法,探讨我国目前操作方法可能存在的缺陷。
青霉素发现史
1928年英国伦敦圣玛丽医院的细菌学家亚历山大·弗莱明无意中发现与空气接触过的金黄色葡萄球菌培养皿中长出了一团青绿色霉菌,而霉菌周围的葡萄球菌菌落已经被溶解,后经鉴定发现上述的青绿色霉菌为青霉菌。1929年6月,弗莱明把他的发现总结成论文发表,他把青霉菌分泌的具有杀菌活性的物质称为青霉素。1941年英国牛津大学病理学家弗洛里和生物化学家钱恩完成了青霉素的分离和纯化,1942年美国制药企业开始对青霉素进行大批量生产。青霉素是人类历史上发现的第一种抗生素,它的发现开创了抗感染治疗的新时代,改变了人类与感染性疾病之间生死搏斗的结局,人类的寿命得以延长。1945年弗莱明、弗洛里和钱恩因青霉素的发现及其临床应用而共同获得了诺贝尔生理学和医学奖。但随着青霉素的广泛临床应用,其可引发过敏反应的现象逐渐引起重视。Lyons最早在1943年报道了因术后感染需使用青霉素的美国士兵中,约5.7%的患者可出现荨麻疹[7]。1946年,Suchecki发表了第一篇有关青霉素过敏的综述[8]。
青霉素过敏的分子学基础
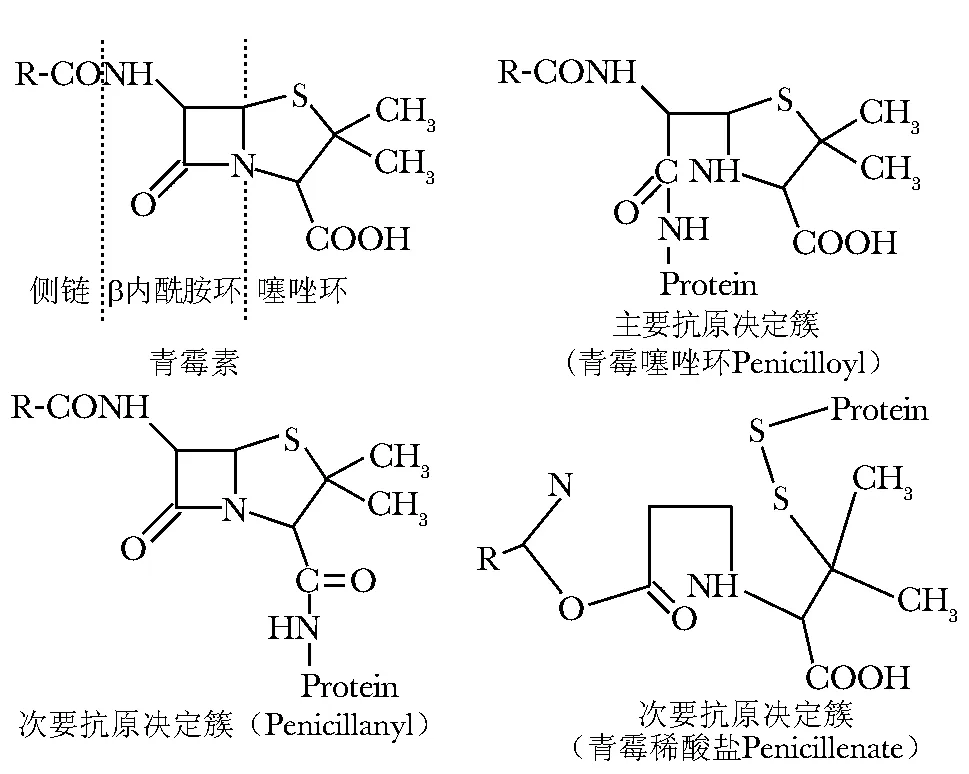
图1 青霉素、主要抗原决定簇、次要抗原决定簇结构图Fig 1 Chemical molecular structure of penicillin, major determinant and minor determinants
青霉素类药物由母核(包括1个β内酰胺环,1个噻唑环)以及各种不同的侧链组成(图1)。青霉素本身的分子量小,属于半抗原,其代谢产物与体内蛋白质或多肽的结合产物构成可引发过敏反应的完全抗原。青霉素进入机体后,由于β内酰胺环的化学不稳定性,首先内酰胺环被打开,形成活性中间体青霉噻唑(penicilloyl),然后与体内的蛋白质结合。青霉素的降解90%以上是通过上述途径,因此青霉噻唑作为青霉素最主要的体内代谢产物,被称为主要抗原决定簇(major determinant)。商业化的青霉素过敏皮肤试验检测试剂的主要抗原决定簇是由青霉噻唑基(penicilloyl)和聚赖氨酸(polylysine)合成的,称为青霉噻唑酰多聚赖氨酸(penicilloyl-polylysine,PPL)。青霉素也可通过其他代谢途径被分解为其他的抗原决定簇,这些代谢物质产生的量少,所以被称为次要抗原决定簇(minor determinant),包括青霉烯酸盐(penicillenate)、青霉烷(penamaldate)、penicillanyl、penaldate等,商业化的试剂把这些物质混合在一起,统称为次要抗原决定簇混合液(minor determinant mixture,MDM),青霉素自身也是次要抗原决定簇之一。
青霉素类抗生素除了共同的母核(β内酰胺环和噻唑环)外,添加不同的侧链结构可形成不同种类的半合成青霉素。研究发现氨苄青霉素、阿莫西林[9]和氟氯西林[10]等的侧链结构具有重要的免疫原性,并且在对这些药物过敏的患者中可以检测到针对侧链的特异性IgE抗体。对阿莫西林过敏的患者,可能耐受青霉素G激发试验[11- 13]。因此除母核结构外,侧链结构也可导致过敏反应的发生。
青霉素过敏反应分类
青霉素过敏反应可根据给药和过敏反应发生的时间间隔分为速发型和迟发型两种类型。速发型反应是由IgE介导的,通常发生在给药后数分钟至1 h,可表现为全身风团、皮肤瘙痒、血管神经性水肿、支气管痉挛、严重过敏反应甚至过敏性休克造成死亡;迟发型反应是非IgE介导的,发生在给药后1 h甚至数天,可表现为红斑疹、斑丘疹、多形性红斑、Stevens-Johnson综合征、中毒性表皮坏死松解症、剥脱性皮炎、DRESS综合征等[14],迟发反应中非皮肤病变包括血清病型反应和药物热,较少见的迟发反应包括免疫性细胞减少、嗜酸粒细胞性肺浸润及超敏性血管炎等。
青霉素过敏流行病学研究
β内酰胺类药物是引起药物过敏反应最常见的药物之一,但在普通人群中,青霉素过敏的发病率目前仍缺乏相关流行病学调查数据。青霉素引起严重过敏反应的概率约为0.015%~0.04%[15- 16],20~49岁年龄组多见[17];而在严重过敏反应中,由青霉素诱发的约占0.7%~10%[16,18];使用青霉素后出现致死性严重过敏反应的发生率估计为0.001 5%~0.002%[16,19]。在欧洲约20%的药物相关致死性严重过敏反应是由青霉素导致的[20]。
国外青霉素过敏诊断流程
病史采集
详尽、准确的病史是正确诊断的前提和基础。问诊内容应包括可疑致敏青霉素类药物的具体名称、使用时间、给药途径、过敏症状、给药后症状出现时间、缓解时间以及之后相关抗生素使用情况等,这些信息对于判断是否为真正的过敏、过敏反应的类型、后续是否可进行皮肤试验以及皮肤试验起始浓度的选择均具有重要意义。但在临床实际工作中,由于药物过敏可能发生在很久以前,患者的记忆不一定准确,临床资料的记录可能丢失或者无法获得,因此所获取的信息可能不够详细和精确。
皮肤试验
皮肤试验对于青霉素过敏的诊断很有价值,试验的试剂应包括PPL、MDM、青霉素G、阿莫西林、病史中怀疑导致过敏的药物、阳性及阴性对照。首先进行皮肤点刺试验(skin prick test, SPT),若SPT为阴性结果进一步行皮内试验(intradermal test, IDT)。不引起皮肤非特异性刺激反应的各种试剂的推荐浓度见表1。
皮肤试验最好在药物过敏发生6周后进行,以免若病史提示可疑严重不良反应,皮肤试验的浓度可从更低浓度开始;改编自英国伦敦大学学院附属皇家耳鼻咽喉头颈外科医院过敏反应科药物过敏门诊β内酰胺类药物皮肤试验操作规程;PPL:青霉噻唑酰多聚赖氨酸;MDM:次要抗原决定簇混合液在过敏反应的不应期内得到假阴性的结果。若病情需要也可在6周之内进行,如结果为阴性需在6周之后复查。但皮肤试验和药物过敏反应的间隔时间太长也会使阳性率降低。有研究结果证实青霉素的特异性IgE抗体浓度随着抗原暴露时间的延长逐渐减低[21],特异性IgE的半衰期为1.6~76.4个月,52%的患者特异性IgE的半衰期<1年[22]。青霉素皮肤试验阳性患者,1年之内、1~10年和10年以上皮肤试验复查阳性率分别为73%、57%和22%[23]。

表1 青霉素类及头孢菌素类药物皮肤试验常用试剂推荐浓度Table 1 Concentrations of agents used for the skin test (mg/ml)
按照规范的流程来实施青霉素皮肤试验,总体来说安全性较高,全身不良反应少见。据文献报道,β内酰胺类药物皮肤试验全身不良反应发生在所有接受皮肤试验的患者中发生率约为0.1%~2%,而在检测结果为阳性的患者中发生率为0.7%~9.4%[24- 27]。但也有致死病例报道,美国统计,1973至1983年间有1例因青霉素皮肤试验造成死亡,原因为试剂浓度错误,并且在IDT之前未进行SPT检测[28]。因此,青霉素皮肤试验应由经过正规培训、能够按正确步骤实施、对结果进行合理解释,并熟悉如何判断和处理不良反应的专业人员进行;皮肤试验实施场所应配备应对不良事件的相关抢救药品和设备。
皮肤试验的阴性预测值为70%~93%,若仅进行皮肤试验,有可能造成1/3青霉素过敏的患者漏诊[29- 30],因此,皮肤试验阴性仍需经药物激发试验来除外青霉素过敏。有关皮肤试验阳性预测值的研究非常有限,因为在皮肤试验为阳性结果的情况下,医师从安全性角度出发,往往避免进行药物激发试验来进一步确诊。
血清学特异性IgE检测
瑞典赛默飞世尔公司的Immunocap系统是目前使用最为广泛的青霉素特异性IgE检测系统,可检测抗原包括penicilloyl V(Pen V)、penicilloyl G(Pen G)、amoxicilloyl、ampicilloyl。该检测虽特异度高,但灵敏度很低[31],Fontaine等[32]报道其特异度为85.7%~100%,而灵敏度仅为12.5%~25.0%。但西班牙研究的结果显示,290例确诊青霉素过敏的患者中,有24例皮肤试验阴性而特异性IgE阳性的患者,经药物激发试验确诊青霉素过敏[33]。因此,特异性IgE检测在国外相关指南中一般不作为必需检测的常规项目,但当病史与皮肤试验结果不相符,即病史强阳性而皮肤试验结果为阴性时,可在激发试验前进行sIgE检测,以避免不必要的激发试验的风险[14]。
药物激发试验
如皮肤试验为阴性(如果进行了sIgE检测结果亦阴性),需进一步进行药物激发试验。采用剂量逐步递增的方式给药,通常采用口服激发。剂量递增的时间间隔为20~30 min,最后一剂给药后需观察60~90 min。当出现过敏症状或总的激发给药剂量达到常规治疗1 d的总量时,终止或结束试验。激发试验推荐方案见表2。如果现场药物激发试验结果为阴性,患者仍需在家服用3~5 d治疗剂量的药物,以排除迟发型反应的可能[34]。有些国家如瑞典,甚至推荐在家口服激发的时间长达7 d[35]。口服激发试验的阴性预测值高达94%~100%,一项多中心研究结果显示,对118例β内酰胺类药物口服激发试验阴性的患者进行随访,仅7.6%的患者在其后使用同种药物出现轻度迟发型反应[36]。
青霉素迟发型过敏反应诊断
由于皮肤试验对迟发型过敏反应诊断的灵敏度低,目前也缺乏标准化的诊断方法和流程,因此迟发型过敏反应比速发型过敏反应的诊断难度更大。迟发型过敏反应累及皮肤的情况常见,但也可以累及多脏器、系统,可导致肾炎、肝炎及血管炎等。对于轻度仅累及皮肤的迟发型过敏反应,可以进行斑贴试验或者延迟判读结果的IDT(分别于IDT后20 min、24 h、48 h、72 h读取结果),但两种方法的灵敏度均不高。有研究报道斑贴试验对β内酰胺类药物引起的迟发型皮肤反应的灵敏度仅为9%[37],而延迟判读结果的IDT的灵敏度高于斑贴试验[38],可能是由于一些药物的穿透性差,斑贴试验时难以进入皮肤,但IDT特异度低于斑贴试验[39];斑贴试验的安全性较IDT高。对于轻度仅累及皮肤的迟发型过敏反应也可进行药物激发试验,起始激发剂量为1/100治疗剂量,此后以1/10的治疗剂量激发3~7 d,最后以全治疗剂量激发3~7 d[39]。但对于严重迟发型反应的患者不建议进行IDT和药物激发试验[14]。
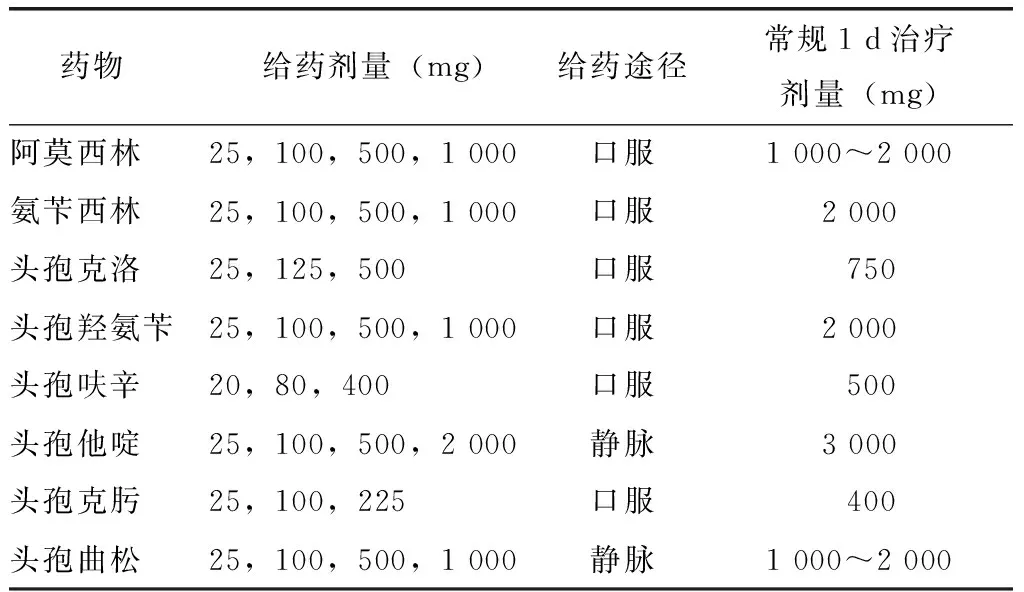
表2 青霉素类及头孢菌素类药物激发试验推荐给药剂量[34]Table 2 Drug challenge protocol of penicillins and cephalosporins
青霉素与头孢菌素之间的交叉反应性
青霉素类药物由一个β内酰胺环、一个噻唑环以及不同侧链组成,为六元环结构。头孢菌素虽也属于β内酰胺类抗生素,但其基本结构包括一个β内酰胺环、一个噻嗪环,为七元环(图2)。从电子共轭的药物化学角度来看,头孢菌素的β内酰胺环比青霉素的稳定,不易开环。虽然头孢菌素类在体内降解的产物尚未明确[40],但已有研究表明头孢菌素引起过敏的主要抗原决定簇与青霉素不同,为侧链结构[41- 42]。青霉素与第一代或者早期第二代(1980年以前上市的)头孢菌素之间的交叉反应概率约为10%,但与第三代之间仅有2%~3%[43]。一项荟萃分析研究结果证实,青霉素过敏的患者,对第一代头孢菌素过敏的概率较普通人群高,而对第二代、第三代头孢菌素过敏的发生率无影响[44]。头孢菌素与青霉素、不同种类头孢菌素类药物是否会引起交叉反应,主要取决
于是否有相同或相似的侧链结构(常用头孢菌素与青霉素的侧链结构比较见表3、4)。因此欧美国家相关指南中规定,对于有青霉素过敏病史,且经过敏原检测确诊的患者,如需使用头孢类抗生素,需要选用与致敏青霉素侧链不同的头孢菌素来进行皮肤试验,如果皮肤试验结果为阴性,需进一步进行激发试验来确认[14]。
进行青霉素过敏诊断的意义
在临床中,患者自述青霉素过敏的情况非常常见,调查结果显示在普通人群中比例可高达10%~20%[1- 3]。但Bousquet等[6]研究发现在1 218例怀疑青霉素过敏的患者中,经皮肤试验和激发试验最终确诊的仅有21.1%。一项丹麦的研究,对一家大学附属医院所有病历上标注了青霉素过敏的患者进行相关检测,最终仅5%的患者确诊青霉素过敏[4],因此经过正规、系统的诊断可以排除大量伪青霉素过敏。患者自述和最终确诊结果之间有如此大差异的可能原因:(1)患者往往把药物不良反应与药物过敏混为一谈;(2)在感染性疾病发病期间,感染本身有可能诱发皮疹(如风团),机制尚不完全清楚,但可能与病原微生物侵入皮肤、病原微生物产生毒素或通过循环免疫复合物激活补体系统有关,但此种情况下出现的皮疹往往被归因于青霉素过敏[45];(3)患者可能确实是对青霉素过敏,但检测时间距青霉素过敏时间间隔太长,患者体内特异性IgE已经消失。
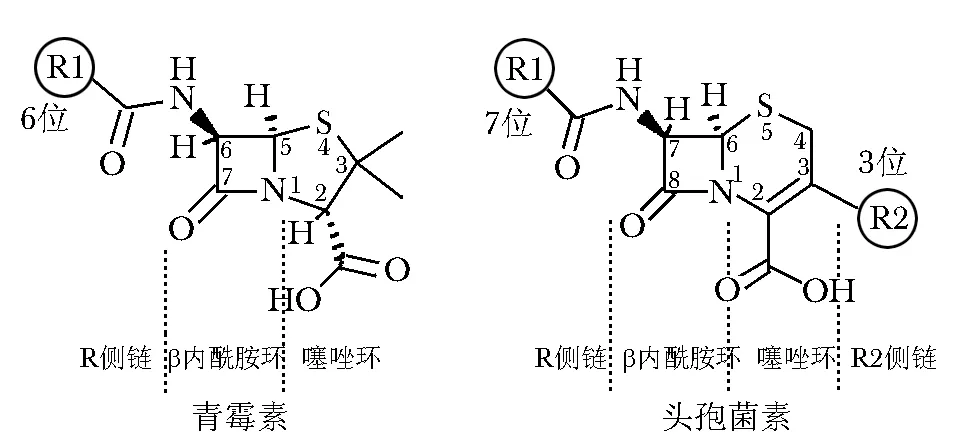
图2 青霉素和头孢菌素分子结构对比Fig 2 Comparison the chemical molecular structure between penicillin and cephalosporin

药物头孢克洛头孢羟氨苄头孢氨苄头孢克肟头孢噻肟头孢泊肟头孢拉定头孢他啶头孢曲松头孢呋辛青霉素G相似相似相似不同不同不同相似不同不同不同氨苄西林相同相似相同不同不同不同相同不同不同不同阿莫西林相似相同相似不同不同不同相似不同不同不同

表4 青霉素类药物C6位侧链与头孢类药物C3位侧链比较[14]Table 4 Comparison of the side chain of penicillins(C6 position) to cephalosporins(C3 position)
在美国梅奥医学中心进行的一项研究显示,进行选择性外科手术并且有青霉素过敏史的患者,经变态反应科医师会诊并进行过敏评估,可有效降低术中预防性使用万古霉素的概率[46]。在一项更为大型的研究中,纳入1 030例需接受外科手术且有青霉素过敏史的患者,过敏评估可将预防使用万古霉素的比例从30%下降到16%[47]。因此,对于有青霉素过敏主诉的患者进行系统过敏原检测及临床评估,对于减少抗生素滥用、减少细菌耐药及降低医疗费用具有重要意义。
其他国家及地区对青霉素皮肤试验的规定
皮肤试验是诊断青霉素过敏的首选检测方法,但由未经培训人员进行皮肤试验可能存在潜在的诱发严重过敏反应的风险[16],并且对没有可疑青霉素过敏史的患者给药前均进行皮肤试验不符合成本效益原则[48],因此欧美国家[14,48- 51]不推荐在所有患者每次给药前均进行皮肤试验,仅需对既往有青霉素过敏史的患者进行皮肤试验,但仅依据皮肤试验不能排除或确诊过敏,需进行前述的一系列相关检查以明确诊断(图3)。
日本在2004年因“没有确切能预知休克、严重过敏反应的方法”,将青霉素类药物用药前需行皮肤试验的规定取消[52]。
中国台湾省“卫生处”曾于1945年规定在注射青霉素前为保证安全应先做皮肤试验。1946年“司法行政部”规定司法机关在审判青霉素过敏致死案件
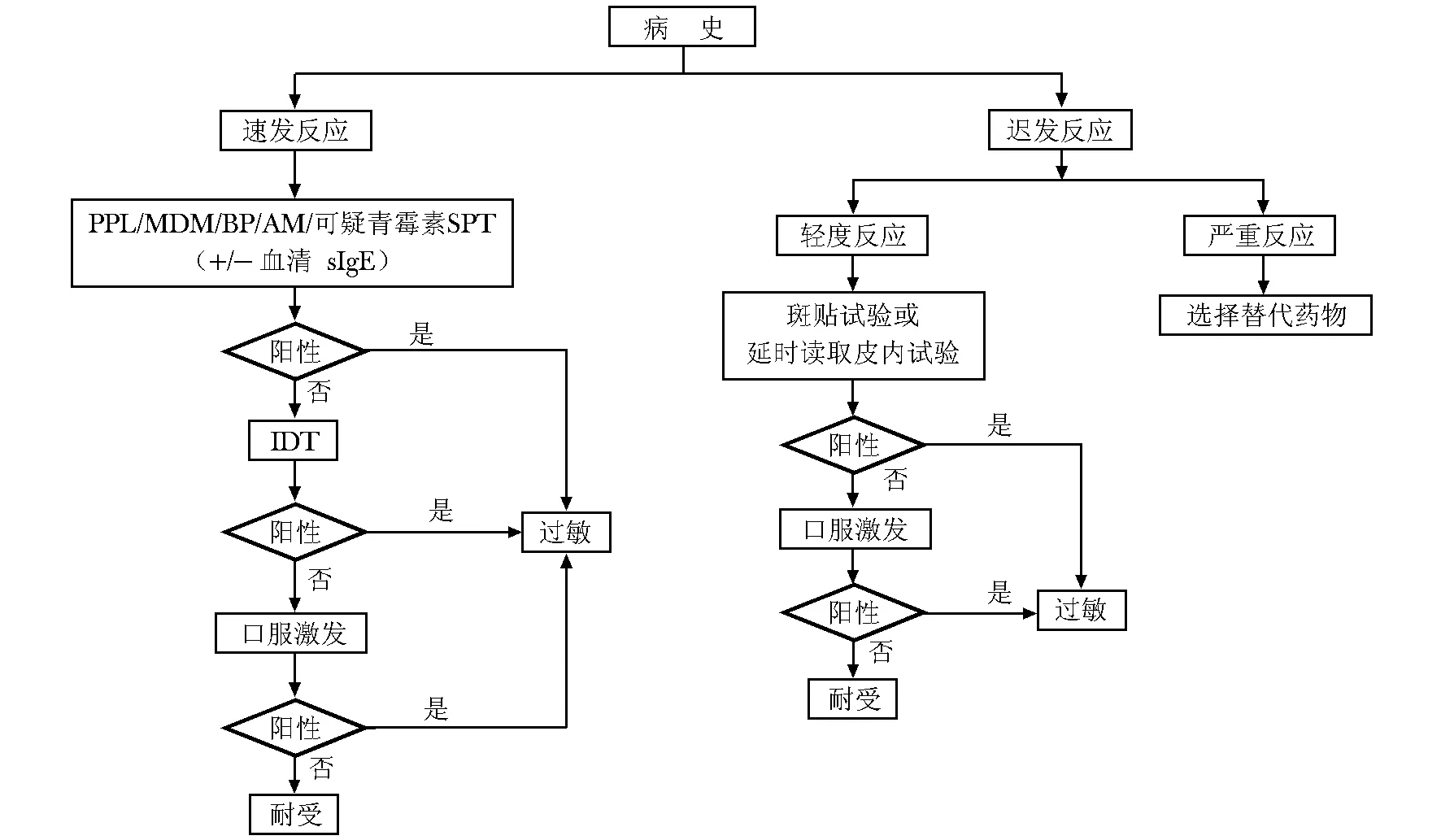
图3青霉素类药物过敏诊断流程[14]
Fig3Flow chart of penicillin allergy diagnosis[14]
SPT:皮肤点刺试验;IDT:内皮试验;PPL:青霉噻唑酰多聚赖氨酸;MDM:次要抗原决定族混合液;BP:青霉素;AM:阿莫西林
时,以事先是否行皮肤试验为判案依据。但在1966年发布的有关“注射盘尼西林(即青霉素)应注意事项”函中,对以往规定进行了更改,大致内容:(1)对于注射青霉素发生的纠纷事件,审判不以事先是否进行青霉素皮肤试验为依据;(2)青霉素皮肤试验可靠性不强,且皮肤试验用量、用法均无统一标准可循,远非普通医师能力所及,对皮肤试验是否继续进行不做硬性规定[52]。
我国青霉素过敏诊断现状及存在问题
我国目前仍规定给予青霉素类药物口服、肌注或者静注治疗前,必须进行皮肤试验[53- 55]。皮肤试验操作方法为用生理盐水将青霉素钾或者青霉素钠配制成500 U/ml的皮肤试验试剂,抽取0.1 ml于前臂曲侧腕关节以上6.6 cm处皮内注射成皮丘,20 min后出现红肿,直径>1 cm或局部红晕或伴水疱为阳性[53]。但操作中存在问题颇多:(1)仅用新配制的青霉素G稀释液进行IDT,而该成分实际仅为引起青霉素过敏的次要抗原决定簇之一,势必会造成90%以上真正青霉素过敏的患者漏诊,这也是我国有青霉素皮肤试验阴性而用药中仍会出现严重过敏反应、甚至出现致死反应的主要原因;(2)临床操作中,皮肤试验不设置阴性、阳性对照试剂,无法排除假阳性、假阴性结果;(3)未进行SPT而直接进IDT,增加了IDT诱发严重过敏反应,甚至出现致死反应的风险;(4)进行皮肤试验操作的护士往往没有经过严格培训,在皮肤试验操作以及结果判读上难免有误差,且当皮肤试验导致严重过敏反应时,有可能做不到尽早发现、正确处理,错过最佳抢救时机,因此皮肤试验导致的致死性严重过敏反应也时有发生;(5)国内的医务工作者担心国产青霉素制剂的质量问题,认为进口青霉素杂质含量少,国产青霉素杂质含量高,而杂质成分也可导致过敏反应,因此认为给药前进行皮肤试验很有必要。但实际上如今我国青霉素类药物药典规定的质量标准与国外一致[56],国产试剂质量已有明显的提高,且并无研究结果显示皮肤试验对于杂质成分引起过敏反应的预测价值。综上所述,实际目前所实施的青霉素皮肤试验诊断结果不可靠,假阳性、假阴性比例均很高,是错误弃用青霉素改用其他类抗生素导致抗生素滥用的重要原因之一,并且不规范的皮肤试验操作本身就存在一定的诱发严重过敏反应的隐患。
为保证临床正确用药和患者安全,亟待建立完善而正规的青霉素过敏诊断流程。然而,目前我国要进行此项工作尚存在很多瓶颈。首先青霉素主要和次要抗原决定簇的商业化制剂PPL和MDM目前在国内市场还是空白;另外一套完整的青霉素过敏诊断流程较复杂,需要经过相关培训的医师来执行。而我国目前独立、成规模的变态反应科建制稀缺,过敏性疾病往往分散于各相关科室处置,如耳鼻喉科、呼吸科、儿科及皮肤科,专职的变态反应科医师数量远远不足。因此,宣传、普及有关青霉素过敏诊断的正确理念,引入进口商业化皮肤试验试剂,制订规范化的诊断流程、大力培养专业人员,逐步改变不合理的法规制度是解决此问题的关键。
[1]Surtees SJ, Stockton MG, Gietzen TW. Allergy to penicillin: fable or fact?[J]. BMJ, 1991, 302: 1051- 1052.
[2]Solensky R. Hypersensitivity reactions to beta-lactam antibiotics[J]. Clin Rev Allergy Immunol, 2003, 24: 201- 220.
[3]Albin S, Agarwal S. Prevalence and characteristics of reported penicillin allergy in an urban outpatient adult population[J]. Allergy Asthma Proc, 2014,35: 489- 494.
[4]Borch JE, Andersen KE, Bindslev-Jensen C. The pre-valence of suspected and challenge-verified penicillin allergy in a university hospital population[J]. Basic Clin Pharmacol Toxicol, 2006,98: 357- 362.
[5]Silva R, Cruz L, Botelho C, et al. Work up of patients with history of beta-lactam hypersensitivity[J]. Allergol Immunopathol(Madr),2009,37: 193- 197.
[6]Bousquet PJ, Pipet A, Bousquet-Rouanet L, et al. Oral challenges are needed in the diagnosis of beta-lactam hypersensitivity[J]. Clin Exp Allergy, 2008,38: 185- 190.
[7]Lyons C. Problems Of Infection And Chemotherapy[J]. Ann Surg,1943,117: 894- 902.
[8]Suchecki AI. Allergic reactions to penicillin[J]. Br Med J, 1946,2: 938- 940.
[9]de Haan P, de Jonge AJ, Verbrugge T, et al. Three epitope-specific monoclonal antibodies against the hapten penicillin[J]. Int Arch Allergy Appl Immunol, 1985,76: 42- 46.
[10] Baldo BA, Pham NH, Weiner J. Detection and side-chain specificity of IgE antibodies to flucloxacillin in allergic subjects[J]. J Mol Recognit,1995,8: 171- 177.
[11] Blanca M, Perez E, Garcia J, et al. Anaphylaxis to amoxycillin but good tolerance for benzyl penicillin.Invivoandinvitrostudies of specific IgE antibodies[J]. Allergy,1988,43: 508- 510.
[12] Blanca M, Vega JM, Garcia J, et al. Allergy to penicillin with good tolerance to other penicillins; study of the incidence in subjects allergic to beta-lactams[J]. Clin Exp Allergy,1990,20: 475- 481.
[13] Vega JM, Blanca M, Garcia JJ, et al. Immediate allergic reactions to amoxicillin[J]. Allergy,1994,49: 317- 322.
[14] Mirakian R, Leech SC, Krishna MT, et al. Management of allergy to penicillins and other beta-lactams[J]. Clin Exp Allergy,2015,45: 300- 327.
[15] Park MA, Li JT. Diagnosis and management of penicillin allergy[J]. Mayo Clin Proc,2005,80: 405- 410.
[16] Idsoe O, Guthe T, Willcox RR, et al. Nature and extent of penicillin side-reactions, with particular reference to fatalities from anaphylactic shock[J]. Bull World Health Organ,1968,38: 159- 188.
[17] Sue MA, Noritake DT, Klaustermeyer WB. Penicillin anaphylaxis: fatality in elderly patients without a history of penicillin allergy[J]. Am J Emerg Med,1988,6: 456- 458.
[18] Neugut AI, Ghatak AT, Miller RL. Anaphylaxis in the United States: an investigation into its epidemiology[J]. Arch Intern Med,2001,161: 15- 21.
[19] International Collaborative Study of Severe A. Risk of anaphylaxis in a hospital population in relation to the use of various drugs: an international study[J]. Pharmacoepidemiol Drug Saf,2003,12: 195- 202.
[20] Lenler-Petersen P, Hansen D, Andersen M, et al. Drug-related fatal anaphylactic shock in Denmark 1968-1990. A study based on notifications to the Committee on Adverse Drug Reactions[J]. J Clin Epidemiol,1995,48: 1185- 1188.
[21] Antunez C, Fernandez T, Blanca-Lopez N, et al. IgE antibodies to betalactams: relationship between the triggering hapten and the specificity of the immune response[J]. Allergy,2006,61: 940- 946.
[22] Hjortlund J, Mortz CG, Stage TB, et al. Positive serum specific IgE has a short half-life in patients with penicillin allergy and reversal does not always indicate tolerance[J]. Clin Transl Allergy,2014,4: 34.
[23] Sullivan TJ, Wedner HJ, Shatz GS, et al. Skin testing to detect penicillin allergy[J]. J Allergy Clin Immunol,1981,68: 171- 180.
[24] Green GR, Rosenblum AH, Sweet LC. Evaluation of penicillin hypersensitivity: value of clinical history and skin testing with penicilloyl-polylysine and penicillin G. A cooperative prospective study of the penicillin study group of the American Academy of Allergy[J]. J Allergy Clin Immunol,1977,60: 339- 345.
[25] Gadde J, Spence M, Wheeler B, et al. Clinical experience with penicillin skin testing in a large inner-city STD clinic[J]. JAMA,1993,270: 2456- 2463.
[26] Valyasevi MA, Van Dellen RG. Frequency of systematic reactions to penicillin skin tests[J]. Ann Allergy Asthma Immunol,2000,85: 363- 365.
[27] Co Minh HB, Bousquet PJ, Fontaine C, et al. Systemic reactions during skin tests with beta-lactams: a risk factor analysis[J]. J Allergy Clin Immunol,2006,117: 466- 468.
[28] Lockey RF, Benedict LM, Turkeltaub PC, et al. Fatalities from immunotherapy(IT) and skin testing(ST)[J]. J Allergy Clin Immunol,1987,79: 660- 677.
[29] Richter AG, Wong G, Goddard S, et al. Retrospective case series analysis of penicillin allergy testing in a UK specialist regional allergy clinic[J]. J Clin Pathol,2011,64: 1014- 1018.
[30] Torres MJ, Romano A, Mayorga C, et al. Diagnostic evaluation of a large group of patients with immediate allergy to penicillins: the role of skin testing[J]. Allergy,2001,56: 850- 856.
[31] Dworzynski K, Ardern-Jones M, Nasser S, et al. Diagnosis and management of drug allergy in adults, children and young people: summary of NICE guidance[J]. BMJ,2014,349: g4852.
[32] Fontaine C, Mayorga C, Bousquet PJ, et al. Relevance of the determination of serum-specific IgE antibodies in the diagnosis of immediate beta-lactam allergy[J]. Allergy,2007,62: 47- 52.
[33] Torres MJ, Mayorga C, Cornejo-Garcia JA, et al. IgE antibodies to penicillin in skin test negative patients[J]. Allergy,2002,57: 965.
[34] Messaad D, Sahla H, Benahmed S, et al. Drug provocation tests in patients with a history suggesting an immediate drug hypersensitivity reaction[J]. Ann Intern Med,2004,140: 1001- 1006.
[35] Hjortlund J, Mortz CG, Skov PS, et al. Diagnosis of penicillin allergy revisited: the value of case history, skin testing, specific IgE and prolonged challenge[J]. Allergy,2013,68: 1057- 1064.
[36] Demoly P, Romano A, Botelho C, et al. Determining the negative predictive value of provocation tests with beta-lactams[J]. Allergy,2010,65: 327- 332.
[37] Padial A, Antunez C, Blanca-Lopez N, et al. Non-immediate reactions to beta-lactams: diagnostic value of skin testing and drug provocation test[J]. Clin Exp Allergy,2008,38: 822- 828.
[38] Torres MJ, Sanchez-Sabate E, Alvarez J, et al. Skin test evaluation in nonimmediate allergic reactions to penicillins[J]. Allergy,2004,59: 219- 224.
[39] Romano A, Blanca M, Torres MJ, et al. Diagnosis of nonimmediate reactions to beta-lactam antibiotics[J]. Allergy,2004,59: 1153- 1160.
[40] Sanchez-Sancho F, Perez-Inestrosa E, Suau R, et al. Synthesis, characterization and immunochemical evaluation of cephalosporin antigenic determinants[J]. J Mol Recognit,2003,16: 148- 156.
[41] Perez-Inestrosa E, Suau R, Montanez MI, et al. Cephalosporin chemical reactivity and its immunological implications[J]. Curr Opin Allergy Clin Immunol,2005,5: 323- 330.
[42] Pichichero ME. A review of evidence supporting the American Academy of Pediatrics recommendation for prescribing cephalosporin antibiotics for penicillin-allergic patients[J]. Pediatrics,2005,115: 1048- 1057.
[43] Madaan A, Li JT. Cephalosporin allergy[J]. Immunol Allergy Clin North Am,2004,24: 463- 476, vi-vii.
[44] Pichichero ME, Casey JR. Safe use of selected cephalosporins in penicillin-allergic patients: a meta-analysis[J]. Otolaryngol Head Neck Surg,2007,136: 340- 347.
[45] Minciullo PL, Cascio A, Barberi G, et al. Urticaria and bacterial infections[J]. Allergy Asthma Proc, 2014, 35: 295- 302.
[46] Li JT, Markus PJ, Osmon DR, et al. Reduction of vancomycin use in orthopedic patients with a history of antibiotic allergy[J]. Mayo Clin Proc,2000,75: 902- 906.
[47] Park M, Markus P, Matesic D, et al. Safety and effectiveness of a preoperative allergy clinic in decreasing vancomycin use in patients with a history of penicillin allergy[J]. Ann Allergy Asthma Immunol,2006,97: 681- 687.
[48] Sussman GL, Davis K, Kohler PF. Penicillin allergy: a practical approach to management[J]. CMAJ,1986,134: 1353- 1356.
[49] Joint Task Force on Practice P, American Academy of Allergy A, Immunology, et al. The diagnosis and management of anaphylaxis: an updated practice parameter[J]. J Allergy Clin Immunol,2005,115: S483- 523.
[50] Executive summary of disease management of drug hypersensitivity: a practice parameter. Joint Task Force on Practice Parameters, the American Academy of Allergy, Asthma and Immunology, the American Academy of Allergy, Asthma and Immunology, and the Joint Council of Allergy, Asthma and Immunology[J]. Ann Allergy Asthma Immunol,1999,83: 665- 700.
[51] Forrest DM, Schellenberg RR, Thien VV, et al. Introduction of a practice guideline for penicillin skin testing improves the appropriateness of antibiotic therapy[J]. Clin Infect Dis,2001,32: 1685- 1690.
[52] 邱勝康, 張峰義.盤尼西林過敏反應與盤尼西林皮膚測試之回顧與實務建議[J].內科學誌,2009,20:58- 69.
[53] 国家药典委员会.中华人民共和国药典临床用药须知:化学药和生物制品卷[M].2010版.北京:中国医药科技出版社,2010:627- 628.
[54] 陈新谦,金有豫,汤光.新编药物学[M].17版.北京:人民卫生出版社.2011:40.
[55] 汤光,李大魁.现代临床药物学[M].2版.北京:化学工业出版社,2008:2.
[56] 国家药典委员会.中华人民共和国药典二部[M]. 2015版.北京:中国医药科技出版社,2015:596- 600.