L-色氨酸分子印迹光子晶体水凝胶膜的制备及性能
2016-04-08杨兆昆张晓栋施冬健陈明清刘士荣
杨兆昆, 张晓栋, 施冬健, 陈明清, 刘士荣
(江南大学化学与材料工程学院, 食品胶体与生物技术教育部重点实验室, 无锡 214122)
L-色氨酸分子印迹光子晶体水凝胶膜的制备及性能
杨兆昆, 张晓栋, 施冬健, 陈明清, 刘士荣
(江南大学化学与材料工程学院, 食品胶体与生物技术教育部重点实验室, 无锡 214122)
摘要采用胶体晶体模板法, 借助“三明治”结构制备了可与基底剥离的分子印迹光子晶体水凝胶膜(MIPHs). 该MIPHs以L-色氨酸(L-Trp)为模板分子, 丙烯酰胺(AM)为功能单体, N,N′-亚甲基双丙烯酰胺(BIS)为交联剂, 在紫外光下引发聚合. 扫描电子显微镜(SEM)表征结果表明, MIPHs具有相互贯通的三维有序大孔结构. 制得的MIPHs在L-Trp的缓冲溶液中可快速响应, 当L-Trp的浓度从10-10mol/L增大到10-5mol/L时, MIPHs的Bragg衍射峰位移83 nm, 并伴有明显的颜色变化. 此外, MIPHs在L-Trp结构类似物L-酪氨酸(L-Tyr)和L-苯丙氨酸(L-Phe)的缓冲溶液中Bragg衍射峰位移较小, 表明制得的MIPHs具有良好的选择性.
关键词“三明治”结构; 反蛋白石; 光子晶体; 分子印迹; L-色氨酸
色氨酸(Tryptophan)是生命体系中蛋白质及其它生物活性物质必不可少的组成成分. 由于仅通过日常饮食摄取的色氨酸量不能满足人体的正常需求, 所以色氨酸常被添加于各种食品和药品中. 然而, 人体摄入过多色氨酸则可能引起恶心、食欲不振及有困意等不良反应[1~3]. 因此, 检测食品和药品中色氨酸的含量对于公众健康极其重要.
目前, 用于检测色氨酸的分析方法主要有高效液相色谱(HPLC)法[4]、毛细管电泳法(CE)[5]、荧光光谱法[6]和电化学方法[7~9]等, 这些方法虽然都具有一定的灵敏性和选择性, 但都需要复杂的仪器及繁琐的操作, 甚至需要专业人员来进行检测. 因此, 建立一种快速、灵敏、方便的现场检测手段具有重要的意义.
分子印迹凝胶光子晶体(MIPHs)是基于分子印迹技术与凝胶光子晶体技术相结合发展起来的. 分子印迹技术是研究制备具有特异性纳米识别空腔的分子印迹聚合物(MIPs)的技术手段[10]. 特异性纳米识别空腔与印迹分子在尺寸、形状以及功能团作用上相匹配, 使其可与混合物中待分离的印迹分子发生特异性的结合[11,12]. 凝胶光子晶体(HPCs)周期性的介电结构可使电磁波发生Bragg衍射, 当电磁波落在可见光波长范围内时, 凝胶光子晶体即呈现出裸眼可视的鲜艳的结构颜色[13]; 同时HPCs可对外界环境刺激响应而发生快速可逆的溶胀收缩, 进而引起结构颜色的变化[14~17]. MIPHs既具有MIPs特异性识别的特点, 又能维持HPCs对外界刺激响应而导致肉眼可视的颜色变化的性质. 因此, MIPHs有望用于实际环境中待分析物的快速、灵敏、特异性检测. Li等[18]率先制备了用于识别L-多巴(L-Dopa)的MIPHs. 此后, 用于检测食品中香兰素[19]、胆固醇[20]及脯氨酸[21]等的分子印迹凝胶光子晶体被相继制得. 但迄今尚未见文献报道用于色氨酸检测的MIPHs的制备.
本文制备了L-Trp分子印迹光子晶体水凝胶膜(L-MIPHs)和非印迹光子晶体水凝胶膜(NIPHs); 研究了L-MIPHs对L-Trp的特异响应性, 以及其对相应构型异构体和结构类似物的选择性. 结果表明, MIPHs不仅展现出快速响应及可重复使用的特点, 还具有肉眼可区分的颜色变化.
1实验部分
1.1试剂与仪器
L-色氨酸(L-Trp)、L-酪氨酸(L-Tyr)、L-苯丙氨酸(L-Phe)、丙烯酰胺(AM)和N,N′-亚甲基双丙烯酰胺(BIS)均为分析纯, 购自国药集团化学试剂有限公司; 2,2′-二乙氧基苯乙酮(DEAP)和D-色氨酸(D-Trp)均为分析纯, 购自百灵威科技有限公司; 聚苯乙烯微球乳液(PS, 自制). 供胶体晶体生长的玻璃片(76.2 mm×24.5 mm×1 mm)依次用丙酮、乙醇和超纯水超声清洗, 用氮气吹干, 备用.
紫外灯(365 nm, 125 W, 深圳市喜万年科技有限公司); FLA5000型光纤光谱仪(杭州晶飞科技有限公司); DSC-HX300型数码相机(日本SONY公司).
1.2聚苯乙烯(PS)胶体晶体的制备
参考文献[22], 采用无皂乳液聚合法制备单分散PS微球乳液(单分散系数<0.005), 配制成质量分数为1%的PS乳液. 采用垂直沉积法制备胶体晶体. 将上述配制好的PS乳液置于小烧杯中, 将处理过的玻璃片垂直插入乳液中, 将烧杯置于恒温恒湿箱(温度60 ℃, 湿度40%)中, 至水分完全挥发即得到PS胶体晶体.
1.3色氨酸分子印迹光子晶体水凝胶膜(L-MIPHs)的制备
将一定量的L-Trp, AM, BIS和DEAP溶于超纯水中, 制成前驱液, 通氮气10 min备用. 将石英玻璃片覆盖在胶体晶体表面, 将二者固定, 即得到“三明治”结构. 在“三明治”结构间隙中填充上述前驱液, 直至胶体晶体模板变为透明状态; 在冰浴中紫外光照射下光聚合2 h, 将聚合后的“三明治”结构浸入去离子水中, 使复合蛋白石膜自动脱落, 再将其置于二甲苯中24 h, 即得到反蛋白石凝胶光子晶体膜(MIPHs). 将MIPHs放入甲醇-乙酸(体积比9∶1)溶液中2 h以除去L-Trp分子, 即制得L-Trp分子印迹光子晶体水凝胶膜(L-MIPHs). Scheme 1示出了MIPHs的制备过程. 采用相同方法制得非印迹光子晶体水凝胶膜(NIPHs).

Scheme 1 Schematic illustration of the procedure for the preparation of L-MIPHs
1.4MIPHs的响应性
将MIPHs/NIPHs浸入待测分子(由低浓度到高浓度)缓冲溶液中30 s, 用光纤光谱仪记录Bragg衍射峰的位置(Bragg衍射光谱图显示的衍射峰强度均为相对值), 同时用数码相机拍摄相应的光学照片.
1.5MIPHs的响应速度和重复利用性
将MIPHs浸入10-5mol/L的L-Trp缓冲溶液中, 测定Bragg衍射峰位置随时间的变化, 即响应速度曲线. 然后将响应L-Trp的MIPHs浸于甲醇-乙酸溶液中2 min以除去吸附的L-Trp, 再用磷酸缓冲溶液洗涤, 其Bragg衍射峰位置即可恢复到初始水平531 nm, 证明L-Trp已经完全洗脱, MIPHs可用于下一轮测试.
2结果与讨论
2.1L-MIPHs的制备
MIPHs的制备主要包括3个连续步骤(见Scheme 1): (1) 在“三明治”结构的胶体晶体间隙中填入分子印迹预聚物, 紫外光引发聚合; (2) 浸入去离子水中得到可从基底剥离的复合蛋白石膜; (3) 除去PS胶球及印迹分子制得MIPHs. MIPHs制备的关键之一是在前驱液中形成分子印迹预聚物. 本反应中功能单体丙烯酰胺与色氨酸之间通过氢键相互作用可形成稳定的复合物; 然后, 通过光聚合过程将印迹分子固定在水凝胶网络中, 待将其洗脱后即形成与模板分子在形状、尺寸及功能团上相匹配的特异性识别纳米空腔. 此外, 在“三明治”结构中发生的毛细诱导驱使的前驱液填充可以有效减少最后制得的反蛋白石结构的覆盖以及胶体微球的滑动, 有助于得到高度有序的、双连续结构(相互贯穿的孔结构和相互连续的聚合物凝胶)的反蛋白石凝胶光子晶体. 图1(A)和(B)分别为制得的PS胶体晶体和反蛋白石凝胶光子晶体的扫描电子显微镜(SEM)照片, 可见制得的MIPHs具有相互贯穿且高度有序的三维大孔结构.

Fig.1 SEM images of PS colloidal crystals(A) and inverse opals of MIPHs(B)
2.2L-MIPHs的特异识别性
图2示出了L-MIPHs[n(L-Trp)∶n(AM)∶n(BIS)=0.3∶20∶1.2]对模板分子的传感性能. 由图2(A)可见,L-MIPHs在不同浓度(0, 10-10, 10-9, 10-8, 10-7, 10-6和10-5mol/L)的L-Trp缓冲溶液中具有尖锐的布拉格(Bragg)衍射峰, 且随着L-Trp浓度的增大, Bragg衍射峰位置发生红移, 最大红移达83 nm. 此外, 由图3可观察到MIPHs在不同浓度的L-Trp缓冲溶液中的颜色. 当将L-MIPHs浸入L-Trp缓冲溶液中时,L-Trp与L-MIPHs中的印迹空腔发生相互作用, 造成水凝胶溶胀, 使得光子晶体的晶格间距增大, 从而引起Bragg衍射峰位置的红移. NIPHs由于不具有印迹位点, 几乎不能吸附印迹分子, 因此响应性较差[图2(B)]. MIPHs这种肉眼可见的颜色变化为L-Trp的现场快速检测提供了可能.

Fig.2 Optical response of L-MIPHs(A) and NIPHs(B) upon soaking in L-Trp buffers c/(mol5L{-1): a. 0; b. 10{-10; c. 10{-9; d. 10{-8; e. 10{-7; f. 10{-6; g.10{-5.

Fig.3 Color change induced by the rebinding of L-Trp at different concentrations (A) Pure buffer; (B)—(G) concentration of L-Trp/(mol·L-1): 10-10, 10-9, 10-8, 10-7, 10-6, 10-5.
2.3印迹分子用量对L-MIPHs特异识别性的影响
由图4可见, 随着印迹分子用量的增加, MIPHs的Bragg衍射峰红移量增大. 这是由于随着前驱液中印迹分子浓度增大, 制得的L-MIPHs特异性纳米识别空腔增多, 将其置于印迹分子的缓冲溶液中时, 吸附的印迹分子的量增多, 导致水凝胶膜溶胀程度较大, 因此Bragg衍射峰红移量增大. 尽管印迹分子的用量对L-MIPHs的响应性有明显的影响, 但是由于Trp在水中溶解度的限制, 致使前驱液中印迹分子的用量并不能进一步增大.

Fig.4 Influence of of imprinting molecule content on the sensing property of L-MIPHsContent of L-Trp imprinted/(mmol5L{-1): a. 0; b. 0.1; c. 0.2; d. 0.3.
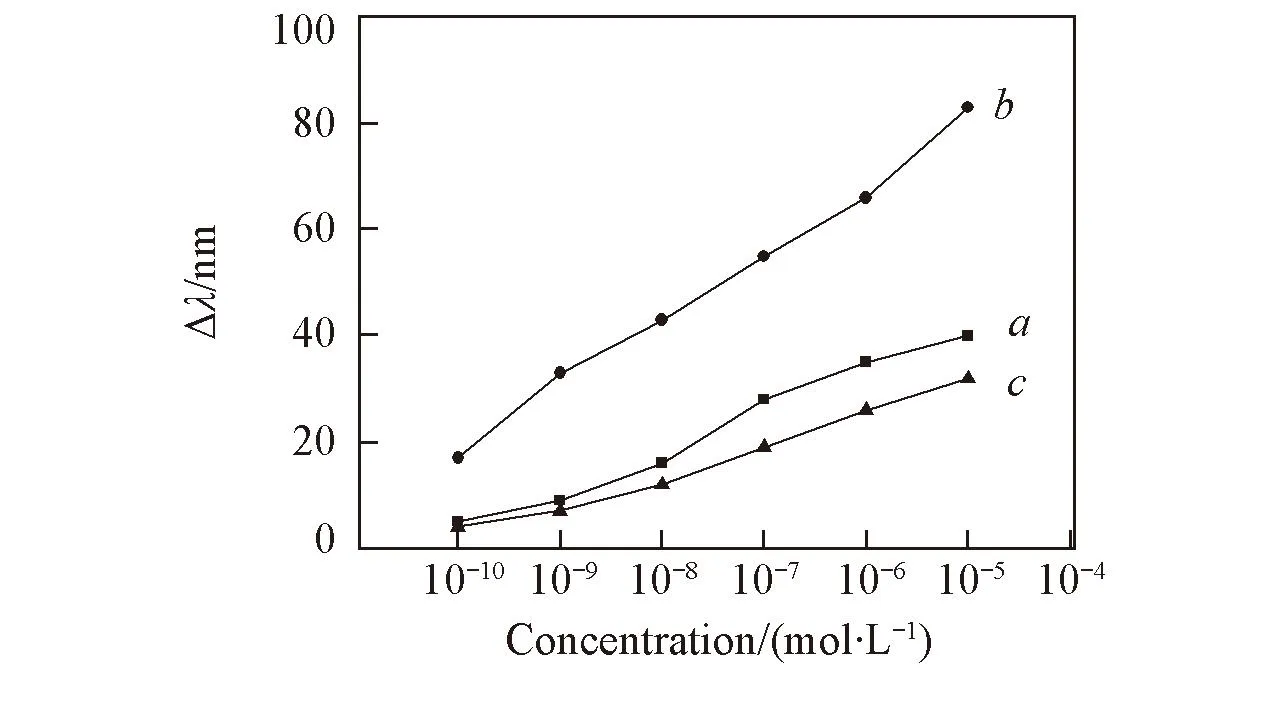
Fig.5 Influence of the crosslinking monomer(BIS) content on the sensing property of L-MIPHsn(BIS)∶n(AM): a. 4%; b. 6%; c. 8%.
2.4交联剂BIS用量对L-MIPHs特异识别性的影响
水凝胶中交联剂用量的不同会影响水凝胶三维网络的交联密度, 从而导致水凝胶溶胀程度的不同, 因此交联剂的用量可能影响L-MIPHs的传感性能. 图5示出了交联剂用量对L-MIPHs的传感性能的影响. 当交联剂BIS与AM的摩尔比为4%时, Bragg衍射峰位置的最大红移量为40 nm; 当二者摩尔比为8%时, Bragg衍射峰红移32 nm; 当二者摩尔比为6%时, Bragg衍射峰位移最大为83 nm. 这是由于交联剂用量较少时, 水凝胶的交联密度不足以维持印迹位点的形状, 将其置于L-Trp缓冲溶液中时吸附的印迹分子量相对较少, 从而导致水凝胶溶胀程度较小, 使得Bragg衍射峰位移较少. 这也说明MIPHs的溶胀是由于其吸附了印迹分子引起的. 而当交联剂用量较大时, 水凝胶交联密度过大, 造成印迹位点刚性较强, 使其不容易吸附印迹分子, 将交联剂用量不同的L-MIPHs置于相同浓度印迹分子缓冲溶液中时, 交联密度过大的L-MIPHs吸附的印迹分子相对较少, 因此其Bragg衍射峰位移量就相对较小.
2.5L-MIPHs的选择性
图2和图3结果表明MIPHs可对印迹分子产生响应, 并伴有裸眼可见的颜色变化. 但是, 评价MIPHs的分子印迹效应还需检测其对结构类似物的选择性. 由图6可以看出,L-MIPHs在不同浓度的L-Tyr和L-Phe缓冲溶液中Bragg衍射峰位移较小, 说明L-MIPHs对印迹分子的结构类似物具有良好的选择性, 这是因为印迹空腔形状记忆效应导致其更容易吸附印迹分子而引起水凝胶膜溶胀程度较大, 而对其它2种结构类似物的吸附则较少. 但是,L-MIPHs对D-Trp缓冲溶液的传感性能与对L-Trp的响应性能差别不大[图6(C)], 说明制得的L-MIPHs尚不能很好地区分印迹分子的2种立体异构体. 有关构型异构体的识别有待进一步研究.
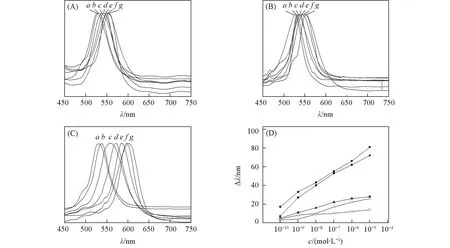
Fig.6 Selectivity of L-MIPHs to L-Tyr(A), L-Phe(B), D-Trp(C) and plots of Bragg diffraction peak shifts for L-MIPHs to L-Trp(■), D-Trp(●), L-Tyr(▲), L-Phe(△) and NIPHs to L-Trp(□)(D)c/(mol5L{-1): a. 0; b. 10{-10; c. 10{-9 ; d. 10{-8; e. 10{-7; f. 10{-6; g. 10{-5.
2.6L-MIPHs的响应速度和重复利用性
L-MIPHs的三维有序大孔结构有利于传质过程, 使其可以快速产生响应. 图7(A)示出了L-MIPHs在L-Trp缓冲溶液中的响应速度. 可见,L-MIPHs的布拉格(Bragg)衍射峰在30 s时达到最大, 此后衍射峰不再随时间变化, 说明L-MIPHs在30 s时已经吸附饱和. 图7(B)示出了L-MIPHs循环使用5次后的响应结果, 可见制得的L-MIPHs具有良好的重复利用性. 此结果表明, 合适的交联可使制得的L-MIPHs具有良好的物理和化学稳定性.
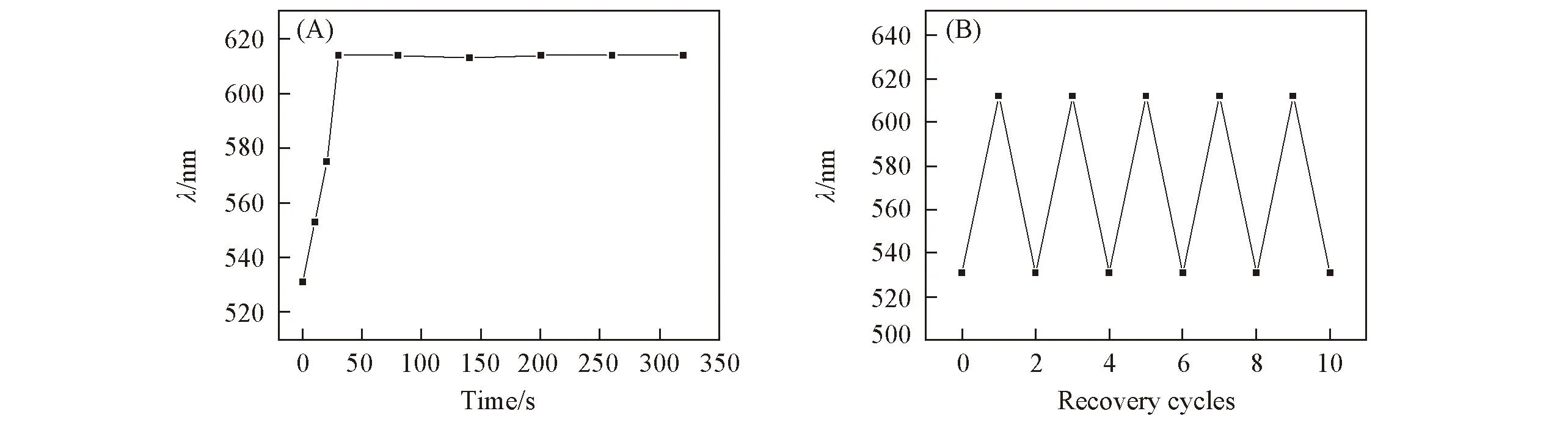
Fig.7 Kinetic response of L-MIPHs when immersed into 10-5 mol/L L-Trp buffers(A) and recoverability of MIPHs incubated in 10-5 mol/L L-Trp buffers and then recovered in deionized water(B)
3结论
采用光引发聚合方法, 借助“三明治”结构制备了可与基底分离的分子印迹光子晶体水凝胶膜(MIPHs). 制备的MIPHs具有高选择性、快速响应及自表达的特点, 还具有优异的循环使用性能. MIPHs能选择性地识别L-Trp, 并将特异性的识别作用转换成可读的光学信号. 此外, 无需依赖任何基底的水凝胶膜在现场检测中应用更加方便.
[1]Tao Y., Dai J., Kong Y., Sha Y.,Anal.Chem., 2014, 86(5), 2633—2639
[2]Raoof J. B., Ojani R., Karimi-Maleh H.,Electroanalysis, 2008, 20(11), 1259—1262
[3]Wang H., Zhou Y., Guo Y., Liu W., Dong C., Wu Y., Li S., Shuang S.,SensorsandActuatorsB:Chemical, 2012, 163(1), 171—178
[4]Yamada K., Miyazaki T., Shibata T., Hara N., Tsuchiya M.,J.Chromatogr.B, 2008, 867(1), 57—61
[5]Ilisz I., Fodor G., Ivanyi R., Szente L., Toth G., Peter A.,J.Chromatogr.B, 2008, 875(1), 273—279
[6]Reynolds D. M.,WaterResearch, 2003, 37(13), 3055—3060
[7]Tang X. F., Liu Y., Hou H. Q., You T. Y.,Talanta, 2010, 80(5), 2182—2186
[8]Shahrokhian S., Fotouhi L.,SensorsandActuatorsB:Chemical, 2007, 123(2), 942—949
[9]Zanini V. I. P., Gimenez R. E., Perez O. E. L., de Mishima B. A. L., Borsarelli C. D.,SensorsandActuatorsB:Chemical, 2015, 209(2015), 391—398
[10]Haupt K., Mosbach K.,Chem.Rev., 2000, 100(7), 2495—2504
[11]Chen F. Q., Liu S. X., Fang Y., Wang Y. J., Zhang Z. Y., Jiang Y.,Chem.J.ChineseUniversities, 2007, 28(11), 2195—2199(陈奋强, 刘守信, 房喻, 王艺娟, 张朝阳, 姜宇. 高等学校化学学报, 2007, 28(11), 2195—2199)
[12]Gai Q. Q., Liu Q. Y., Li W. Y., He X. W., Chen L. X., Zhang Y. K.,Chem.J.ChineseUniversities, 2008, 29(1), 64—70(盖轻轻, 刘秋叶, 李文友, 何锡文, 陈朗星, 张玉奎. 高等学校化学学报, 2008, 29(1), 64—70)
[13]Asher S. A., Holtz J., Liu L., Wu Z. J.,J.Am.Chem.Soc., 1994, 116(11), 4997—4998
[14]Wang J. Y., Hu Y. D., Deng R. H., Liang R. J., Li W. K., Liu S. Q., Zhu J. T.,Langmuir, 2013, 29(28), 8825—8834
[15]Shao M., Qiao X. G., Fu H. W., Li H. D., Zhao J. L., Li Y.,OpticsandLasersinEngineering, 2014, 52, 86—90
[16]Tou Z. Q., Koh T. W., Chan C. C.,SensorsandActuatorsB:Chemical, 2014, 202, 185—193
[17]Fenzl C., Genslein C., Zopfl A., Baeumner A. J., Hirsch T.,J.Mater.Chem.B, 2015, 3(10), 2089—2095
[18]Hu X. B., An Q., Li G. T., Tao S. Y., Liu B.,Angew.Chem.Int.Ed., 2006, 45(48), 8145—8148
[19]Peng H., Wang S., Zhang Z., Xiong H., Li J., Chen L., Li Y.,J.Agric.FoodChem., 2012, 60(8), 1921—1928
[20]Li J., Zhang Z., Xu S., Chen L., Zhou N., Xiong H., Peng H.,J.Mater.Chem., 2011, 21(48), 19267—19274
[21]Zhang Y. L.,Pan Z., Yuan Y. X., Sun Z. M., Ma J. H., Huang G. B., Xing F. B., Gao J. P.,Phys.Chem.Chem.Phys., 2013, 15, 17250—17256
[22]Liu H., Shi D., Duan F., Yang Z., Chen M., Liu S.,Mater.Lett., 2015, 150, 5—8
Preparation and Characterization ofL-Tryptophan
Molecularly Imprinted Photonic Hydrogels†
YANG Zhaokun, ZHANG Xiaodong, SHI Dongjian, CHEN Mingqing, LIU Shirong*
(SchoolofChemicalandMaterialEngineering,TheKeyLaboratoryofFoodColloidsandBiotechnology,
MinistryofEducation,JiangnanUniversity,Wuxi214122,China)
AbstractFree-standing molecularly imprinted photonic hydrogels(MIPHs) that peeled from the supporters were prepared using the colloidal crystal template method assisted by “sandwich structure”. MIPHs were fabricated by UV polymerization withL-Tryptophan(L-Trp) as template molecule, acrylamide(AM) as functional monomer,N,N′-methylene bisacrylamide(BIS) as crosslinking agent. MIPHs were characterized by highly ordered three-dimensional interconnected macroporous structure. MIPHs showed rapid response property when immersed intoL-Trp buffers. The Bragg diffraction peak of MIPHs redshifted 83 nm as the concentration ofL-Trp increased from 10-10mol/L to 10-5mol/L, and the color changes could be visible by the naked eyes. Moreover, MIPHs showed only a slight shift in the Bragg diffraction peak in solutions ofL-Tyr orL-Phe, which indicated that MIPHs possessed a certain selectivity. High selectivety, rapid response and signal self-reporting of MIPHs might provide great convenience for the application in the real-world environments.
Keywords“Sandwich” structure; Inverse opal; Photonic crystal; Molecularly imprinted;L-Tryptophan
(Ed.: N, K)
† Supported by the National Natural Science Foundation of China(No.51173072).
doi:10.7503/cjcu20150513
基金项目:国家自然科学基金(批准号: 51173072)资助.
收稿日期:2015-06-01. 网络出版日期: 2015-11-17.
中图分类号O658; O648.1
文献标志码A
联系人简介: 刘士荣, 男, 副教授, 主要从事功能材料研究. E-mail: liushirong1@aliyun.com
