脱除阿魏酸后车前子多糖的溶液性质、构象特征及固体形貌
2016-04-08殷军艺刘晓莹聂少平谢明勇
殷军艺, 刘晓莹, 聂少平, 谢明勇
(南昌大学食品科学与技术国家重点实验室, 南昌 330047)
脱除阿魏酸后车前子多糖的溶液性质、构象特征及固体形貌
殷军艺, 刘晓莹, 聂少平, 谢明勇
(南昌大学食品科学与技术国家重点实验室, 南昌 330047)
摘要分别采用NaOH和阿魏酸酯酶对车前子多糖(PLCP)进行脱除阿魏酸处理, 得到的多糖分别记为PLCP-FAS和PLCP-FAE. 通过基本理化性质测定和单糖组成分析比较了处理前后多糖的基本结构特征, 并采用乌式黏度计、高效体积排阻色谱(HPSEC)和扫描电子显微镜(SEM)等方法表征了多糖的溶液性质、构象特征及固体形貌. 结果表明, 经NaOH或阿魏酸酯酶处理后多糖的单糖组成基本不变, 但糖含量和糖醛酸含量增加, 表观黏度显著下降; PLCP-FAS和PLCP-FAE在0.1 mol/L NaCl和0.5 mol/L NaOH中的特性黏度基本相同; HPSEC分析结果表明, PLCP-FAE的重均分子量(Mw)为3.17×106, PLCP-FAS的Mw为2.83×106, PLCP-FAS和PLCP-FAE的持续围长值一致, 但相同分子量下PLCP-FAS的特性黏度低于PLCP-FAE; SEM测定结果显示, PLCP-FAS和PLCP-FAE仍保留一定线性链特征. 上述结果表明, 脱除阿魏酸的大粒车前子多糖呈现半柔顺链的构象特征, 样品固体形貌仍保留一定的线性链特征.
关键词车前子; 多糖; 阿魏酸; 溶液性质; 构象特征
车前子为车前(PlantagoasiaticaL., 又称大粒车前子)或平车前(PlantagodepressaWilld.)的干燥成熟种子, 主要产自江西、河南[1], 可用作保健食品. 车前子除了含有苯乙醇苷类化合物外[2], 还含有大量黏液质, 具有抗氧化[3,4]、免疫调节[5,6]和提升肠道健康[7,8]等功能. 大粒车前子富含阿拉伯糖和木糖, 主链由β-1,4-linked Xylp顺序连接组成, 大量阿拉伯糖和木糖残基分布在支链上, 同时支链上带有部分GlcA[9,10]. 前文[11]研究表明, 阿魏酸对于维持大粒车前子高黏性和弱凝胶特征起重要作用, 采用NaOH脱除车前子多糖中的阿魏酸后多糖黏度显著下降. 对于和车前子多糖具有相似结构的阿拉伯木聚糖, 其高黏性特征通常与其支链末端Ara上存在的阿魏酸密切相关, 多糖链间的阿魏酸通过交联等作用赋予了阿拉伯木聚糖独特的分子结构和理化特征[12~14]. 阿拉伯木聚糖类多糖通常呈现出半柔顺链的构象特征[15~17], 其支链上的阿拉伯糖取代度对该类型多糖构象特征的影响很小[15,18], 而多糖上的阿魏酸对其构象有一定影响[19], 迄今未见关于阿魏酸和阿拉伯木聚糖溶液、构象特征之间相互作用关系的报道. 大粒多糖为阿拉伯木聚糖, 含有一定量的阿魏酸, 本文通过碱法或者酶法脱除车前子多糖上的阿魏酸, 表征了脱除阿魏酸后多糖溶液的构象特征, 进而分析了脱除阿魏酸前后的车前子多糖在结构和构象特征等方面的变化, 以期为车前子多糖高黏度性质提供更科学、合理的解释.
1实验部分
1.1试剂与仪器
大粒车前子产自江西省吉安市; 单糖标准品葡萄糖(Glucose)、鼠李糖(Rhamnose)、岩藻糖(Fucose)、阿拉伯糖(Arabinose)、木糖(Xylose, Xyl)、甘露糖(Mannose)和半乳糖(Galactose)购自德国Merck公司/美国Sigma化学制剂公司; 阿魏酸酯酶购自爱尔兰Megazyme公司; 其它试剂均为分析纯.
ICS 500型离子色谱仪(美国Dionex公司); 高效体积排阻色谱(HPSEC)系统包括Wyatt D05SFD01泵、Dawn Heleos型多角度激光光散射检测器、OPTILAB T-rEX示差检测器和Visco Star Ⅱ型黏度检测器(美国Wyatt公司), 色谱柱为Ohpak SB-G保护柱(8 mm×50 mm)、Ohpak SB-806 HQ型色谱柱和Ohpak SB-804 HQ型色谱柱(日本Showa Denko公司) 串联使用; ALPHA 1-2型冷冻干燥机(德国Martin Christ公司); Milli-Q 超纯水仪(美国Millipore公司); ARES流变仪(美国TA公司); 透析袋(截留分子量8000~10000); QUANTA 200F扫描电子显微镜(美国FEI公司).
1.2实验过程
1.2.1多糖样品的制备参考文献[10]方法制备车前子精制多糖(PLCP). 称取1.0 g PLCP溶解于50 mL水中, 加入150 mL 5 mg/mL NaBH4的NaOH溶液(终浓度为2.0 mol/L), 在N2气保护下搅拌4 h, 用盐酸调节pH值至1.5以下, 加入300 mL无水乙醚萃取3次. 将萃取后的多糖溶液减压浓缩, 经透析、冻干得到脱除阿魏酸后的车前子多糖PLCP-FAS(收率63%).
称取1.0 g PLCP溶解于300 mL磷酸钠缓冲液(0.1 mol/L)中, 加入50 μL 0.39 mmol/L阿魏酸酯酶, 于40 ℃反应3 h后, 透析、离心收集上层清液, 经浓缩、冻干得到多糖PLCP-FAE(收率89%).
1.2.2测试与表征以Xyl为标准品, 采用苯酚-硫酸法测定总糖含量[20]; 以葡萄糖醛酸为标准品, 采用改良硫酸-咔唑法测定糖醛酸含量[21]; 以牛血清白蛋白为标准品, 采用考马斯亮蓝法测定蛋白含量[22]. 取一定量多糖加入2 mol/L H2SO4中, 于100 ℃水解2 h后, 用离子色谱仪测定单糖组成[23].
利用乌氏黏度计分别测定PLCP-FAS和PLCP-FAE在水溶液、0.1 mol/L NaCl溶液和0.5 mol/L NaOH溶液中的特性黏度, 测试温度为25.0 ℃. 依据Huggins和Kramer公式计算特性黏度
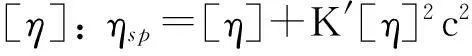
(1)
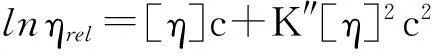
(2)
式中,ηsp为表观黏度,ηrel为相对黏度,c为待测物浓度,k为常数, 通过浓度外推法可计算得到
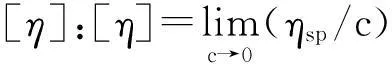
(3)
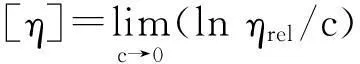
(4)
HPSEC测定: 将PLCP-FAS和PLCP-FAE溶解在0.1 mol/L NaNO3溶液中(含0.2 mg/mL NaN3), 室温下搅拌溶解12 h以上(样品浓度为0.5 mg/mL), 然后用0.45 μm滤膜过滤. 以0.1 mol/L NaNO3为流动相(含0.2 mg/mL NaN3), 流速为0.6 mL/min, 进样量100 μL进行HPSES测定. 示差折光指数浓度增量(dn/dc)值取0.146. 以Mw为40000的葡聚糖(Dextran)为标样对仪器进行归一化处理. 采用Wyatt公司ASTRA软件(6.1.1.84)采集和分析数据.
2结果与讨论
2.1基本理化性质和单糖组成分析
PLCP经脱除阿魏酸处理后的基本理化性质和单糖组成结果如表1所示. 与原有样品相比[11], 多糖脱除阿魏酸后糖含量和糖醛酸含量显著上升, 但主要单糖组成种类和相对比例几乎无变化, 特别是阿拉伯糖(Arabinose)和木糖(Xylose)的比例基本稳定, 说明无论是用NaOH还是阿魏酸酯酶处理, 多糖主要结构均未发生显著变化. 但是多糖经脱除阿魏酸处理后, 阿魏酸之间的交联作用以及阿魏酸与Ca2+的相互作用消失, 导致多糖黏度急剧下降(图S1~图S3, 见本文支持信息).

Table 1 Physicochemical properties and monosaccharide compositions of PLCP-FAS and PLCP-FAE*
* ND: Not determined.
2.2特性黏度分析
特性黏度用于衡量给定溶剂中被单独的聚合物链所占据的流体体积. PLCP-FAS和PLCP-FAE在不同溶剂中的特性黏度存在一定差异, 如PLCP-FAS和PLCP-FAE在纯水中特性黏度最高, 分别达到43.68和32.94 dL/g, 当2个组分溶解于0.1 mol/L NaCl溶液中时, 由于Na+可以消除多糖中酸性电荷引起的排斥作用, 致使多糖的特性黏度降低(均为3.45 dL/g). 在0.5mol/L NaOH溶液中, PLCP-FAS和PLCP-FAE的特性黏度则分别降至2.64和2.68 dL/g.
2.3HPSEC检测
HPSEC-激光光散射仪联用称为绝对方法, 除可得到Mw, 还能得到多分散指数(Mw/Mn)和均旋转半径(Rg)等构象参数[24], PLCP-FAE和PLCP-FAS的HPSEC测定结果见表2(HPSEC色谱图见图S4和图S5, 见本文支持信息). 由HPSEC结果可知, PLCP-FAS的Mw大于PLCP-FAE, PLCP-FAS的多分散指数(Mw/Mn)和PLCP-FAE相当, 但二者的Mw和Mn均小于PLCP[25]. PLCP-FAE和PLCP-FAS的样品回收率较高, 与其它来源的小分子量阿拉伯木聚糖在HPSEC测试中的数值接近[15,16].

Table 2 Analysis results of PLCP-FAS and PLCP-FAE from HPSEC*
* Injection volume: 100 μL; flow rate: 0.6 mL/min; sample concentration: 0.5 mg/mL; mobile phase: 0.1 mol/L NaNO3containing 0.2 mg/mL NaNO3.Rg: Mean-square radius of gyration;Rh: hydrodynamic radius.
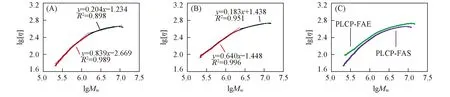
Fig.1 Logarithmic plot of molecular weight against intrinsic viscosity of PLCP-FAS(A), PLCP-FAE(B) and wmbination(C)
由Mark-Houwink经验公式([η]=KMα, 其中K和α是经验常数, 随聚合物的种类、溶剂以及测定温度不同而呈现一定差异)可知, 在一个特定溶剂中测定的特性黏度与相对分子质量M有关. 对于线性无规卷曲多糖, 指数α介于0.5~0.8之间, 且随着链条刚性的增加而增大. 对于PLCP-FAS, 在低分子量(占总数的50%)和高分子量区域(占总数的47%)的α值分别为0.84和0.20, 而PLCP-FAE在低分子量(占总数的70%)和高分子量区域(占总数的26%)的α值分别为0.64和0.18(见图1). 通过蠕虫状链模型(Bohdanecky模型)可分析PLCP-FAS和PLCP-FAE的构象参数, 伸展无规线团的(M2/[η])1/3和M1/2存在以下线性关系[26,27]
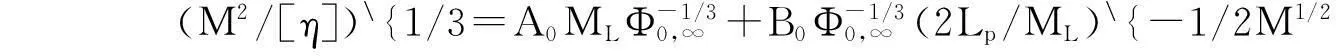
(5)
式中:M为HPSEC测得的相对分子质量; [η]为每个级分对应的特性黏度;ML为单位围长摩尔质量;Lp为持续围长;A0和B0为常数[25];Φ0,∞=2.86×1023mol-1;ML取值为420 g/(mol·nm). PLCP-FAS和PLCP-FAE的Bohdanecky拟合图见图2, 通过计算得到PLCP-FAS和PLCP-FAE的Lp值均为2.1 nm. 持续围长Lp的大小常用于衡量多糖链刚性结构的强弱, 如非常柔顺的普鲁兰的Lp介于1.2~1.9 nm之间, 而刚性结构非常强的黄原胶的Lp可达到100~150 nm[17], 通过HPSEC测试计算得到PLCP-FAS和PLCP-FAE的持续围长Lp均为2.1 nm, 说明脱除阿魏酸后的多糖表现出半柔顺链构象特征, 文献[15~17]也报道阿拉伯木聚糖类多糖通常呈现出半柔顺链的构象特征.
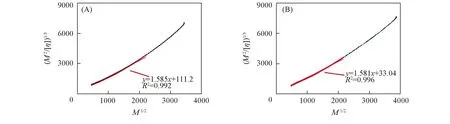
Fig.2 Bohdanecky plot of PLCP-FAS(A) and PLCP-FAE(B) in 0.1 mol/L NaNO3
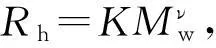
2.4SEM表征
采用SEM表征了脱除阿魏酸后车前子多糖的形态变化情况, 结果如图3所示. 在未脱除阿魏酸之前, 车前子多糖PLCP基本上呈现线性形态, 存在少量无规则卷曲结构[10]. 由图3(A)可见, PLCP-FAS基本上表现为短小的细丝状链结构, 有少部分链上出现圆形或椭圆形节点. 而PLCP-FAE还能观察到细丝状链构象, 但链的直径大小不一, 重要的是多糖链上出现了大量的圆形或椭圆形节点[图3(B)]. 上述结果表明, 车前子多糖脱除阿魏酸后, 多糖链的形貌发生了一定变化.

Fig.3 SEM images of PLCP-FAS(A) and PLCP-FAE(B)
综上所述, 分别采用NaOH和阿魏酸酶对车前子多糖PLCP进行脱除阿魏酸处理, 制得多糖PLCP-FAS和PLCP-FAE. 与PLCP相比, PLCP-FAS和PLCP-FAE的结构特征未发生明显改变, 但其表观黏度和特性黏度数值显著降低, 同时相对分子质量和可持续围长等值也有一定程度的降低. PLCP-FAS和PLCP-FAE呈现半柔顺链的构象特征, 二者的固体形貌发生了改变, 但均仍保留一定的线性链特征.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20150513.
参考文献
[1]State Pharmacopoeia Committee,People’sRepublicofChinaCodex(FirstSection), China Medical Sciences Press, Beijing, 2010, 63(国家药典委员会. 中华人民共和国药典(一部), 北京: 中国医药科技出版社, 2010, 63)
[2]Li L., Liu C. M., Chen Z. J., Wang J., Shi D. F., Liu, Z. Q.,Chem.Res.ChineseUniversities, 2009, 25(6), 817—821
[3]Ye C. L., Hu W. L., Dai D. H.,Int.J.Biol.Macromol., 2011, 49(4), 466—470
[4]Yin J. Y., Nie S. P., Zhou C., Wan Y., Xie M. Y.,J.Sci.FoodAgric., 2010, 90, 210—217
[5]Huang D. F., Tang Y. F., Nie S. P., Wan Y., Xie M. Y., Xie X. M.,Eur.J.Pharmacol., 2009, 620(1—3), 105—111
[6]Huang D. F., Nie S. P., Jiang L. M., Xie M. Y.,Int.Immunopharmacol., 2014, 18, 236—243
[7]Hu J. L., Nie S. P., Wu Q. M., Fu Z. H., Gong J., Cui S. W., Xie M. Y.,J.Agric.FoodChem., 2014, 62, 229—234
[8]Hu J. L., Nie S. P., Li C., Fu Z. H., Xie M. Y.,J.Agric.FoodChem., 2013, 61, 6092—6101
[9]Yin J. Y., Li C., Nie S. P., Xie M. Y.,Chem.J.ChineseUniversities, 2013, 34(12), 2728—2733(殷军艺, 李昌, 聂少平, 谢明勇. 高等学校化学学报, 2013, 34(12), 2728—2733)
[10]Yin J. Y., Lin H. X., Li J., Cui S. W.,Carbohydr.Polym., 2012, 87, 2416—2424
[11]Yin J. Y., Nie S. P., Li J., Cui S. W.,J.Agric.FoodChem., 2012, 60(32), 7981—7987
[12]Izydorczyk M. S., Biliaderis C. G.,J.Agric.FoodChem., 1992, 40, 561—566
[13]Carvajal-Millan E., Landillon V., Morel M. H., Rouau X., Doublier J. L., Micard V.,Biomacromolecules, 2005, 6, 309—317
[14]Kale M. S., Hamaker B. R., Campanella O. H.,FoodHydrocolloids, 2013, 31, 121—126
[15]Pitkänen L., Liisa V., Tenkanen M., Tuomainen P.,Biomacromolecules, 2009, 10, 1962—1969
[16]Pitkänen L., Tuomainen P., Virkki L., Aseyew V., Tenkanen M.,J.Agric.FoodChem., 2008, 56, 5069—5077
[17]Guo Q. B., Wang Q., Cui S. W., Kang J., Hu X. Z., Xing X. H., Yada R. Y.,FoodHydrocolloids, 2013, 32, 155—161
[18]Dervilly P. G., Thibault J. F., Saulnier L.,Carbohydr.Res., 2001, 330, 365—372
[19]Dervilly P. G., Saulnier L., Thibault J. F.,J.Agric.FoodChem., 2000, 48, 270—278
[20]Dubois M., Gilles K. A., Hamilton J. K., Rebers P. A., Smith F.,Anal.Chem., 1956, 28(3), 350—356
[21]Blumenkrantz N., Asboe H. G.,Anal.Biochem., 1973, 54, 484—489
[22]Bradford M. M.,Anal.Biochem., 1976, 72, 248—254
[23]Cui W., Wood P. J., Blackwell B., Nikiforuk J.,Carbohydr.Polym., 2000, 41, 249—258
[24]Li S., Xu S. Q., Zhang L. N.,ActaPolymericaSinica, 2010, (12), 1359—1375(李盛, 许淑琴, 张俐娜. 高分子学报, 2010, (12), 1359—1375)
[25]Yin J. Y., Nie S. P., Guo Q. B., Wang Q., Cui S. W., Xie M. Y.,Carbohydr.Polym., 2015, 124, 331—336
[26]Bohdanecky M.,Macromolecules, 1983, 16, 1483—1492
[27]Chen J. H., Zhang L. N., Yu D.S., Zhu R. P.,Chem.J.ChineseUniversities, 2000, 21(6), 961—964(陈敬华, 张俐娜, 余登寿, 朱荣萍. 高等学校化学学报, 2000, 21(6), 961—964)
Solution, Conformational Properties and Morphology of Psyllium
Polysaccharide with Ferulic Acid Removal†
YIN Junyi, LIU Xiaoying, NIE Shaoping, XIE Mingyong*
(StateKeyLaboratoryofFoodScienceandTechnology,NanchangUniversity,Nanchang330047,China)
AbstractThis study was aimed at investing the solution and conformation properties of polysaccharide from psyllium(or seeds ofPlantagoasiaticaL.). The fraction which was subjected with NaOH to remove ferulic acid was named as PLCP-FAS, while another fraction was PLCP-FAE whose ferulic acid was removed by feruloyl esterase. Ubbelohde capillary viscometer, HPSEC with refractive index, light scattering and viscometric detectors and scanning electron microscope(SEM) were applied to investigate the two fractions’ solution, conformation properties and solid form. The results showed that there was little change in monosaccharide compositions of the polysaccharide after ferulic acid removing, not mater by NaOH or enzyme. Sugar contents and uronic acid contents were much higher both for the two fractions. However, its apparent viscosity reduced remarkably. Intrinsic viscosity of PLCP-FAS and PLCP-FAE were close either in 0.1 mol/L NaCl or 0.5 mol/L NaOH. HPSEC analysis results showed that weight average molecular weight of PLCP-FAS was 3.17×106, while it was 2.83×106for PLCP-FAE. Persistence length of PLCP-FAS and PLCP-FAE were similar. SEM results showed that both PLCP-FAE and PLCP-FAS still exhibited certain linear chain characteristics. The above results indicated that the psylliun polysaccharide after removing ferulic acid was semi flexible, and morphology of the polysaccharide remained some linear chain characteristics.
KeywordsPsyllium; Polysaccharide; Ferulic acid; Solution property; Conformation characteristic
(Ed.: P, H, S, K)
† Supported by the National Natural Science Foundation of China(Nos.31301434, 21564007), the National Key Technology Research and Development Program of China for the 12th Five-year Plan(No.2012BAD33B06), the Research Fund for the Doctoral Program of Higher Education of China(No.20133601120009) and the Natural Science Foundation of Jiangxi Province, China(No.20142BAB214004).
doi:10.7503/cjcu20150490
基金项目:国家自然科学基金(批准号: 31301434, 21564007)、“十二五”国家科技支撑计划项目(批准号: 2012BAD33B06)、教育部高等学校博士学科点专项科研基金(批准号: 20133601120009)和江西省自然科学基金(批准号: 20142BAB214004)资助.
收稿日期:2015-07-01. 网络出版日期: 2015-12-20.
中图分类号O629.12
文献标志码A
联系人简介: 谢明勇, 男, 博士, 教授, 博士生导师, 主要从事食品化学和营养学研究. E-mail: myxie@ncu.edu.cn
