化痰活血方对哮喘小鼠IL-17A和IL-13的影响
2016-04-06何丽霞吴赛春李秀存凃苑青李满萍童晓云暨南大学药学院广东广州5063云南中医学院第一附属医院云南昆明6500云南中医学院药学院云南昆明650500
何丽霞, 吴赛春, 李秀存, 凃苑青, 曾 静, 李满萍, 杨 丽, 童晓云,黄 丰(.暨南大学药学院,广东广州5063;.云南中医学院第一附属医院,云南昆明6500;3.云南中医学院药学院,云南昆明650500)
化痰活血方对哮喘小鼠IL-17A和IL-13的影响
何丽霞1, 吴赛春1, 李秀存1, 凃苑青1, 曾 静1, 李满萍1, 杨 丽1, 童晓云2,黄 丰3*
(1.暨南大学药学院,广东广州510632;2.云南中医学院第一附属医院,云南昆明650021;3.云南中医学院药学院,云南昆明650500)
摘要:目的 研究化痰活血方(川芎、当归、白芍等)对哮喘小鼠支气管肺泡灌洗液(BALF)中白细胞介素IL-17A、IL-13和肺组织血管内皮生长因子-2(VEGFI2)表达的影响。方法 小鼠用卵清蛋白(OVA)腹腔注射致敏,并予2% OVA雾化吸入激发的方式建立哮喘小鼠模型,HE染色观察肺组织病理炎症,PAS染色观察肺组织杯状细胞增生情况,酶联免疫法(ELISA)测定BALF中细胞因子IL-17A和IL-13的量,免疫印迹法(Western b1ot)测定蛋白VEGFI 2在肺组织中的表达。结果 哮喘组肺部的炎症评分、杯状细胞增生、BALF中IL-17A和IL-13与蛋白VEGFI2的量均明显高于正常组(P<0.05,P<0.01)。与哮喘组比较,化痰活血方组小鼠肺组织病理炎症和杯状细胞增生均减轻,BALF中IL-17A和IL-13的量降低(P<0.05,P<0.01),而肺组织中蛋白VEGFI2的表达无明显变化(P>0.05)。结论 化痰活血方可能通过调节IL-17A和IL-13途径来缓解哮喘小鼠症状。
关键词:化痰活血方;哮喘;IL-17A;IL-13;支气管肺泡灌洗液(BALF);卵清蛋白(OVA)
KEY W 0 RDS:Huatan Huoxue Decoction;asthma;IL-17A;IL-13;bronchoa1veo1ar 1avage f1uid(BALF);ova1bumin(OVA)
支气管哮喘是一种复杂的慢性气道炎症疾病,特点主要有气道阻塞、气道炎症细胞浸润和气道高反应性等。研究资料表明,支气管哮喘患者BALF 中IL-17和哮喘小鼠BALF中IL-13含有量均显著升高[1-2]。本课题组前期初步发现,化痰活血方对哮喘小鼠的治疗作用可能与调节其辅助性T细胞Th1/Th2的失衡有关。文献研究报道,哮喘的发病除与Th1/Th2失衡相关外,Foxp3+Treg/Th17失衡在哮喘病程中也发挥着重要作用[3]。鉴于此,为了进一步研究化痰活血方治疗作用可能存在的机制,本实验测定哮喘小鼠BALF中IL-17A、IL-13含有量及肺组织中相关蛋白VEGFI 2表达的变化。
1 材料和方法
1.1 动物 雌性Ba1b/c小鼠,体质量18~22 g,广东省医学实验动物中心提供,许可证号SCXK(粤)2008-0002。1.2 药物和试剂 化痰活血方由川芎、当归、白芍、桃仁、红花、熟地黄、(白)芥子、苏子、莱菔子组成,购于广州林和药业连锁有限公司祥安药店,并由其代煎浓缩成每1 mL含生药3 g,置4℃冰箱储存备用。醋酸地塞米松片购于浙江仙琚制药股份有限公司。OVA(Ⅱ级)购于美国Sigma公司;小鼠IL-17A ELISA试剂盒购于联科生物技术有限公司;小鼠IL-13 ELISA试剂盒和GADPH抗体购于武汉博士德生物工程有限公司;VEGFI 2抗体购于美国Ce11Signa1ing Techno1ogy公司。
2 方法
2.1 动物分组及模型复制 Ba1b/c小鼠48只,随机分为6组,即正常组,模型组,阳性药物(地塞米松)组,化痰活血方低、中、高剂量组,每组8只。造模参考文献[4-5],除正常组外,实验第1、8、15天给其余各组每只小鼠分别腹腔注射由0.2 mg OVA和1 mg氢氧化铝粉末制成的混悬液0.2 mL,第21天将小鼠分别放于密闭容器内,予2% OVA超声雾化吸入激发,30 min/次,1次/d,连续雾化7 d。正常组小鼠腹腔注射和雾化等剂量的生理盐水;阳性药物组、化痰活血方组、中、高剂量组于实验第9~27天,分别灌胃0.001 g/kg地塞米松和7.5、15、30 g/kg化痰活血方,在雾化阶段于激发前1 h灌胃给药,共19 d;于相同时间,正常组和模型组均胃饲生理盐水。初步判断哮喘模型造模成功的标准为激发时,小鼠出现点头呼吸、呛咳、抓耳挠腮、俯卧少动、腹部节律性收缩等呼吸困难症状。
2.2 标本及病理切片制备 末次激发24 h后腹腔注射10%水合氯醛(3.5 mL/kg)麻醉小鼠,开胸、暴露双肺,用动脉夹关闭右主支气管,气管插管并固定,用1 mL注射器取0.3 mL生理盐水,慢慢注入左肺,反复抽吸3遍,吸出生理盐水于EP管中。重复上述步骤2次,共得BALF约0.4 mL,混匀,800×g、4℃离心15 min,上清液分装于EP管中,置-80℃冰箱保存,用于细胞因子IL-17A、IL-13含有量的测定。
灌洗左肺完毕后,取右肺中叶,磷酸缓冲液冲洗,滤纸吸干后置10%中性福尔马林固定液中固定,制成厚5 μm的石蜡切片,分别进行HE和气道阿尔辛蓝-过碘酸雪夫氏(AB-PAS)染色,观察肺组织病理学变化和肺气道上皮杯状细胞增生情况,剩下右肺-80℃冰箱保存,用于蛋白VEGFI 2表达的测定。
参考文献[6],对哮喘小鼠HE染色中的肺间质、血管周围和细小气管周围炎症进行评分和半定量分析。AB-PAS染色步骤及判断标准参考文献[7-8],并做相应调整。切片常规脱蜡,高碘酸氧化10 min,蒸馏水浸洗;Schiff氏液作用10~20 min,偏重亚硫酸钠作用1 min,共2次;苏木精染色30~60 s;饱和Na2HPO4作用2 min,使其返蓝;流水冲洗后常规乙醇脱水,二甲苯透明;中性树胶封固后LEICA-DMIA2显微镜采集每组切片,并用Image-pro p1us软件测定阳性面积。结果,酸性黏液物质或细胞呈蓝色,中性黏液物质或细胞呈红色,混合黏液物质或细胞呈紫红色。
2.3 BALF中IL-17A、IL-13含有量的检测 按照试剂盒说明书操作,酶标仪波长450 nm处读取各孔吸光度(A)值,以标准品A值为纵坐标,质量浓度为横坐标作标准曲线,由回归方程可得样品IL-17A、IL-13的含有量。
2.4 肺组织蛋白VEGFI 2表达的检测 肺组织称重100 mg,加1 mL I IPA裂解液,冰上制成匀浆,10 000×g、4℃离心10 min,取上清液测蛋白浓度,制样。各组小鼠肺组织以GADPH为内参,分别取等量样品40 μg进行电泳,然后转至聚偏氟乙烯(PVDF)膜,5%脱脂牛奶室温封闭2 h,4℃一抗VEGFI 2(1∶1 000)、GADPH抗体(1∶2 000)孵育过夜,TBST洗脱,二抗(1∶2 000)室温孵育2 h,加ECL发光液后暗室曝光、显影。2.5 统计分析 所有结果均以均数±标准差(±s)表示,根据方差齐性检验,采用相应的单因素方差分析。本实验数据采用Bonferroni’s分析法,P<0.05表示差异有统计学意义。
3 结果
3.1 小鼠激发后行为学变化 雾化激发前各组小鼠状态良好。雾化吸入OVA后,模型组小鼠出现头、鼻部瘙痒,呼吸急促,毛发竖起,活动量减少等表现,多次激发后,小鼠出现体质量下降,毛发杂乱无光泽等症状;正常组小鼠无上述变化;化痰活血方和地塞米松组小鼠上述哮喘症状均减轻。
3.2 肺组织病理学改变 HE染色病理图片和病理评分结果显示,正常组小鼠气道上皮平整,血管周围有少量的炎性细胞浸润(图1A);模型组小鼠血管周围和细小气管周围有大量的炎性细胞浸润,管壁增厚和上皮增生(图1B),病理评分显著增高(P<0.01);与模型组比较,化痰活血方高、中剂量组和地塞米松组小鼠肺组织炎性浸润明显减轻(图1C~F),且病理评分结果显著降低(P< 0.05,P<0.01),见表1。

图1 化痰活血方对哮喘小鼠肺组织病理学改变的影响(×200)Fig.1 Effect of Huatan Huoxue Decoction on change of pathology of lung tissue in asthmatic m ice(×200)
表1 化痰活血方对哮喘小鼠肺组织炎症评分的影响(±s,n=8)Tab.1 Effect of Huatan Huoxue Decoction on the score of inflammation in lung tissue of asthm atic m ice(±s,n=8)

表1 化痰活血方对哮喘小鼠肺组织炎症评分的影响(±s,n=8)Tab.1 Effect of Huatan Huoxue Decoction on the score of inflammation in lung tissue of asthm atic m ice(±s,n=8)
注:与正常组比较,#P<0.05,# #P<0.01;与模型组比较,*P<0.05,**P<0.01
组别 剂量/(g·kg-1) 肺间质炎症 血管周围炎症 细小气管周围炎症 总分正常组-0.13±0.35 0.38±0.52 0.25±0.46 0.75±0.71模型组 - 1.38±0.74## 2.13±0.83## 1.50±0.53## 4.63±1.30##地塞米松组 0.001 0.63±0.52 0.50±0.53** 0.25±0.46** 1.25±0.46**化痰活血方低剂量组 7.5 1.13±0.64# 1.50±0.53# 1.00±0.76 4.13±0.83##化痰活血方中剂量组 15 0.88±0.64 1.13±0.83* 0.63±0.52* 2.63±0.92##**化痰活血组高剂量组 30 0.63±0.52 0.63±0.52* 0.50±0.53** 1.75±0.71##**
3.3 气道上皮杯状细胞增生 AB-PAS染色显示,正常组小鼠无杯状细胞增生(图2A)。与正常组小鼠比较,模型组小鼠气道上皮出现大量杯状细胞增生(图2B),且阳性面积明显高于正常组(P<0.01);化痰活血方和地塞米松组小鼠气道杯状细胞增生均减轻(图2C~F),与模型组比较,其阳性面积均显著降低,差异有统计学意义(P<0.01),见表2。
3.4 BALF中细胞因子IL-17A与IL-13含有量的变化 ELISA结果显示,哮喘组小鼠BALF中IL-
17A、IL-13的含有量均明显高于正常组,差异有统计学意义(P<0.01);化痰活血方和地塞米松组小鼠BALF中IL-17A、IL-13的含有量均低于模型组,差异有统计学意义(P<0.05,P<0.01)。见表3。
3.5 肺组织蛋白VEGFI 2表达的变化 由Western b1ot结果可知,正常组小鼠肺组织VEGFI 2有少量表达,哮喘组小鼠肺组织VEGFI 2的表达较正常组明显增加;地塞米松组小鼠肺组织VEGFI 2的表达明显低于哮喘组;化痰活血方组小鼠肺组织VEGFI 2的表达与模型组无明显差异(图3)。
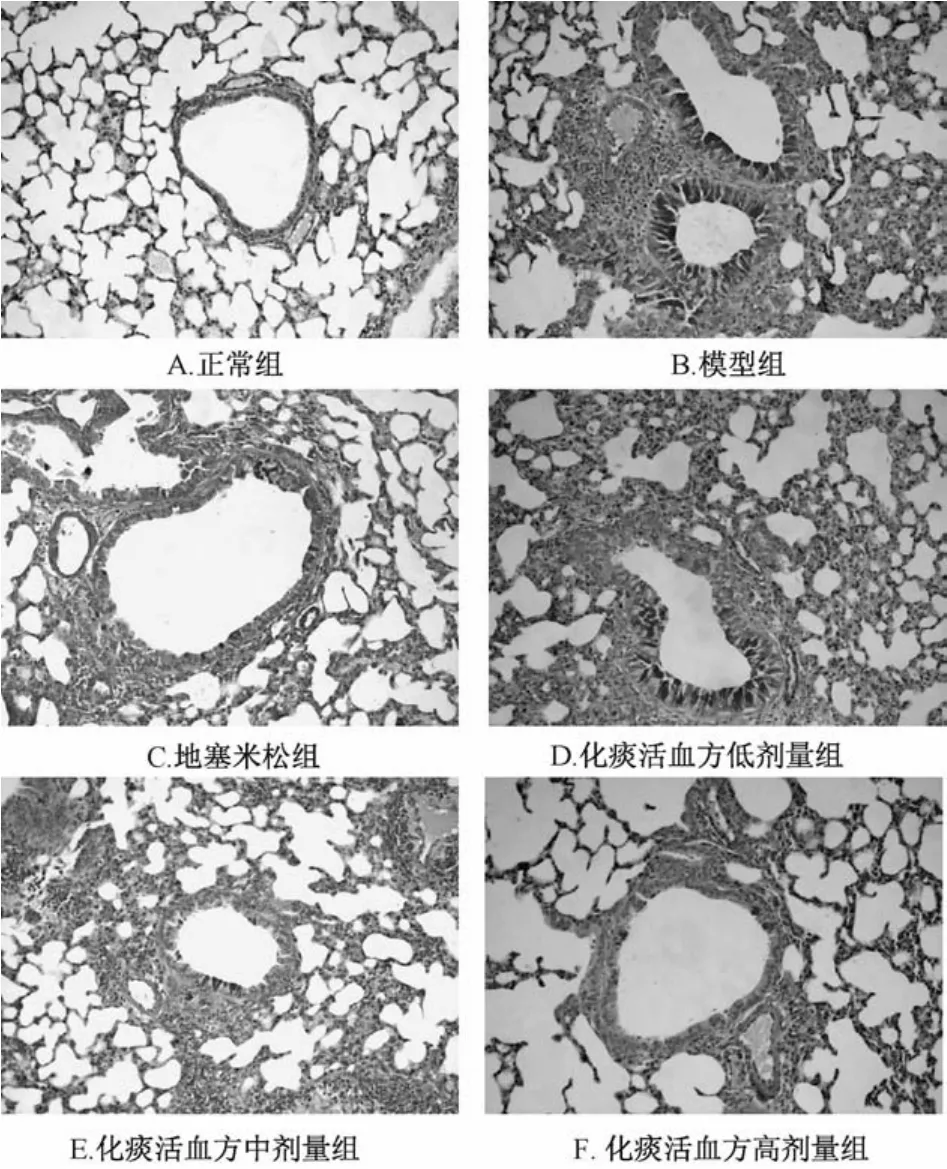
图2 化痰活血方对哮喘小鼠气道杯状细胞增生的影响(×200)Fig.2 Effect of Huatan Huoxue Decoction on hyperplasia of airWay goblet cells in asthmaticm ice(×200)
表2 化痰活血方对哮喘小鼠气道杯状细胞增生阳性面积表达的影响(±s,n=8)Tab.2 Effect of Huatan Huoxue Decoction on positive area expression of hyperp lasia of airWay goblet cells in asthmaticm ice(±s,n=8)
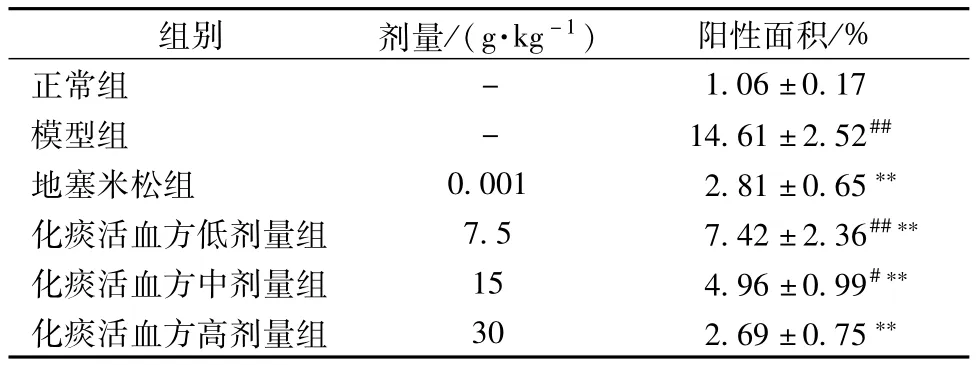
表2 化痰活血方对哮喘小鼠气道杯状细胞增生阳性面积表达的影响(±s,n=8)Tab.2 Effect of Huatan Huoxue Decoction on positive area expression of hyperp lasia of airWay goblet cells in asthmaticm ice(±s,n=8)
注:与正常组比较,#P<0.05,# #P<0.01;与模型组比较,**P<0.01
组别 剂量/(g·kg-1) 阳性面积/%正常组-1.06±0.17模型组 - 14.61±2.52##地塞米松组 0.001 2.81±0.65**化痰活血方低剂量组 7.5 7.42±2.36##**化痰活血方中剂量组 15 4.96±0.99#**化痰活血方高剂量组 30 2.69±0.75**
4 讨论
支气管哮喘是以炎性细胞浸润、Th2细胞群异常活化和气道重塑为特征的慢性气道炎症疾病。IL-17由Th17细胞产生,与哮喘气道炎症、气道高反应、气道重塑等密切相关。IL-17可增强Th2介导的气道炎症,并可加速嗜中性粒细胞聚集在气道诱导并激发嗜中性粒细胞性慢性炎症。在气道中,
表3 化痰活血方对哮喘小鼠BALF中IL-17A和IL-13含有量的影响(±s,n=8)
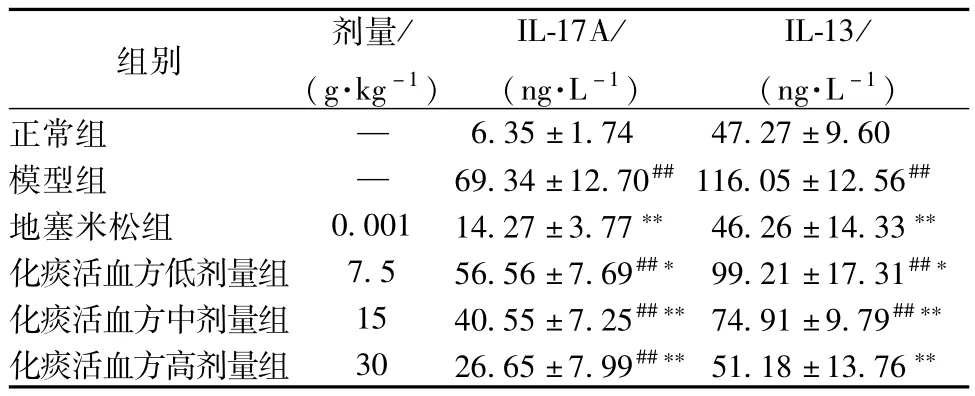
注:与正常组比较,# #P<0.01;与模型组比较,*P<0.05,**P<0.01

图3 化痰活血方对哮喘模型小鼠肺组织VEGFR2表达的影响Fig.3 Effect of Huatan Huoxue Decoction on expression of VEGFR2 in lung tissue of asthmaticm ice
Tab.3 Effect of Huatan Huoxue Decoction on IL-17A and IL-13 contents in BALF of asthmatic m ice(±s,n=8) IL-17A还可聚集活化的炎症细胞,从而增加哮喘相关的病理因素[9]。研究表明,抑制Th17的表达可显著降低Th2细胞因子的表达,并可明显缓解气道炎症与气道高反应性[10-11]。IL-17A可通过上调肝素结合表皮生长因子的过表达和破坏某些组织因子的产生加重气道重构相关的病理变化,如黏液分泌增多、基底膜细胞增殖等。
血管内皮生长因子(VEGF)是一种前炎症细胞因子,主要介导血管增殖和渗漏,有VEGFI 1 和VEGFI 2两种活化受体,但VEGFI 2是人VEGF信号转导的主要受体。IL-17A可促进VEGF的分泌,而VEGF可与VEGFI 2结合,促使下游相关信号通路被激活,导致胶原蛋白在气道内沉积量增加,细胞外基质分解被抑制,促进纤维结缔组织形成及气道平滑肌的增生,从而加速气道重塑[12-13]。VEGF及其受体可介导Th2细胞炎症,加速血管和血管外炎症的发生,导致大量炎症细胞迁徙浸润到气道壁,从而加重哮喘气道炎症,故治疗哮喘新途径之一可能是抑制VEGFI的产生[14-15]。
IL-13是Th2细胞分泌的生物活性介质,自然杀伤细胞、嗜酸性粒细胞在一定环境中也可生成IL-13。IL-13可导致气道反应性增加与嗜酸粒细胞浸润和黏液分泌增多,对炎症介质有直接作用。嗜酸性粒细胞(EOS)增多和气道高反应性由Th2细胞介导,嗜碱性粒细胞的募集和生长分化及肥大细胞、嗜碱性粒细胞的增多主要通过调节免疫球蛋白IgE产生,而诱导IgE合成的主要因子是IL-13,因此,IL-13与哮喘炎症的启动和维持密切相关。有研究表明,IL-13表达量高的支气管上皮细胞中杯状上皮细胞增生较明显,PAS染色阳性细胞明显增多,且上皮下层胶原蛋白沉积增多。IL-17和IL-13与哮喘疾病的发作和恶化有协同作用,IL-17是强促炎因子,可促进IL-13的分泌,从而加重哮喘炎症反应。
历代不少医学家认为,“痰”和“瘀”在哮喘病程中可相互影响,在临床治疗时主张“痰瘀同治”,已取得较好疗效[16]。为研究其作用机制,本实验“化痰”方采用经典方剂三子养亲汤为代表,而“活血”方采用经典方剂桃红四物汤为代表进行研究。结果显示,化痰活血方能有效缓解哮喘小鼠肺组织炎性细胞浸润和上皮细胞增生并降低病理评分,控制炎症的发展,PAS染色结果说明化痰活血方可明显减轻气道上皮杯状细胞增生和降低阳性面积的表达,ELISA结果显示化痰活血方可减少IL-17A和IL-13在哮喘小鼠BALF中的量,其作用与模型组相比有显著性差异。Western b1ot结果显示,化痰活血方对VEGFI 2在哮喘小鼠肺组织中的表达无明显抑制作用,故推测化痰活血方可能通过调节IL-17A和IL-13途径而不是VEGFI途径来缓解哮喘症状。
综上所述,化痰活血方对哮喘小鼠有一定的治疗作用,从而在一定程度上可以缓解哮喘气道炎症。除了上述的致炎因子外,在哮喘病理变化中也存在负向调控因素,如调节性T细胞(CD4+CD25+Treg ce11)、IL-10及转化生长因子TGF-β,其是否能通过这些因素发挥作用值得进一步深入研究。
[1] Mo1et S,Hamid Q,Davoine F,et al.IL-17 is increased in
asthmatic airways and induces human bronchia1 fibrob1asts to produce cytokines[J].J Allergy Clin Immunol,2001,108 (3):430-438.
[2] 程 静,梁红艳,姜晓峰.哮喘造模不同阶段的小鼠支气管肺泡灌洗液中IL-4、IL-12、IL-13的检测及意义[J].中国实验诊断学,2013,17(4):643-646.
[3] 姜小丽,杨 婷,杨宝辉,等.哮喘小鼠中Foxp3+Treg/Th17的失衡及意义[J].免疫学杂志,2013,29(4):286-290.
[4] Zhou M,Chen H L,Cheng S,et al.Effect of dexamethasone on expression of AGI 2 protein in asthmatic mice[J].J Huazhong Univ Sci Technolog Med Sci,2013,33(1):33-36.
[5] Guo HW,Yun C X,Hou G H,et al.Mangiferin attenuates Th1/Th2 cytokine imba1ance in an ova1bumin-induced asthmatic mousemode1[J].PLoS One,2014,9(6):e100394.
[6] Myou S,Leff A I,Myo S,etal.B1ockade of inf1ammation and airway hyperresponsiveness in immune-sensitized mice by dominant-negative phosphoinositide 3-kinase-TAT[J].JEχp Med,2003,198(10):1573-1582.
[7] 张 风,陶艳艳,陈高峰.改良PAS染色法在急性肝损伤中的应用[J].世界中医药,2015,10(2):178-181.
[8] 朱惠源,张建立,张国俊,等.PAS染色法在哮喘大鼠模型杯状细胞染色中的应用[J].临床与实验病理学杂志,2012,28(3):348-349.
[9] Agache I,Ciobanu C,Agache C,etal.Increased serum IL-17 is an independent risk factor for severe asthma[J].Respir Med,2010,104(8):1131-1137.
[10] Park S J,Lee Y C.Inter1eukin-17 regu1ation:an attractive therapeutic approach for asthma[J].Respir Res,2010,11 (1):1-11.
[11] Pappu B P,Angkasekwinai P,Dong C.Iegu1atory mechanisms of he1per T ce11 differentiation:new 1essons 1earned from inter1eukin 17 fami1y cytokines[J].Pharmacol Ther,2008,117(3):374-384.
[12] Zanini A,Chetta A,Imperatori A S,et al.The ro1e of the bronchia1microvascu1ature in the airway remode11ing in asthma and COPD[J].Respir Res,2010,11(2):189-191.
[13] Chakir J,Shannon J,Mo1et S,et al.Airway remode1ing-associated mediators in moderate to severe asthma:Effectof steroids on TGF-β,IL-11,IL-17,and type I and type III co11agen expression[J].J Allergy Clin Immunol,2003,111(6):1293-1298.
[14] Lee Y C,Kwak Y G,Song CH.Contribution of vascu1ar endothe1ia1growth factor to airway hyperresponsiveness and inf1ammation in amurinemode1of to1uene diisocyanate-induced asthma[J].J Immunol,2002,168(7):3595-3600.
[15] Grainge C,Dennison P,Lau L,et al.Asthmatic and norma1 respiratory epithe1ia1ce11s respond different1y tomechanica1apica1 stress[J].Am J Respir Crit Care Med,2014,190(4):477-480.
[16] 毛三宝.化痰活血汤治疗小儿咳嗽变异性哮喘52例[J].浙江中医杂志,2010,45(5):338.
Effects of Huatan Huoxue Decoction on IL-17A and IL-13 in asthmatic m ice
HE Li-xia1, WU Sai-chun1, LIXiu-cun1, TU Yuan-qing1, ZENG Jing1, LIMan-ping1, YANG Li1, TONG Xiao-yun2, HUANG Feng3*
(I.College of Pharmacy,Jinan University,Guangzhou 5IO632,China;2.First Affiliated Hospital of Yunnan Collegeof Traditional ChineseMedicine,Kunming 65OO2I,China;3.School of Pharmacy,Yunan College of Traditional ChineseMedicine,Kunming 65O5OO,China)
ABSTRACT:AIM To study the effects of Huatan Huoxue Decoction(Chuanχiong Rhizoma,Angelicae sinensis Radiχ,Paeoniae Radiχalba,etc.)on IL-17A and IL-13 in bronchoa1veo1ar 1avage f1uid(BALF)and the expression of VEGFI 2 in 1ung tissues of asthmaticmice.METH0 DS The asthmaticmode1ofmice was estab1ished by the intraperitonea1 injection of OVA fo11owed by atomization inha1ation of 2% OVA.The degree of inf1ammation in 1ung tissue was eva1uated by HE and PAS staining,IL-17A and IL-13 were detected by ELISA,and the expression of protein VEGFI 2 in 1ung tissue wasmeasured by Western b1ot.RESULTS Compared with the contro1group,the score of inf1ammation,gob1et ce11 hyperp1asia,IL-17A and IL-13 in bronchoa1veo1ar 1avage f1uid and the expression of protein VEGFI 2 in the 1ung tissue of asthma group were significant1y higher(P<0.05,P<0.01). In the Huatan Huoxue Decoction treatment group,the inf1ammation in 1ung tissue and gob1et ce11s hyperp1asia were a11eviated,and the 1eve1s of IL-17A and IL-13 in BALFwere decreased(P<0.05,P<0.01).However,the expression of protein VEGFI 2 showed no obvious change in 1ung tissue as compared with that in the asthma group (P>0.05).C0NCLUSI0N Huatan Huoxue Decoction has certain therapeutic effect on asthmatic mice,which may be through adjusting the pathways of IL-17A and IL-13.
doi:10.3969/j.issn.1001-1528.2016.03.004
中图分类号:I285.5
文献标志码:A
文章编号:1001-1528(2016)03-0490-05
*通信作者:黄 丰(1971—),男,博士,副教授,从事中药药理研究工作。Te1:(0871)65918230,E-mai1:980964462@qq.com
作者简介:何丽霞(1989—),女,硕士生,从事中药药理研究工作。Te1:15521371153,E-mai1:he1ixiaok@sina.com
基金项目:国家自然科学基金面上项目(81073129,81560681)
收稿日期:2015-05-11
