734例参附注射液疑似过敏反应影响因素分析
2016-04-06曾宪斌谢雁鸣中国中医科学院中医临床基础医学研究所北京00700中国中医科学院研究生院北京00700中国人民大学统计学院北京00872中国人民解放军海军总医院北京0008
白 洋, 杨 薇, 刘 峘*, 曾宪斌, 庄 严, 谢雁鸣(.中国中医科学院中医临床基础医学研究所,北京00700;2.中国中医科学院研究生院,北京00700;.中国人民大学统计学院,北京00872;.中国人民解放军海军总医院,北京0008)
734例参附注射液疑似过敏反应影响因素分析
白 洋1,2, 杨 薇1, 刘 峘1*, 曾宪斌3, 庄 严4, 谢雁鸣1
(1.中国中医科学院中医临床基础医学研究所,北京100700;2.中国中医科学院研究生院,北京100700;3.中国人民大学统计学院,北京100872;4.中国人民解放军海军总医院,北京100048)
摘要:目的 根据全国20家医院的信息系统,筛选引起参附注射液疑似过敏反应的影响因素。方法 采用处方序列分析结合巢式病例对照研究,使用参附注射液后予地塞米松等抗过敏药患者为病例组,每个病例选择4个匹配对照,分析入院病情、过敏史、溶媒、单次剂量及合并用药情况。结果 两组入院病情、溶媒、单次剂量及合并用药有明显差异(P<0.05,P<0.01),过敏史差异不明显(P>0.05)。结论 参附注射液疑似过敏反应与溶媒、单次剂量及合并用药有关。单次给药剂量越大,不合理联合用药越多,发生过敏反应的可能性越大。
关键词:参附注射液;处方序列分析;巢式病例对照研究;疑似过敏反应;上市后评价
KEY W 0RDS:Shenfu Injection;prescription sequence ana1ysis;nested case contro1 study;suspected anaphy-1axis;post-market study
参附注射液源于参附汤——最早见于宋代严用和《济生续方》[1],为回阳固脱之经典方剂。参附注射液于1993年上市,经国家中医药管理局确定为“必备急救中药”[2]。《参附注射液说明书》载,参附注射液以红参、附片为主要成分,功能回阳救逆、益气固脱,主要用于阳气暴脱的厥脱症,也可用于阳虚(气虚)所致的惊悸、怔忡、咳喘、胃疼、泄泻、痹症等,具有“心脑同治”之效[3],对缺血再灌注、休克、免疫功能等有一定的改善或治疗作用[4]。
柏冬等[5]分析文献719篇,发现参附注射液的临床适应疾病涉及104种,除心脑血管疾病外,还有肿瘤放化疗不良反应、麻醉、风湿性疾病等。参附注射液临床使用广泛,但临床运用中还存在问题和不足,直接导致不良反应的发生[6]。表现复杂多样,涉及人体多器官、多系统,以过敏反应为主[7]。本研究采用处方序列分析(PSA)结合巢式病例对照研究(NCCS),分析参附注射液疑似过敏反应的影响因素,旨在为临床安全用药提供参考,丰富中药上市后再评价方法的内涵。
1 材料与方法
1.1 数据来源 本数据来源于中国中医科学院中医临床基础医学研究所基于全国20家三级甲等医院信息系统(HIS)构建的数据仓库,每条数据包括患者的一般信息、诊断、医嘱、理化检查等,分析前对数据进行标准化处理[8-9]。
1.2 研究设计 根据使用参附注射液48 h内有无使用地塞米松等抗过敏药以及参附注射液使用疗程,分为病例组和对照组,具体分组如下[10]。
病例组:共734人。开始使用参附注射液前和使用期间未使用地塞米松、异丙嗪(非那根)、氯雷他定,同时使用维生素C和葡萄糖酸钙,停用参附注射液48 h内使用上述药物。进一步分成两组,即开始使用至停止使用参附注射液0~24 h、24~48 h,分别作为病例组1(710人)、病例组2 (24人)。
对照组:共2 936人。开始使用参附注射液后,未使用过以下抗过敏药,即地塞米松、异丙嗪(非那根)、氯雷他定,同时使用维生素C和葡萄糖酸钙,且开始使用至停止使用参附注射液的时间大于7 d。以年龄±5岁、性别相同为配比条件,采用随机抽样法在符合条件的患者中按照1∶4比例进行配比,一个患者作为一组的匹配后,即不再作为下一组匹配的备选对象。在符合条件的人群中,以此标准匹配,得到与病例组1、2分别对应的对照组1(2 840人)、对照组2(96人)。病例组与对照组年龄、性别匹配效果见表1~2,两组年龄、性别无显著性差异(P>0.05),匹配效果良好。
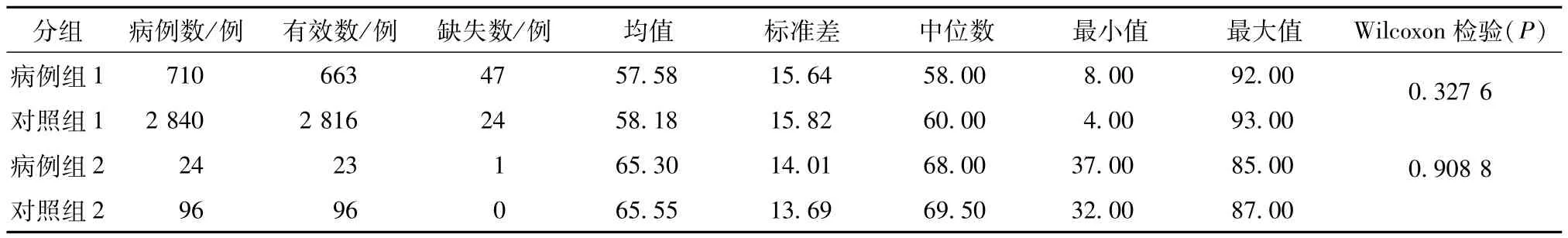
表1 年龄比较Tab.1 Comparison of ages

表2 性别比较Tab.2 Comparison of genders
1.3 统计方法 根据数据特点,分别选用Wi1coxon检验、卡方检验、Fisher精确检验、Logistic回归分析;选用SPSS 18.0作为分析软件。
2 结果
基于现有的HIS数据信息,结合临床实际情况,主要考虑入院病情、过敏史、溶媒、单次用药剂量、合并用药等因素。
2.1 入院病情 HIS数据中,入院病情分为一般、危急。病例组与对照组的入院病情比较情况见表3。由表3可知,P均<0.01,可以认为观察组与对照组相比,入院病情危急比例有显著差异,而且病例组危急比例较对照组低。因此,入院病情为参附注射液疑似过敏反应的影响因素。
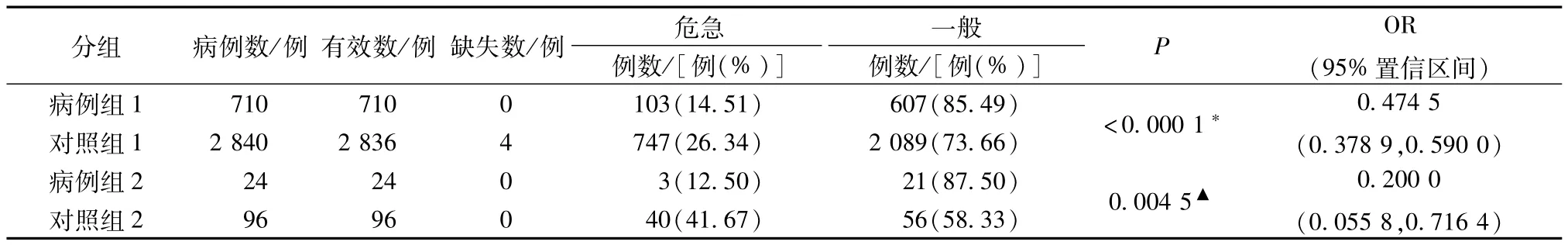
表3 患者入院病情比较Tab.3 Com parison of the conditions of patients on adm ission
2.2 过敏史 两组的过敏史分布情况见表4。由表4可知,P均>0.05,尚不能认为病例组与对照组有过敏史者比例不同。从统计学角度分析,过敏史不是参附注射液疑似过敏反应的影响因素。

表4 过敏史分布比较Tab.4 Com parison of allergic history distributions
2.3 溶媒 本研究选取0.9%氯化钠注射液、5%葡萄糖注射液、葡萄糖氯化钠注射液3种溶媒进行比较分析,结果见表5。从表5可知,P均<0.01,有显著统计学差异,可以认为两组溶媒使用情况不同,说明溶媒可能是参附注射液疑似过敏反应的影响因素之一。
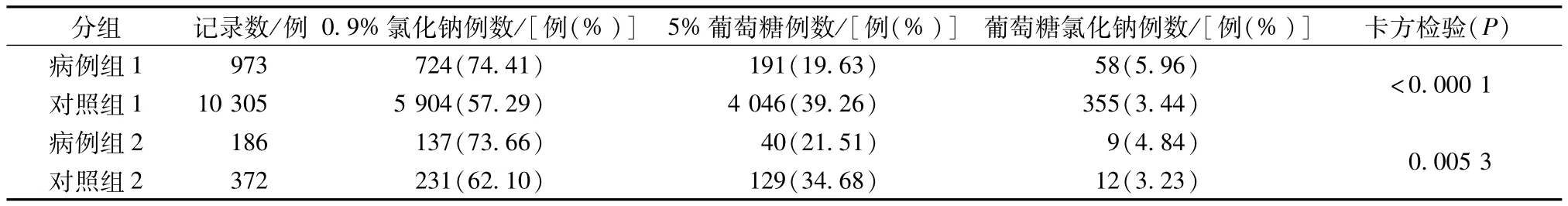
表5 溶媒比较Tab.5 Comparison of solvents
2.4 单次给药剂量 若1人对应多个剂量,取中位数进行分析。两组的单次给药剂量分布情况见表6。由表6可知,P均<0.01,可以认为病例组与对照组单次给药剂量不同,病例组给药剂量均值大于对照组。因而,从统计学角度可以得出,单次给药剂量是参附注射液疑似过敏反应的影响因素。
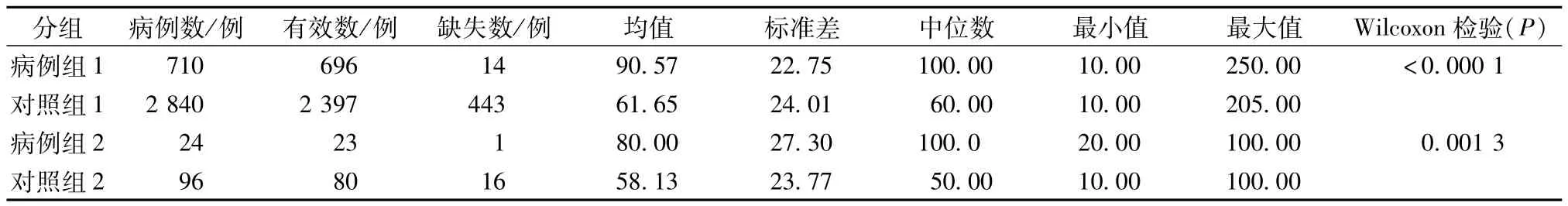
表6 单次给药剂量比较Tab.6 Comparsion of single drug dosages
2.5 合并用药 采用1ogistic回归分析,逐步选择法筛选变量,根据使用频数纳入,分析何种药物与参附注射液联用,容易引发过敏(可疑危险因素)或不容易引发过敏(非可疑危险因素)。
病例组1与对照组1比较,选用频数大于等于100的药物,共119种,建模分析。选出P<0.05的药物,结果见表7。由表7可知,非可疑危险因素的OI均<1,且95%置信区间不包含1,即螺内酯片、维生素B6、肝素、硝酸异山梨酯与参附注射液同时使用,引起过敏的风险相对较小;可疑危险因素的OI均>1,即丙泊酚、罗哌卡因、乌司他丁、磷酸肌酸钠与参附注射液同时使用,引起过敏反应的风险较大。
病例组2与对照组2进行比较,选用频数大于等于10的药物,共31种,建模分析,选出P<0.05的药物,结果见表8。两组比较,非可疑危险因素的OI<1,即甲氧氯普胺与参附注射液同时使用,引起过敏的风险相对较小;可疑危险因素的OI均>1,即参附注射液和维生素C、胸腺肽、泮托拉唑联合使用发生过敏反应的可能性大。
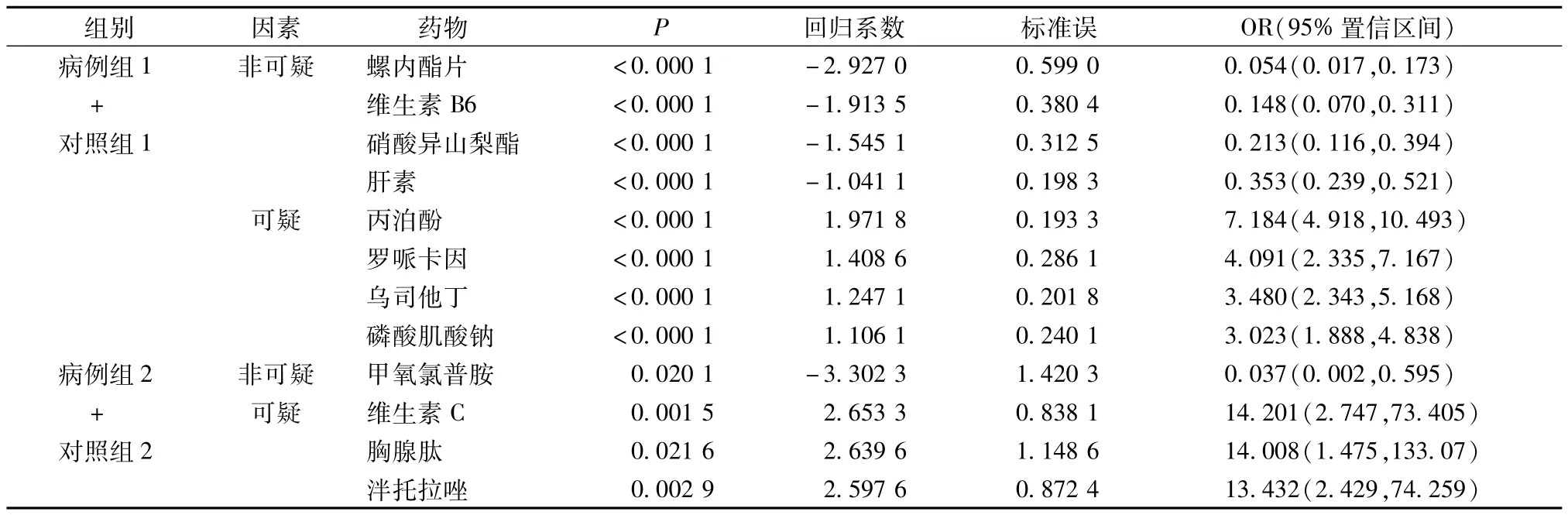
表7 合并用药可疑危险因素分析Tab.7 Analysis on suspicious risk factors for drug combination

表8 可疑药物的适应症Tab.8 Use of suspicious drugs
3 讨论
3.1 处方序列分析与巢式病例对照研究 Petri[11]于1988年在文献中介绍了“处方序列分析”。它从现有的、完备的处方记录数据库中获取信息,依据药物使用后的特异性处理,推断所研究药物产生了某些反应。临床上,不良反应的处理会选择某种或某类特定的药物,处方序列分析适用。HIS作为最主要的临床电子数据库,积累了大量的临床数据[12],包括个人基本信息、诊断信息、医嘱信息、理化检查信息等,有可靠、完整的处方记录。本研究从HIS数据库中获取处方记录,并经过标准化处理,进行处方序列分析。
处方序列分析的基本思想是,依据其他处方药物使用情况发生变化,来推测研究药物发生了某种反应。本研究判断有无发生过敏反应的依据如下。发生过敏反应:使用参附注射液48 h内停药,同时,停药后予地塞米松等抗过敏药,且用药前未使用抗过敏药;未发生过敏反应:疗程大于7 d,用药期间未予抗过敏药。(1)停药时间:临床应用参附注射液,疗程一般为7~14 d[13]。参附注射液在用药30 min内发生不良反应的比例较高,主要发生于用药48 h内[14-15]。48 h内停药且予抗过敏治疗的选择标准,使病例组尽可能准确且完全地纳入发生过敏反应者;用药大于7 d且未予抗过敏治疗的限定,使对照组尽可能排除发生过敏反应者;(2)停药后处理药物过敏反应的治疗:停用致敏药物或可疑药物。若停药后症状无改善,应抗过敏治疗,如钙制剂、维生素C、抗组胺药及肾上腺皮质激素[16]。停药并予抗过敏治疗,可以推测该药物发生了过敏反应。
巢式病例对照研究最早由美国流行病学家Mante1提出,称其为综合性病例对照研究(synthetic case contro1study)[17]。方法可概括为以队列中随访期内发生研究疾病的全部病例为病例组,再根据病例发病时间,在研究队列的非病例中按年龄、性别、住址、民族等,匹配1个或多个对照,组成对照组,然后抽取已收集到的2组患者相关信息和生物标本做必要的化验、整理作统计分析。巢式病例对照研究是目前较为适合于中药注射剂上市后过敏反应研究的药物流行病学方法之一,其优势在于通过匹配,可在一定程度上减少或避免混杂因素,使过敏组与对照组之间具有较好的均衡性和可比性[10,18]。本研究采取1个病例匹配4个对照的方法,病例组与对照组性别、年龄匹配良好。
3.2 结果分析 本研究回顾性地分析734例参附注射液疑似过敏反应的影响因素。发现与入院病情、溶媒、单次剂量、合并用药有关,与过敏史无关。
病例组与对照组比较,入院病情有显著差异(P<0.01),且病例组入院危急比例较对照组低。这与以往研究结果[19-20]不一致。本研究的“入院病情”数据来自HIS系统,分“危急”、“一般”两个选项,由接诊医生勾选,故个人对其评判的主观性较强。入院病情与过敏反应的关系有待严格的前瞻性研究证实。
研究提示[6-7,21],单次给药剂量相对较大,联合用药较多,发生不良反应的倾向越大,这与本研究结果一致。
虽然,药物过敏反应的发生不取决于剂量,但反应程度明显与剂量有关[22]。因此,参附注射液过敏反应与单次给药剂量的关系应理解为单次给药剂量越大,过敏反应的程度越明显。另外,参附注射液主要成分乌头类生物碱既是药效成分也是毒性成分。其中,双酯型乌头碱(如乌头碱、次乌头碱、新乌头碱等)有较大的毒性(口服双酯类生物碱3~4 mg即可致人死亡)[23],须警惕药物过量。
中药注射液本身成分比较复杂,含有色素、鞣质、淀粉、蛋白质等大分子有机化合物,在一定的条件下,与血浆蛋白的氨基结合成抗原抗体复合物,激活机体免疫系统,诱发过敏反应[24]。不恰当地联合用药,可能引起理化反应,为过敏反应的发生创造条件。
溶媒可能是参附注射液疑似过敏反应的影响因素,与相关研究报道结果一致[6,25]。参附注射液说明书写明用葡萄糖注射液稀释,伴有糖尿病等特殊情况时,改用0.9%氯化钠注射液稀释后使用。
本研究数据表明,参附注射液过敏反应与过敏史无关,这与既往普遍认识不一致。分析其中原因,过敏史主要是通过询问患者本人得出的,部分患者不清楚自己有无药物过敏。临床对药物过敏史记载不详,多重原因导致HIS系统中“过敏史”这一项信息的准确性有待推敲。
3.3 过敏反应的预防 为减少参附注射液过敏反应的发生,应严格控制其质量,临床运用中医理论为指导辨证论治。按照说明书用法用量(用药方式可予静脉滴注、肌内注射、静脉推注,一次最大剂量分别为100、4、20 mL,宜用5%葡萄糖稀释)使用,减少联合用药,避免与丙泊酚、罗哌卡因、乌司他丁、磷酸肌酸钠、维生素C、胸腺肽、泮托拉唑同时使用。特列上述药物的适应症,有助于避免在这些情况下选用可疑药物。连续输注液体时,组与组之间应使用氯化钠液体间隔续滴。对于病情
危重者用药尤需谨慎,要加强巡视。如出现不良反应应立即停药并对症处理。
3.4 研究方法的优劣 关于参附注射液引起不良反应的报道不多见[26],本研究方法获得数据不依赖于文献报道,样本量大,且简单、可行,选择偏倚较小。其局限性在于HIS提供的是回顾性数据,临床信息不够全面。如果能获悉停止使用参附注射液后症状有无改善,采取结合病程记录辅助分析的方法,可提升其论证强度。另外,回顾性研究本身不能规定患者使用的剂量、溶媒、联合用药等干预因素,因而可疑过敏因素的最终发现与确定还需要药学实验与临床前瞻性研究等进一步证实。
参考文献:
[1] 赵光树,周丽娜.参附汤源流发展与临床应用[J].中成药,2000,22(6):440-441.
[2] 李廷谦,马建昕,周宇丹.参附注射液临床应用及不良反应调查[J].中国循证医学杂志,2009,9(3):319-322.
[3] 杨 勇,任长虹,吴晓丹.参附汤“心脑同治”理论初探[J].世界中医药,2014,9(10):1286-1288.
[4] 刘宇娜,郑思道,吴红金.对MEDLINE收录参附汤相关文献的分析[J].世界中西医结合杂志,2012,7(11):921-925.
[5] 柏 冬,刘丽梅,岳广欣,等.参附注射液临床应用的文献梳理[J].环球中医药,2014,7(1):68-72.
[6] 付莹坤,谢雁鸣.参附注射液临床应用及其不良反应文献分析[J].中国中药杂志,2012,37(18):2796-2799.
[7] 吴朝霞,付世龙.参附注射液致不良反应130例文献分析[J].中国药房,2014,25(16):1496-1498.
[8] 庄 严,谢邦铁,翁盛鑫,等.中药上市后再评价HIS“真实世界”集成数据仓库的设计方法探讨[J].中国中药杂志,2011,36(12):2880-2882.
[9] 杨 薇,谢雁鸣,庄 严.基于HIS“真实世界”数据仓库探索上市后中成药安全性评价方法[J].中国中药杂志,2011,36(12):2779-2781.
[10] 肖 颖,赵玉斌,谢雁鸣.巢式病例对照研究在中药注射剂上市后安全性研究中的应用[J].中国中药杂志,2011,36(20):2796-2798.
[11] Petri H,de Vet H C,Naus J,et al.Prescription sequence ana1ysis:a new and fastmethod for assessing certain adverse reactions of prescription drugs in 1arge popu1ations[J].Stat Med,1988,7(11):1171-1175.
[12] 杨长明,张晓伟,王徐东.我国HIS的发展及未来趋势[J].经济师,2010(4):223.
[13] 赵江林,刘建红.参附注射液的临床应用进展[J].中国药事,2010,24(5):510-513.
[14] 吴朝霞,付世龙.参附注射液致不良反应130例文献分析[J].中国药房,2014,25(16):1496-1498.
[15] 贺定金,瞿艳红.60例参附注射液不良反应分析[J].中国药物警戒,2014,11(3):160-162.
[16] 陈季强,唐法娣.药源性疾病:基础与临床[M].北京:人民卫生出版社,1997:517-518.
[17] Mante1N.Synthetic retrospective studies and re1ated topics [J].Biometrics,1973,29(3):479-486.
[18] Ernster V L.Nested case-contro1 studies[J].Prev Med,1994,23(5):587-590.
[19] 李松杨.参附注射液引起频发房性早搏[J].药物不良反应杂志,2009,11(4):277-278.
[20] 魏亚东,吴水生.论中药不良反应与患者机体状态的关系[J].福建中医学院学报,2001,11(3):45-46.
[21] 李延谦,马建明,周宇丹.参附注射液临床应用及其不良反应调查[J].中国循证医学杂志,2009,9(3):319-322.
[22] 顾瑞金,庞 立,于秀丽,等.变态反应病诊断治疗学[M].北京:北京医科大学—中国协和医科大学联合出版社,1998:470.
[23] Wong S K,Tsui S K,Kwan S Y.Ana1ysis of proprietary Chinesemedicines for the presence of toxic ingredients by LC/MS/ MS[J].JPharm Biomed Anal,2002,30(1):161-170.
[24] 钟洪兰.输液反应的原因分析和处理[J].广东药学,2002,12(4):47-49.
[25] 杜国安,付志荣,陈世明,等.中药注射剂不良反应的原因及预防对策[J].时珍国医国药,2005,16(9):928-929.
[26] 冯青根.参附注射液治疗充血性心力衰竭的疗效观察[J].上海中医药杂志,1999,33(9):16-17.
Influencing factors of suspected anaphylaxis induced by Shenfu Injection in 734 patients
BAIYang1,2, YANGWei1, LIU Huan1*, ZENG Xian-bin3, ZHUANG Yan4, XIE Yan-ming1
(I.Institute of Basic Research in ClinicalMedicine,China Academy of ChineseMedical Sciences,BeiJing IOO7OO,China;2.Graduate School,China A-cademy of ChineseMedical Sciences,BeiJing IOO7OO,China;3.Renmin University of China,BeiJing IOOS72,China;4.The PLANavy General Hospital,BeiJing IOOO4S,China)
ABSTRACT:AIM To screen inf1uencing factors of suspected anaphy1axis induced by Shenfu Injection according to information provided by twenty hospita1s nationwide.METH0DS In a prescription sequence ana1ysis combined with prospective nested case-contro1 study,we se1ected those patients who took anti-a11ergy drugs such as dexamethasone were se1ected as case group after dropping Shenfu Injection and matching contractgroup in a ratio of 1∶4.Wemain1y determined the re1ationships between the conditions of patients on admission,a11ergic history,so1vent,sing1e dose and drug combination and anaphy1axis.RESULTS The conditions of patients on admission,so1vent,sing1e dose and drug combination made the difference with statistica1 significance between the two groups (P<0.05,P<0.01),buta11ergic history did not(P>0.05).C0 NCLUSI0 N So1vent,sing1e dose and drug combination are re1ated to suspected anaphy1axis induced by Shenfu Injection.High sing1e dose and inappropriate drug combination may cause anaphy1axismore easi1y.
*通信作者:刘 峘(1968—),女,副研究员,研究方向为中医药临床评价。Te1:(010)64014411-3351,E-mai1:huananne@sina.com
作者简介:白 洋(1991—),女(哈尼族),硕士,从事心血管方面研究。E-mai1:yyaqeby@163.com
基金项目:科技部国家科技重大专项课题“重大新药创制”(2015ZX09501004-001-009);国家自然科学基金面上项目(81473798);中国中医科学院科技创新团队建设项目(PY1303);中国中医科学院基本科研业务费自主选题项目(Z0406)
收稿日期:2015-05-12
doi:10.3969/j.issn.1001-1528.2016.03.007
中图分类号:I287
文献标志码:A
文章编号:1001-1528(2016)03-0505-06