重复经颅磁刺激对抑郁模型大鼠行为学及海马BDNF表达的影响☆
2016-04-04费鹏鸽赵琳任慧聪宋景贵张朝辉
费鹏鸽 赵琳 任慧聪 宋景贵 张朝辉
重复经颅磁刺激对抑郁模型大鼠行为学及海马BDNF表达的影响☆
费鹏鸽*赵琳*任慧聪*宋景贵△张朝辉*
目的 探讨重复经颅磁刺激(repetitive transcranialmagnetic stimulation,rTMS)对慢性应激抑郁模型大鼠行为学及海马脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的影响,探讨rTMS抗抑郁作用的可能机制。方法40只雄性SPF级Sprague-Dawley大鼠经过初次筛选后,随机分为造模组(n=30)和空白对照组(n=8),造模组应用孤养联合慢性不可预见性温和应激(chronic unpredictablemild stress,CUMS)方法建立大鼠抑郁模型,筛选造模成功的大鼠24只随机分为rTMS组、伪刺激组和抑郁对照组,每组8只,抑郁对照组不给予rTMS干预,rTMS组和伪刺激组分别接受10 Hz的rTMS刺激和伪刺激干预3周。分别于造模前、造模后和干预后进行体质量测量、蔗糖水消耗实验和旷场实验评估,在干预后,检测大鼠海马CA3区BDNF阳性染色的细胞数及海马BDNFmRNA的表达水平。结果造模后,rTMS组、伪刺激组和抑郁对照组大鼠的体质量减分率较空白对照组降低(P<0.01),体质量增加缓慢(P<0.01)。干预后,rTMS组大鼠体质量减分率、蔗糖水消耗量、旷场实验的水平运动评分以及垂直运动评分较伪刺激组和抑郁对照组均增高(均P<0.05),与空白对照组差异并无统计学意义(均P<0.05)。干预后,rTMS组大鼠海马CA3区BDNF阳性细胞数目较伪刺激组和抑郁对照组增加(P<0.01),伪刺激组和抑郁对照组较空白对照组减少(P<0.01);rTMS组大鼠海马BDNFmRNA的相对表达量较伪刺激组和抑郁对照组增多(P<0.01),伪刺激组和抑郁对照组较空白对照组减少(P<0.01)。结论rTMS干预能够改善CUMS抑郁模型大鼠的抑郁样行为,可能与增加海马BDNF的表达导致海马神经元再生有关。
抑郁症 重复经颅磁刺激 海马 脑源性神经营养因子
抑郁症的发生机制仍处于探索研究阶段,其治疗方法也在不断探索之中。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)在神经突触的传导及神经可塑性调节等方面具有重要作用,参与神经元存活、增殖、分化及损伤后的修复过程[1-2]。重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是通过仪器产生磁场,诱发感应电流,改变神经细胞兴奋性,影响机体机能的生物刺激技术。近年来被广泛应用于抑郁症的治疗[3],并取得显著疗效[4]。其临床治疗作用可能与保护海马神经元、促进其再生等密切相关[5]。rTMS同时调节神经肽、酪氨酸等多种神经保护因子的表达[6]。国内外研究发现rTMS刺激能够增加BDNF的表达水平[7-8]。本研究要重点解决的问题是观察rTMS干预对模型大鼠抑郁样行为的改善作用及对海马BDNF表达的影响。
1 材料与方法
1.1 动物与建模40只同批次SPF级健康成年雄性Sprague-Dawley(SD)大鼠,由河南省实验动物中心提供(许可证号:SCXK(豫)2010-0002),实验前适应性饲养2周,进入实验时大鼠体质量约为180~220 g。筛选行为学评分均一的38只大鼠,随机分为造模组30只和空白对照组8只。造模组单笼饲养,参照Willner[9]的慢性不可预见性温和刺激(chronic unpredictablemild stress,CUMS)方法制备抑郁模型,即禁食水24 h、昼夜颠倒24 h、冰水游泳5min、束缚2 h、潮湿垫料24 h、夹尾2min、电击足底(每次10 s,间歇5 s,共10次)共7种刺激,每日1种随机安排,同种刺激不连续出现以使动物不能预料刺激的发生,共21 d。空白对照组4只/笼,正常饲养。
1.2 分组与处理经行为学评估,从造模组中筛选造模成功的大鼠24只,随机分为rTMS组、伪刺激组及抑郁对照组,每组8只。rTMS组大鼠造模结束后即给予3周rTMS刺激,rTMS采用CCY-I型磁刺激仪及环形动物线圈,线圈直径约70mm,刺激时固定大鼠头部,线圈平面与大鼠大脑半球相切,刺激频率为10 Hz,100%运动阈值,每刺激1 s间歇10 s,总时间为10min,共500次脉冲[10],连续5 d为1个疗程,每2个疗程间隔2 d,共3个疗程[11]。伪刺激组置于相同的环境,给予相同线圈但无通电,无脉冲发出,只有同样次数的声音刺激。抑郁对照组不给予任何处理。在rTMS干预期间,空白对照组正常喂养,其余各组继续给予孤养联合CUMS以避免抑郁模型自行退化。
1.3 行为学评估
1.3.1 体质量测量 于造模前、造模后以及rTMS干预完成后分别对各组大鼠进行体质量测量,计算体质量减分率[体质量减分率=(此次体质量-前次体质量)/前次体质量×100%],评估大鼠体质量变化趋势。
1.3.2 蔗糖水消耗实验 于造模前、造模后及rTMS干预后,对各组大鼠禁食水24 h后测定大鼠1 h内1%蔗糖水饮用量。评价指标:每100 g体质量大鼠蔗糖水消耗量(mL/100 g)=1 h蔗糖水饮用量(mL)/动物体质量(g)×100。
1.3.3 旷场实验 于造模前、造模后及rTMS干预后将各组大鼠逐个置于旷场反应箱(100 cm×100 cm× 40 cm,四周为黑色、不透明金属箱壁)中央地带,采用Smart Version 2.5.16轨迹图像分析软件(美国Panlab)测定大鼠5min内水平运动距离(水平运动评分)及垂直直立次数(垂直运动评分)。实验在安静、光强度和温湿度适宜且保持一致的环境中进行,由2名观察者观察记录,取其记录的各指标平均值作为结果数据。每只大鼠实验后彻底清洁敞箱。
1.4 BDNF蛋白测定rTMS干预后,各组随机选取4只大鼠处死,用4%多聚甲醛溶液灌注内固定后,断头取脑,将鼠脑置于4%多聚甲醛溶液外固定后进行脑组织脱水、包埋及切片制作。采用免疫组织化学法检测海马区BDNF蛋白,使用链霉亲和素(strept avidin-biotin complex,SABC)免疫组化染色试剂盒(SA2002-兔IgG),按说明书操作,以DAB显色,PBS缓冲液代替一抗作为阴性对照。采用Leica Application Suite图像采集系统采集海马CA3区BDNF蛋白阳性染色图片,采用Image-Pro Plus 6.0图像分析软件测定各组大鼠海马CA3区BDNF阳性染色的细胞数目[12-13]。
1.5 BDNFmRNA测定将各组剩余4只大鼠进行腹腔麻醉后迅速断头取脑,参照大鼠脑解剖图谱,冰块上分离取出海马组织,置于冷冻管后迅速放于液氮中,然后转移至-70℃低温冰箱,保存备用。采用逆转录PCR(reverse transcription PCR,RT-PCR)法检测海马BDNFmRNA及内参基因GAPDH表达水平。反应体系为cDNA模板液2µL、上游引物(10μmol/L)1µL、下游引物(10μmol/L)1µL、4× dNTPmix(10μmol/L)0.5µL、Taq DNA聚合酶0.4 µL、Taq DNA缓冲液2.5µL、去离子双蒸水17.6 µL。BDNF上游引物5'-TTCGGCTTCACCTTCGTCCC-3',下游引物5'-GCCTTGTCCGTGGACGTTTG-3',片段长度320 bp。GAPDH上游引物5'-GGGCTCTCTGCTCCTCCCTCT-3',下游引物5'-CCGTTGAACTTGCCGTGGGT-3',片段长度244 bp。扩增条件为95℃预变性3min,94℃变性15 s,68℃退火30 s,共35个循环,15℃终止反应。扩增完成后将PCR反应产物即行电泳,并于UVI凝胶成像系统照像,GAS7001B凝胶图像分析软件测定光密度,用以反映PCR产量。目的基因BDNFmRNA的相对表达量为目的基因PCR产量经内参基因GAPDH的PCR产量校正后比值(目的基因相对表达量=目的基因产物光密度/内参基因产物光密度)。
1.6 统计学方法采用SPSS20.0进行统计分析。大鼠体质量减分率、蔗糖水消耗量和旷场实验数据分析采用重复测量资料方差分析,简单效应分析采用单因素方差分析进行各时点上4组间比较,两两比较采用LSD法。rTMS干预后各组大鼠海马BNDF蛋白和mRNA表达水平的比较采用单因素方差分析,两两比较采用LSD法。检验水准α为0.05,双侧检验。
2 结果
2.1 造模前后及rTMS干预后行为学评估结果重复测量方差分析示,造模后和干预后大鼠体质量减分率的分组与时间交互作用具有统计学意义(F=7.00,P<0.01);造模前、造模后和干预后大鼠蔗糖水消耗量的分组与时间交互作用有统计学意义(F=4.15,P<0.01);造模前、造模后和干预后大鼠旷场实验的水平运动评分(F=3.58,P<0.01)及垂直运动评分(F=8.60,P<0.01)的分组与时间交互作用均具有统计学意义。
造模前,所有大鼠体质量分布满足正态分布,均质性较高;体质量、蔗糖水消耗量、旷场实验的水平运动评分及垂直运动评分组间比较差异均无统计学意义(P>0.05)。造模后,4组大鼠的体质量减分率差异有统计学意义(F=6.850,P<0.01),蔗糖水消耗量(F=5.20,P<0.01)和旷场实验的水平运动评分(F=9.37,P<0.01)及垂直运动评分(F= 35.77,P<0.01)差异亦均有统计学意义,其中rTMS组、伪刺激组、抑郁对照组分别与空白对照组相比,体质量减分率较低、蔗糖水消耗量减少、旷场实验的水平运动评分和垂直运动评分降低(均P<0.01),而3组间比较差异均无统计学意义(P>0.05),提示造模成功。见表1。
rTMS干预后,各组大鼠间体质量减分率(F= 5.05,P<0.05)、蔗糖水消耗量(F=11.82,P<0.01)、旷场实验的水平运动评分(F=13.59,P<0.01)和垂直运动评分(F=67.67,P<0.01)差异均有统计学意义。与抑郁对照组相比,rTMS组的大鼠体质量减分率、蔗糖水消耗量、旷场实验的水平运动评分和垂直运动评分增高(均P<0.01);rTMS组与伪刺激组相比差异有统计学意义(P<0.05),与空白对照组相比差异无统计学意义(P>0.05);与空白对照组相比,伪刺激组和抑郁对照组的大鼠体质量减分率、蔗糖水消耗量、旷场实验的水平运动评分和垂直运动评分降低(均P<0.05);伪刺激组与抑郁对照组相比差异无统计学意义(P>0.05)。见表1。
2.2 海马CA3区BDNF蛋白阳性细胞数4组大鼠海马CA3区BDNF蛋白阳性细胞数差异有统计学意义(F=27.15,P<0.01)。与伪刺激组和抑郁对照组大鼠相比,rTMS组海马CA3区BDNF蛋白阳性细胞数目增加,差异有统计学意义(P<0.01);与空白对照组相比,伪刺激组和抑郁对照组大鼠海马CA3区BDNF蛋白阳性细胞数减少,差异有统计学意义(P<0.01)。见表2与图1。
2.3 海马BDNFmRNA表达水平4组大鼠海马BDNFmRNA的相对表达量差异有统计学意义(F=82.70,P<0.01)。与伪刺激组和抑郁对照组相比,rTMS组BDNFmRNA的相对表达量增多,差异有统计学意义(P<0.01);与空白对照组相比,伪刺激组和抑郁对照组的BDNFmRNA相对表达量减少(均P<0.01)。见表3。
3 讨论
本研究采用目前较为认可的孤养联合CUMS方法制备抑郁大鼠模型,经过21 d的模型制备,利用体质量减分率、蔗糖水消耗实验和旷场实验评估抑郁模型制备是否成功。本研究表明,造模后造模组大鼠体质量减分率、蔗糖水消耗量及旷场实验的水平运动评分和垂直运动评分均明显低于空白对照组,说明抑郁模型大鼠制备成功。经rTMS干预后,rTMS组大鼠体质量减分率、蔗糖水消耗量、旷场实验的水平运动评分和垂直运动评分明显高于抑郁对照组,伪刺激组与抑郁对照组相比差异无统计学意义。这提示rTMS具有抗抑郁作用,与张小乔等[14]研究结果一致。

图1 干预后大鼠海马CA3区BDNF蛋白阳性表达结果(免疫组织化学染色,×200)A为空白对照组,B为抑郁对照组,C为rTMS组D:伪刺激组
表1 造模前、造模后及干预后大鼠行为学指标(±s)
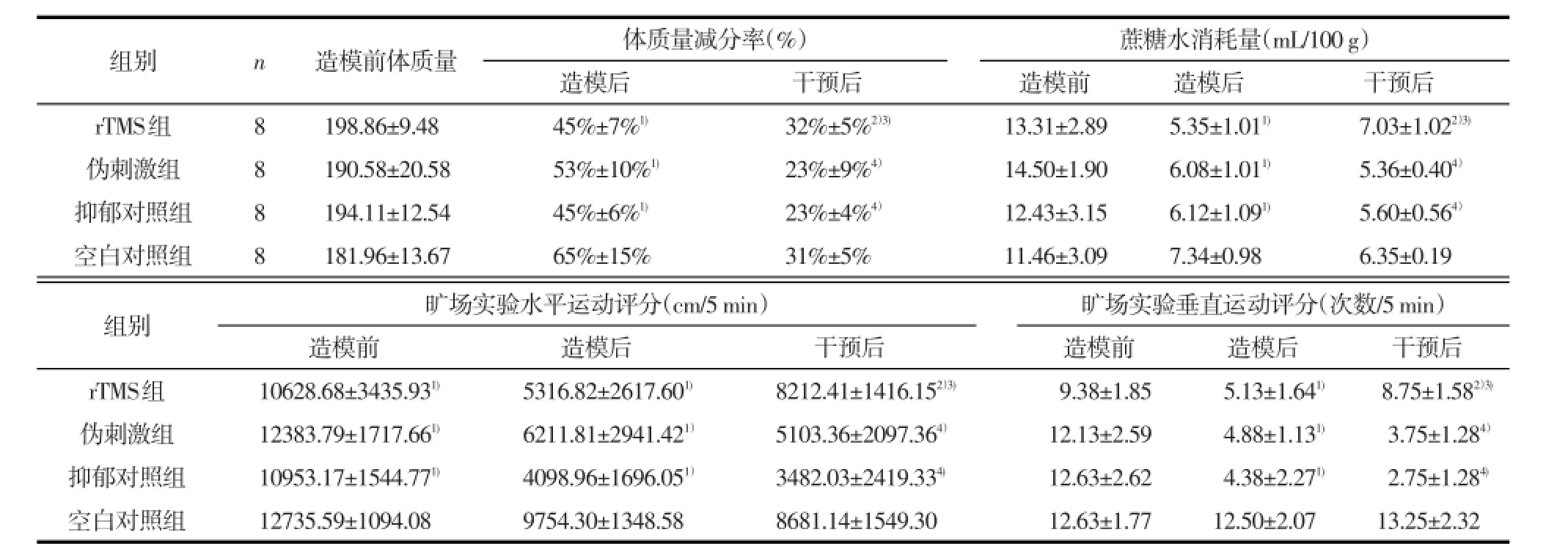
表1 造模前、造模后及干预后大鼠行为学指标(±s)
1)与空白对照组比较,经LSD-t检验,P<0.01;2)与伪刺激组比较,经LSD-t检验,P<0.05;3)与抑郁对照组比较,经LSD-t检验,P<0.01;4)与空白对照组比较,经LSD-t检验,P<0.05
组别rTMS组伪刺激组抑郁对照组空白对照组n 8 8 8 8造模前体质量198.86±9.48 190.58±20.58 194.11±12.54 181.96±13.67体质量减分率(%)造模后45%±7%1)53%±10%1)45%±6%1)65%±15%干预后32%±5%2)3)23%±9%4)23%±4%4)31%±5%蔗糖水消耗量(mL/100g)造模前13.31±2.89 14.50±1.90 12.43±3.15 11.46±3.09造模后5.35±1.011)6.08±1.011)6.12±1.091)7.34±0.98干预后7.03±1.022)3)5.36±0.404)5.60±0.564)6.35±0.19组别rTMS组伪刺激组抑郁对照组空白对照组旷场实验水平运动评分(cm/5min)造模前10628.68±3435.931)12383.79±1717.661)10953.17±1544.771)12735.59±1094.08造模后5316.82±2617.601)6211.81±2941.421)4098.96±1696.051)9754.30±1348.58干预后8212.41±1416.152)3)5103.36±2097.364)3482.03±2419.334)8681.14±1549.30旷场实验垂直运动评分(次数/5min)造模前9.38±1.85 12.13±2.59 12.63±2.62 12.63±1.77造模后5.13±1.641)4.88±1.131)4.38±2.271)12.50±2.07干预后8.75±1.582)3)3.75±1.284)2.75±1.284)13.25±2.32
表2 干预后大鼠海马CA3区BDNF蛋白阳性细胞数(±s)
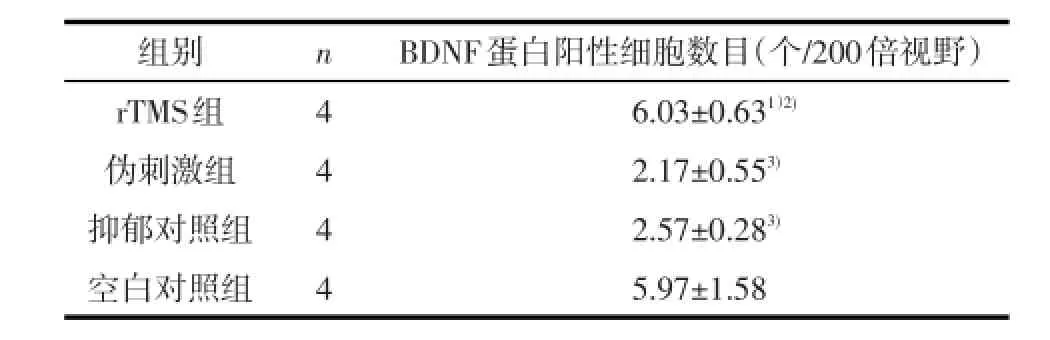
表2 干预后大鼠海马CA3区BDNF蛋白阳性细胞数(±s)
1)与伪刺激组比较,经LSD-t检验,P<0.01;2)与抑郁对照组比较,经LSD-t检验,P<0.01;2)与空白对照组比较,经LSD-t检验,P<0.01
组别rTMS组伪刺激组抑郁对照组空白对照组n 4 4 4 4 BDNF蛋白阳性细胞数目(个/200倍视野)6.03±0.631)2)2.17±0.553)2.57±0.283)5.97±1.58
表3 干预后大鼠海马BDNFm RNA相对表达量(±s)

表3 干预后大鼠海马BDNFm RNA相对表达量(±s)
1)与伪刺激组比较,经LSD-t检验,P<0.01;2)与抑郁对照组比较,经LSD-t检验,P<0.01;2)与空白对照组比较,经LSD-t检验,P<0.01
组别rTMS组伪刺激组抑郁对照组空白对照组n 4 4 4 4 BDNFmRNA相对表达量0.48±0.021)2)0.27±0.053)0.26±0.033)0.49±0.04
BNDF是影响神经元生长微环境的代表性物质。大量研究表明,BDNF可促进神经增殖与分裂,增强突触联系,对海马神经元存活、分化和再生具有重要意义[15-16]。在神经元损伤过程中,给予促进BDNF表达增加的措施后,神经元再生变得更加有利[17]。rTMS能改善抑郁症大鼠抑郁行为,其治疗机制可能与rTMS增强海马BDNF表达、提高神经前体细胞数量、促进其增殖等有关,BDNF表达水平与神经元损伤程度有相当大的关联,其表达增加不仅可提高神经元抗损伤能力,同时也可促进神经元分裂增殖[18]。SHANG[2]等研究报道称rTMS干预促进认知恢复及突触可塑性功能与其增加BDNF的表达密切相关。与文献结果相似,本研究结果也显示经过rTMS干预后,rTMS组大鼠海马体积增大,神经元形态较抑郁对照组好转,海马CA3区BDNF蛋白阳性细胞数及海马BDNFmRNA的表达水平较抑郁对照组增加,而抑郁对照组和伪刺激组大鼠海马CA3区BDNF蛋白阳性细胞数及海马BDNFmRNA的表达水平较空白对照组减少。因此我们推测,rTMS干预可能通过增加BDNF表达来促进海马神经元的再生,保护海马神经元。
本研究通过观察rTMS改善慢性应激抑郁模型大鼠抑郁行为的同时,测定大鼠海马BDNF表达变化,推测rTMS抗抑郁作用可能与BDNF水平变化有关。但本研究的实验设计分组可进一步规范,如增加设置对空白大鼠进行rTMS干预的分组可更加明确rTMS的作用。实验过程中也未能对BDNF蛋白表达量进行定量分析,未能在更深层次了解rTMS是通过何种途径来改变BDNF的表达,条件允许下期待在以后的研究中进一步探讨。
[1] 罗俊霞.BDNF信号途径在神经可塑性和抑郁症发病中的作用研究[D].山东大学,2015.
[2] SHANG Y,WANG X,SHANG X,et al.Repetitive transcranial magnetic stimulation effectively facilitates spatial cognition and synaptic plasticity associated with increasing the levels of BDNF and synaptic proteins in Wistar rats[J].Neurobiol Learn Mem, 2016,134:369-378.
[3] 鲁亚杰,夏麟,武圣君,等.右侧额叶低频重复经颅磁刺激治疗抑郁症的meta分析[J].中国神经精神疾病杂志,2015,41 (6):341-348.
[4] BERLIM MT,VANDEN EF,DASKALAKISZJ.A systematic review andmeta-analysis on the efficacy and acceptability of bilateral repetitive transcranialmagnetic stimulation(rTMS)for treatingmajor depression[J].Psychol Med,2012,1:1-10.
[5] FENGSF,SHITY,FAN Y,et al.Long-lasting effectsof chronic rTMS to treat chronic rodent model of depression[J].Behav Brain Res,2012,232(1):245-251.
[6] GEDGE L,BEAUDOIN A,LAZOSKIL,et al.Effects of electroconvulsive therapy and repetitive transcranialmagnetic stimulation on serum brain-derived neurotrophic factor levels in patientswith depression[J].Front Psychiatry,2012,3:1-8.
[7] YUKIMASA T,YOSHIMURA R,TAMAGAWA A,et al. High-frequency repetitive transcranialmagnetic stimulation improves refractory depression by influencing catecholamine and brain derived neurotrophic factors[J].Pharmacopsychiatry, 2006,39:52-59.
[8] 廖力维,王继军.重复经颅磁刺激治疗精神障碍作用机制[J].中国神经精神疾病杂志,2013,39(9):573-577.
[9] WILLNER P.Animalmodels as simulations of depression[J]. Trends Pharmacol Sci,1991,12(4):131-136.
[10] LEFAUCHEUR JP,ANDRÉ-OBADIA N,ANTAL A,et al.Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetics timulation(rTMS)[J].Clin Neurophysiol, 2014,125(11):2150-2206.
[11] 白冰.rTMS对抑郁模型大鼠学习记忆及海马突触可塑性的影响[D].新乡医学院,2014.
[12] 许淳.内脏痛高敏感幼鼠的学习记忆能力变化和脊髓背角、海马CA1区脑源性神经营养因子表达变化及意义[D].福建医科大学,2015.
[13] 钟亮.孕晚期SD大鼠母体接受丙泊酚全身麻醉对子代学习记忆功能及海马区BDNF表达的影响[D].南昌大学,2015.张小乔,李鹂,霍江涛,等.重复经颅磁刺激对慢性应激抑郁
[14] 大鼠抑郁行为及海马神经元再生的影响[J].中华物理医学与康复杂志,2011,33(5):336-339.
[15] GUAN J,ZHANG B,ZHANG J,et al.Nerve regeneration and functional recovery by collagen-binding brain-derived neurotrophic factor in an intracerebral hemorrhage model[J].Tissue Eng PartA,2015,21(1-2):62-74.
[16] DONEGA V,NIJBOER CH,VAN TG,et al.Intranasally administered mesenchymal stem cells promote a regenerative niche for repair of neonatal ischemic brain injury[J].Experimentalneurology,2014,261:53-64.
[17] 黄伟,朱继,熊海兵,等.脑源性神经营养因子经Akt/eNOS通路在大鼠蛛网膜下腔出血后早期脑损伤中的表达[J].中国神经精神疾病杂志,2013,39(5):300-303.
[18] CHEN YH,ZHANG RG,XUE F,et al.Quetiapine and repetitive transcranial magnetic stimulation ameliorate depression-like behaviors and up-regulate the proliferation of hippocampal-derived neural stem cells in a ratmodel of depression: The involvement of the BDNF/ERK signal pathway[J].Pharmacol Biochem Behav 2015,136:39-46.
Effect of repetitive transcranial magneticstimulation on the improvement of behavior and hippocampus BDNF expression in chronic stress-induced depression rats.
FEI Pengge,ZHAO Lin,REN Huicong,SONG Jinggui,ZHANG Zhaohui.
Second Affiliated Hospital of Xinxiang Medical University,Xinxiang 453002,China.Tel:0373-3373704.
ObjectiveTo explore the effects of repetitive transcranialmagnetic stimulation(rTMS)on the improvement of depressive behavior and the hippocampus brain derived neurotrophic factor(BDNF)expression in chronic stress-induced depression rats.To further investigate the possiblemolecularmechanism of rTMS treatment for depression.MethodsFortymale Sprague-Dawley rats of SPF grade were randomly divided into the blank control group(n=8) and the stress-induced group(n=30).Singly housing and chronic unpredictablemild stress(CUMS)were used to induce the depressionmodel in stress-induced group.Twenty-fourmodel ratswere divided into three groups:model group(with no further treatment),rTMSgroup(receiving 10 Hz rTMS intervention for 3 weeks)and shame group(receiving pseudo TMS treatments for 3 weeks).Weightmeasurement,sucrose consumption test and open-field testwere used to assess the behavior changes.The rat hippocampal CA3 area of BDNF positive staining cell number and expression levels of BDNF mRNA in hippocampuswere examined after intervention.ResultsThe weight reduction rate,score of sucrose consumption test and the score of open field testwere significantly higher in rTMS group than in model group(P<0.05).The numberof BDNF staining positive cells in the hippocampal CA3 areawas lower inmodel group and shame group than in the blank control group whereas was higher in the rTMS group than in themodel group(P<0.01).Compared with themodel group,the BDNF mRNA relative expression was significantly increased in the hippocampus of rTMS group(P<0.01).ConclusionrTMS can improve depressive behaviors of CUMS rats probably through the increase in expression of BDNF in the hippocampalneurons and neuronal regeneration.
Depression Repetitive transcranialmagnetic stimulation Hippocampus Brain derived neurotrophic factor
R749.4
A
2016-05-26)
(责任编辑:肖雅妮)
10.3969/j.issn.1002-0152.2016.10.004
☆河南省医学科技攻关计划项目(编号:201003071);2015新乡市科技攻关计划项目(编号:ZG15019)
*新乡医学院第二附属医院(新乡 453002)
△新乡医学院第一附属医院
