卒中及短暂性脑缺血发作患者不同部位脑萎缩的危险因素
2016-04-04杨洁区腾飞蒲蜀湘解龙昌殷建瑞何毅华杨新光姚海燕高聪
杨洁 区腾飞 蒲蜀湘 解龙昌 殷建瑞 何毅华 杨新光 姚海燕 高聪
卒中及短暂性脑缺血发作患者不同部位脑萎缩的危险因素
杨洁*区腾飞△蒲蜀湘*解龙昌*殷建瑞*何毅华*杨新光*姚海燕*高聪*
目的 脑萎缩是卒中后痴呆的重要危险因素,探索卒中及短暂性脑缺血发作患者不同部位脑萎缩的危险因素,为降低卒中后痴呆发的发生提供潜在干预靶点。方法纳入连续住院的卒中及短暂性脑缺血发作(transient ischemic attack,TIA)患者,采集患者一般危险因素及血管性危险因素,完成头颅MRI和/或头颅CT扫描及半定量测定,包括陈旧性腔隙性脑梗死数量、额叶萎缩、顶叶萎缩、颞中叶萎缩及广泛脑萎缩的程度。结果共519例卒中及TIA患者完成4种脑萎缩的测量。Logistic回归分析结果显示:除年龄外,女性(比数比OR= 2.447,P=0.007)、腔隙性脑梗塞病灶数(OR=1.414,P=0.027)是额叶萎缩的独立危险因素;缺血性卒中病史(OR= 2.224,P=0.024)是顶叶萎缩的独立危险因素;颅内/外大血管狭窄(OR=2.584,P=0.015)、脑白质变性评分(OR= 1.112,P=0.007)及腔隙性脑梗塞病灶数(OR=1.158,P=0.042)是颞中叶萎缩的独立危险因素;而糖尿病(OR= 2.109,P=0.001)、心房纤颤(OR=1.934,P=0.015)、脑白质变性评分(OR=1.098,P=0.002)是广泛脑萎缩的独立危险因素。结论糖尿病、心房纤颤、腔隙性脑梗塞数及脑白质变性是卒中及TIA患者脑萎缩的危险因素,可对对上述高危人群尽早干预,减小此类患者发生痴呆的可能。
脑卒中 短暂性脑缺血发作 脑萎缩
脑萎缩是卒中前及卒中后痴呆的重要危险因素[1-2]。明确脑萎缩的危险因素对于预防卒中后痴呆的发生发展具有重要意义。虽然既往的研究将脑萎缩归纳为痴呆的不可干预因素,但近期的研究表明脑萎缩可能是多种因素综合产生的结果,包括血管性危险因素,如糖尿病、心房纤颤[3-5],均具有干预的可能性。本研究旨在探索卒中患者多个部位脑萎缩的危险因素,包括额叶、颞叶、顶叶及广泛脑萎缩,以期为不同类型脑萎缩的预防和控制提供更多理论依据。
1 对象与方法
1.1 研究对象纳入本院神经内科及佛山市第二人民医院神经内科2012年7月至2013年6月间住院并确诊为卒中或TIA的患者,共549例,其中男239例,女205例,平均年龄(69.6±12.4)岁。其中出血性卒中38例(6.9%),缺血性卒中449例(71.8%),TIA患者62例(11.3%)。入选标准:①年龄≥18岁;②临床诊断为缺血性卒中或TIA。卒中按照世界卫生组织(World Health Organization,WHO)定义[6],指突发的局灶性或全面性神经功能缺损的临床征象,持续时间超过24 h。③脑血管事件发生的时间距就诊日期在14 d内;④获得患者本人或者合法监护人知情同意,并签字。TIA诊断标准采用NIH在1990年制定的脑血管病分类III中的定义:由于局部脑或视网膜缺血引起的短暂性神经功能缺损发作,典型临床症状持续不超过24 h[7]。排除标准:①无症状及体征的静止性脑梗死;②非脑血管病事件;③发病至就诊的时间超过14 d;④拒绝参与评估者。本研究通过广州医科大学附属第二医院及佛山市第二人民医院伦理委员会审查。所有患者及家属签署知情同意书。
1.2 研究方法采用统一的调查表进行数据搜集,内容包括患者的一般情况(人口学特征)、既往史(高血压、高脂血症、糖尿病、心脏病等)、此次卒中的类型(出血性、缺血性、TIA,其中缺血性卒中按照TOAST分型明确及发病机制)及严重程度(来院时NIHSS评分)、个人生活方式(吸烟、饮酒习惯)、辅助检查(空腹血糖、血脂、颈动脉及颅内动脉狭窄的测量)。详细的危险因素定义如下:高血压(安静状况下收缩压≥140 mmHg和/或舒张压≥90mmHg或使用降压药物),高脂血症(空腹总胆固醇浓度≥5.2mmol/L,或空腹低密度脂蛋白浓度≥2.6mmol/L,或空腹甘油三脂≥1.7mmol/L,或使用降脂药),糖尿病空腹血糖≥7.0mmol/L,或随机血糖≥11.1mmol/L),缺血性心脏病(既往有心肌梗塞,或心绞痛,或冠脉成形术,或冠脉搭桥术病史),心房纤颤(入院前或后至少一次心电图提示),吸烟(既往曾有),饮酒(既往曾有),颈动脉狭窄(由颈动脉彩超测量,≥50%狭窄),颅内动脉狭窄(由磁共振动脉成像测量[8]:≥50%狭窄;或经颅多普勒测量[9]:大脑中动脉平均血流速度Vm≥140 cm/s;颈内动脉颅内段Vm≥120 cm/s;大脑前动脉Vm≥120 cm/s;大脑后动脉及椎动脉/基底动脉Vm≥100 cm/s)。
其他脑部结构影像学指标采集均采用既往发表的方法,使用磁共振(magnetic resonance imaging-T1weighted,MRI-T1)加权,MRI-T2加权及液体衰减翻转恢复(fluid attenuated inversion recovery, FLAIR)序列扫描。未做MRI的患者,使用计算机断层(computed tomography,CT)扫描结果进行评估。以下观察指标在CT/MRI图像中的测量均具有较好的一致性[8],包括:脑白质病变(whitematter changes,WMC)[10]:0分,无WMC;1分,有散在斑片状WMC;2分,部分融合WMC;3分,大面积融合WMC。额叶萎缩及顶叶萎缩[11]:0分,无;1分,轻-中度;2分,重度。广泛脑萎缩(global brain atrophy,GBA):使用脑室-大脑比(ventricle-to-brain ratio,VBR)测定法进行测量[12]。内侧颞叶萎缩(medial temporal atrophy,MTA)[13]:0分,无;1分,轻度;2分,中度;3分,重度;4分,极重度。陈旧性腔隙性脑梗死[14]及脑部微出血[15]:记录其部位及个数。
1.3 统计学方法应用SPSS16.0统计软件进行数据处理。先应用卡方检验或t检验对入选因素进行单因素分析,筛选出对脑萎缩有统计学差异的影响因素。其中,部分半定量因素再分组后进行分析,以上分析均采用既往已发表的方法进行[16-17]。将单因素分析中有意义的变量引入多因素Logistic回归分析,以比数比(OR)值及95%置信区间(95%CI)估计各因素的危险度。检验水准α=0.05,双侧检验。
2 结果
所有549个入组病例中,共519例完成了所有脑区萎缩的影像学评价,并进行了以下分析。
2.1 单因素分析将有无各对应脑区萎缩的患者分为两组,组间比较分析显示,与无对应脑区萎缩的患者相比,各对应脑区萎缩的患者年龄均显著增高。除此之外,女性(P=0.045)、缺血性脑卒中病史(P=0.016)、脑白质变性(P<0.001)及腔隙性脑梗塞(P<0.001)在额叶萎缩的患者中比例更高;缺血性卒中病史(P=0.003)在顶叶萎缩的患者比例中更高;入院时NIHSS(P<0.001)、吸烟史(P<0.001)、缺血性心脏病(P=0.001)、心房纤颤(P=0.014)、颅内/外动脉狭窄(P=0.004)、脑白质变性(P<0.001)、腔隙性脑梗塞(P<0.001)在颞中叶萎缩的患者中增加;而入院时NIHSS(P<0.001)、糖尿病(P=0.002)、心房纤颤(P<0.001)、缺血性脑卒中病史(P=0.024)、脑白质变性(P<0.001)及腔隙性脑梗塞(P<0.001)在广泛脑萎缩的患者中增加。并且除顶叶外,额叶、颞中叶及广泛脑萎缩互为影响(见表1-4)。
2.2 多因素Logistic回归分析将单因素分析中有意义的危险因素分别引入多因素Logistic回归分析,结果显示:除年龄外,女性(比数比OR=2.447, P=0.007)、腔隙性脑梗塞病灶数(OR=1.414,P= 0.027)是额叶萎缩的独立危险因素;缺血性卒中病史(OR=2.224,P=0.024)是顶叶萎缩的独立危险因素;颅内/外大血管狭窄(OR=2.584,P=0.015)、脑白质变性评分(OR=1.112,P=0.007)及腔隙性脑梗塞病灶数(OR=1.158,P=0.042)是颞中叶萎缩的独立危险因素;而糖尿病(OR=2.109,P=0.001)、心房纤颤(OR=1.934,P=0.015)、脑白质变性评分(OR= 1.098,P=0.002)是广泛脑萎缩的独立危险因素;除顶叶外,额叶、颞中叶及广泛脑萎缩互为独立危险因素(见表5)。
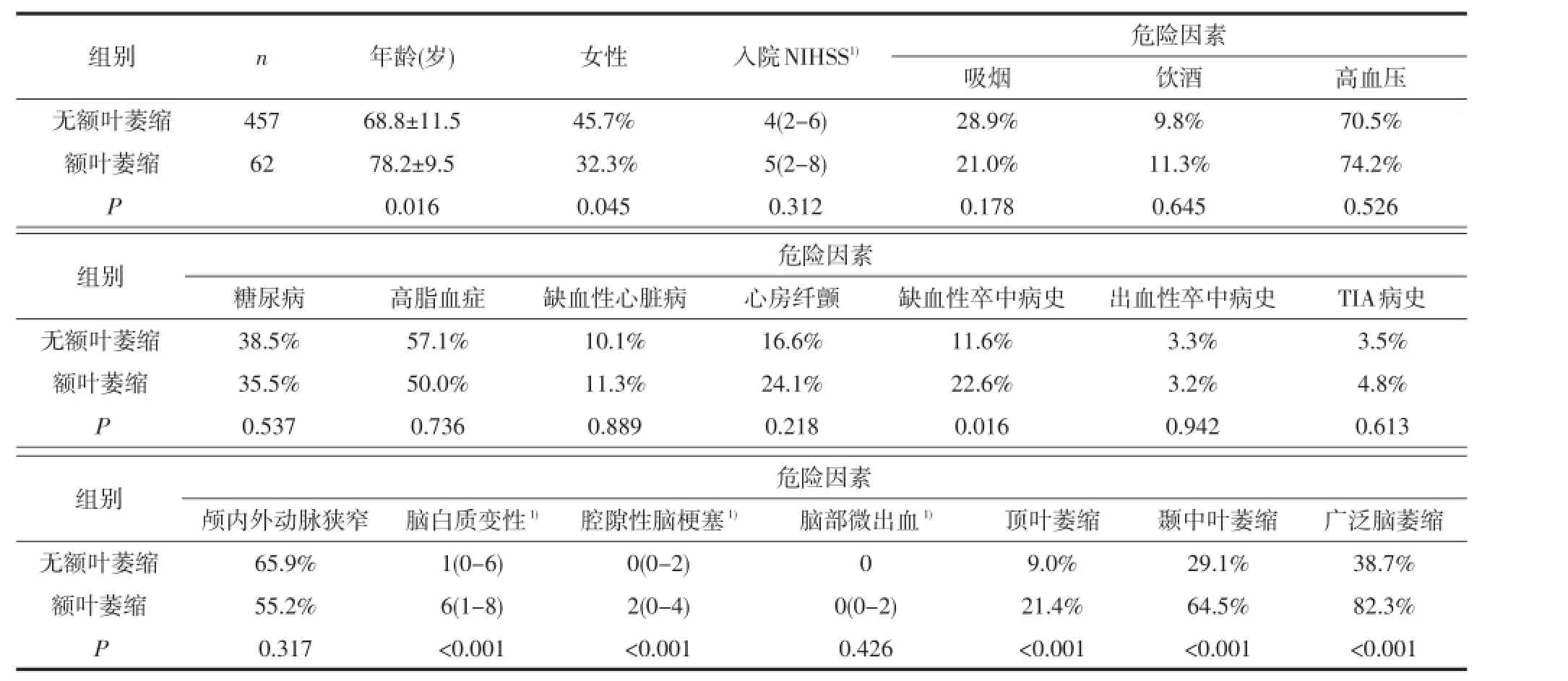
表1 卒中及TIA患者有无额叶萎缩的临床资料比较

表2 有无顶叶萎缩的患者临床资料比较
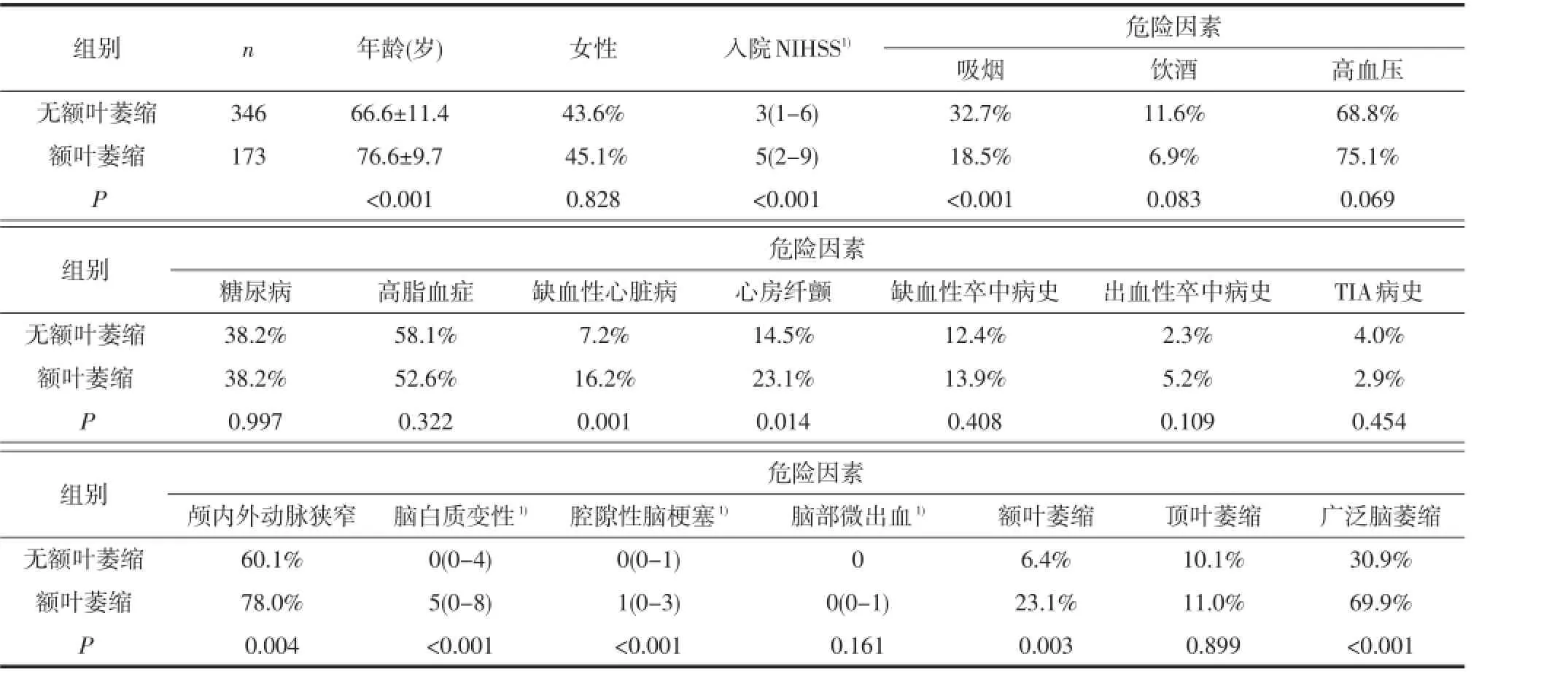
表3 有无内侧颞叶萎缩的患者临床资料比较
3 讨论
本研究的结果显示,年龄是不同类型脑萎缩的独立危险因素,提示脑萎缩部分原因为无法干预的退行性改变。同时我们还发现,脑白质变性、腔隙性脑梗塞病灶、糖尿病、房颤等是卒中及TIA患者多种不同部位脑萎缩的独立危险因素,提示以上上述病变可能参与了脑部退行性改变的发生发展。
本研究发现脑白质变性是颞中叶萎缩及广泛
脑萎缩的独立危险因素,与既往研究结果一致[18]。白质变性导致脑萎缩的机制可能包括:①白质纤维间联系的破坏导致皮层的继发性损伤[19];②皮层的低灌注及微小梗塞灶依靠目前的影像学技术暂无法观察到,但有可能导致白质变性,最终形成皮层萎缩的原因[19];③皮层神经元丢失可能导致白质的轴索及髓鞘脱失[20]。但也有其他研究认为皮层萎缩可能是AD的前期改变,而白质变性是伴随病变,二者并无因果关系[21]。可见脑白质变性与脑萎缩的关系暂未完全明确,所以在目前研究的基础上对脑白质变性患者进行随访,开展更多的前瞻性研究,或者采用动物模型研究进行机制探讨是十分必要的。
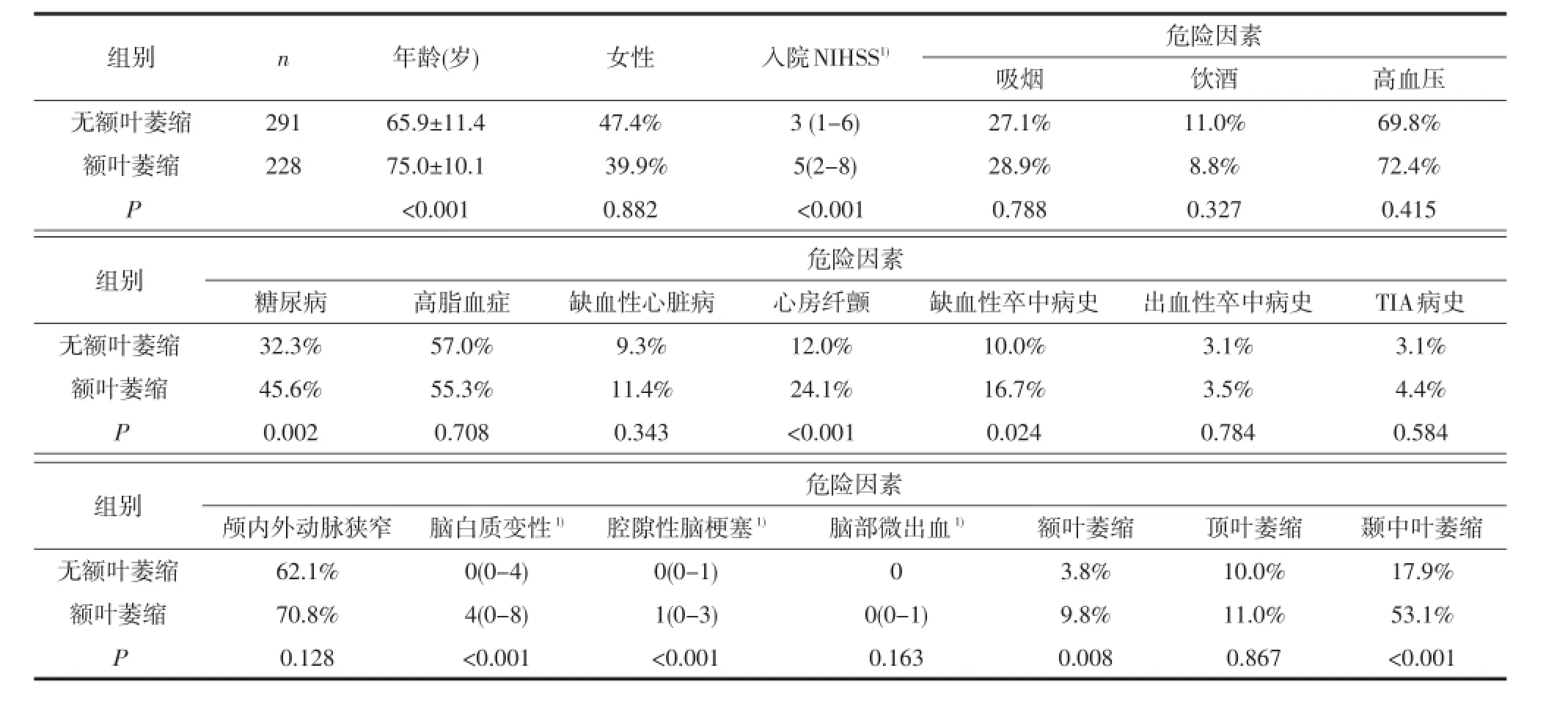
表4 有无广泛脑萎缩的患者临床资料比较
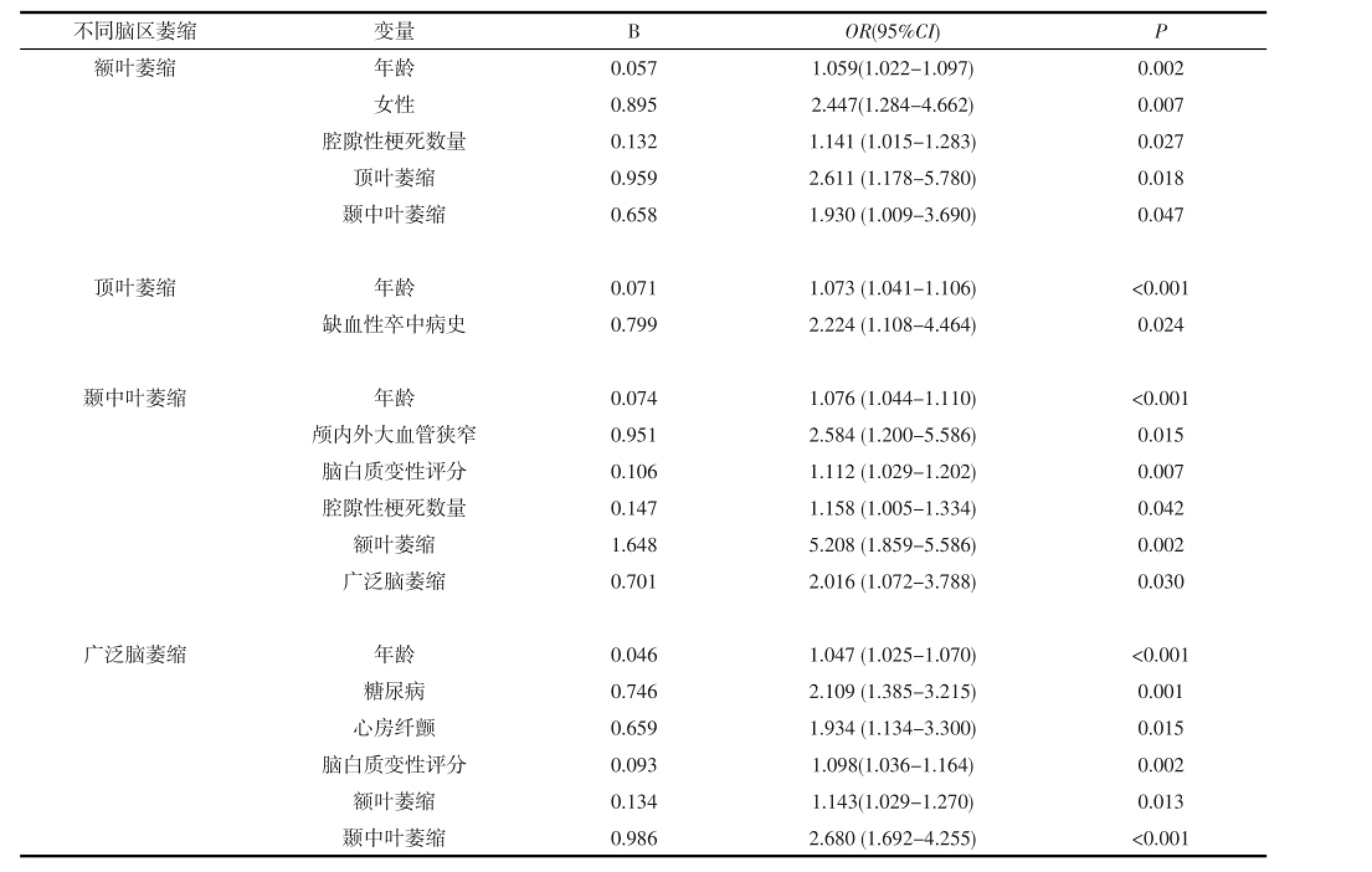
表5 Logistic回归分析显示不同脑区萎缩的独立危险因素
腔隙性脑梗塞也是脑部小血管病变的重要形式。前瞻性研究表明腔隙性梗塞灶数目的增加和全脑萎缩的加剧呈正相关[22]。既往对腔隙性脑梗塞在脑萎缩的作用机制未做单独探讨,多脑白质变性合并讨论[23],可能由于两者具有相同的发病机制。然而就广泛脑萎缩而言,腔隙性脑梗塞是独立于白质变性的危险因素,提示两者各自发挥独立作用[22]。
除脑部小血管病变外,本研究发现颅内外大血管狭窄是颞中叶萎缩的独立危险因素。既往研究亦发现双侧颈动脉或单侧严重的颈动脉狭窄可导致广泛的皮层及皮层下萎缩[24]。可能的机制包括由于脑部灌注减少,导致双侧皮层缺血缺氧,从而触发微循环障碍并加重神经退行性改变[25]。此外,颈动脉狭窄与广泛脑萎缩的关系并不受脑部病灶大小的影响[24],且可能是通过脑白质变性进行调节的[26]。但颅内外大动脉狭窄如何导致局限性的颞叶内侧萎缩,仍需进一步研究以明确。
除影像学因素外,本研究发现心房纤颤是广泛脑萎缩的独立危险因素,可能的机制包括:①房颤导致血流动力学异常,心脏输出降低,影响脑灌注[27];②房颤可导致反复的和/或多发的脑部梗死病灶;③房颤导致多发的无症状的脑部微小栓子[28]。以上因素单独或同时出现,导致脑部广泛受损。此外,糖尿病也是广泛脑萎缩的独立危险因素,与近期在老年女性人群中的研究结果一致[29]。其原因可能包括:①糖尿病患者体内蓄积的晚期糖化终产物导致胶质细胞活化,触发并加重炎症反应,产生AD样的退行性脑部改变,尤其是皮层萎缩[30-31];②胰岛素抵抗可导致血管内皮受损,管腔狭窄,从而导致脑部小血管病变,皮层间接受累[32]。这些结果提示我们控制上述危险因素有可能缓解脑萎缩的进展,但干预方法仍需进一步探索。
综上,本研究提示:除年龄外,卒中及TIA患者不同部位脑萎缩的危险因素各异,但仍有较多可干预因素:包括心房纤颤、糖尿病、腔隙性脑梗塞及脑白质变,使我们进一步明确了脑萎缩的发生机制,为我们进行干预治疗提供了理论依据。我们应针对上述因素积极予以干预,同时开展相应的前瞻性研究,以探讨更多更有效的治疗脑萎缩的方法和可行性,从而降低卒中及TIA后痴呆的发生。
[1] PENDLEBURY ST.Dementia in patients hospitalized with stroke:rates,time course,and clinico-pathologic factors[J].Int JStroke,2012,7(7):570-581.
[2] PENDLEBURY ST,ROTHWELL PM.Prevalence,incidence, and factors associated with pre-stroke and post-stroke dementia:a systematic review and meta-analysis[J].Lancet Neurol, 2009,8(11):1006-1018.
[3] CHEN Y,WANG J,ZHANG J,et al.Aberrant functional networks connectivity and structural atrophy in silent lacunar infarcts:relationship with cognitive impairments[J].J Alzheimers Dis,2014,42(3):841-850.
[4] QURESHIAI,SAED A,TASNEEM N,et al.Neuroanatomical correlates of atrial fibrillation:a longitudinal MRI study[J].J Vasc Interv Neurol,2014,7(5):18-23.
[5] ESPELANDMA,BRINTON RD,MANSON JE,et al.Postmenopausal hormone therapy,type 2 diabetesmellitus,and brain volumes[J].Neurology,2015,85(13):1131-1138.
[6] The World Health Organization MONICA Project(monitoring trends and determinants in cardiovascular disease):a major international collaboration.WHO MONICA Project Principal Investigators[J].JClin Epidemiol,1988,41(2):105-114.
[7] Special report from the National Institute of Neurological Disorders and Stroke.Classification of cerebrovascular diseases III [J].Stroke,1990,21(4):637-676.
[8]YANG J,WONG A,WANG Z,et al.Risk factors for incident dementia after stroke and transient ischemic attack[J].Alzheimers Dement,2015,11(1):16-23.
[9] WONG KS,LIH,CHAN YL,et al.Use of transcranial Doppler ultrasound to predict outcome in patients with intracranial large-artery occlusive disease[J].Stroke,2000,31(11): 2641-2647.
[10] XIONGY,YANG J,WONGA,et al.Operationaldefinitions improve reliability of the age-related white matter changes scale [J].Eur JNeurol,2011,18(5):744-749.
[11] VICTOROFF J,MACK WJ,GRAFTON ST,et al.A method to improve interrater reliability of visual inspection of brain MRI scans in dementia[J].Neurology,1994,44(12):2267-2276.
[12] DEGROOT JC,DE LEEUW FE,OUDKERKM,et al.Cerebral whitematter lesions and cognitive function:the Rotterdam Scan Study[J].Ann Neurol,2000,47(2):145-151.
[13] SCHELTENSP,LEYSD,BARKHOFF,et al.Atrophy ofmedial temporal lobes on MRI in"probable"Alzheimer's disease and normal ageing:diagnostic value and neuropsychological correlates[J].J Neurol Neurosurg Psychiatry,1992,55(10): 967-972.
[14] POTTER GM,MARLBOROUGH FJ,WARDLAW JM.Wide variation in definition,detection,and description of lacunar lesionson imaging[J].Stroke,2011,42(2):359-366.
[15] CORDONNIER C,POTTER GM,JACKSON CA,et al.improving interrater agreement about brain m icrobleeds:development of the Brain Observer Micro Bleed Scale(BOMBS)[J].Stroke, 2009,40(1):94-99.
[16] 杨洁,区腾飞,解龙昌,等.卒中前痴呆的危险因素分析[J].中国神经精神疾病杂志,2015,41(12):724-727.
[17] 杨洁,区腾飞,解龙昌,等.短暂性脑缺血发作及轻型卒中患者认知功能下降的随访研究[J].中国神经精神疾病杂志, 2015,41(2):98-101.
[18] SMITH EE,O'DONNELL M,DAGENAISG,et al.Early cerebral small vessel disease and brain volume,cognition,and gait [J].Ann Neurol,2015,77(2):251-261.
[19] SCHMIDTR,ROPELES,ENZINGER C,et al.Whitematter lesion progression,brain atrophy,and cognitive decline:the Austrian stroke prevention study[J].Ann Neurol,2005,58(4): 610-616.
[20] GODIN O,MAILLARD P,CRIVELLO F,et al.Association of white-matter lesions with brain atrophymarkers:the three-city Dijon MRIstudy[J].Cerebrovasc Dis,2009,28(2):177-184.
[21] TULADHAR AM,REID AT,SHUMSKAYA E,et al.Relationship between white matter hyperintensities,cortical thickness, and cognition[J].Stroke,2015,46(2):425-432.
[22] KLOPPENBORG RP,NEDERKOORN PJ,GROOL AM,et al. Cerebral small-vessel disease and progression of brain atrophy: the SMART-MR study[J].Neurology,2012,79(20):2029-2036.
[23] NITKUNAN A,LANFRANCONI S,CHARLTON RA,et al. Brain atrophy and cerebral small vessel disease:a prospective follow-up study[J].Stroke,2011,42(1):133-138.
[24] MULLER M,VAN DER GRAAF Y,ALGRA A,et al.Carotid atherosclerosis and progression of brain atrophy:the SMART-MR study[J].Ann Neurol,2011,70(2):237-244.
[25] VERNIERIF,PASQUALETTIP,MATTEISM,et al.Effect of collateral blood flow and cerebral vasomotor reactivity on the outcome of carotid artery occlusion[J].Stroke,2001,32(7): 1552-1558.
[26] APPELMAN AP,VAN DER GRAAF Y,VINCKEN KL,et al. Total cerebral blood flow,white matter lesions and brain atrophy:the SMART-MR study[J].J Cereb Blood Flow Metab, 2008,28(3):633-639.
[27] CHOUDHURY A,LIPGY.Atrial fibrillation and the hypercoagulable state:from basic science to clinical practice[J].Pathophysiol Haemost Thromb,2003,33(5-6):282-289.
[28] TINKLER K,CULLINANEM,KAPOSZTA Z,et al.Asymptomatic embolisation in non-valvular atrial fibrillation and its relationship to anticoagulation therapy[J].Eur J Ultrasound,2002, 15(1-2):21-27.
[29] ESPELAND MA,BRYAN RN,GOVEAS JS,et al.Influence of type 2 diabetes on brain volumesand changes in brain volumes: results from the Women's Health Initiative Magnetic Resonance Imaging studies[J].Diabetes Care,2013,36(1):90-97.
[30] SRIKANTH V,WESTCOTT B,FORBES J,et al.Methylglyoxal, cognitive function and cerebral atrophy in older people[J].J Gerontol A Biol Sci Med Sci,2013,68(1):68-73.
[31] MORAN C,MUNCH G,FORBES JM,et al.Type 2 diabetes, skin autofluorescence,and brain atrophy[J].Diabetes,2015,64 (1):279-283.
[32] TIRSIA,DUONG M,TSUIW,et al.Retinal vessel abnormalities as a possible biomarker of brain volume loss in obese adolescents[J].Obesity(Silver Spring),2013,21(12):E577-E585.
Risk factors for different brain region atrophy among stroke and transient ischemic attack patients.
YANG Jie,OU Tengfei,PU Shuxiang,XIE Longchang,YIN Jianrui,HE Yihua,YANG Xin'guang,YAO Haiyan,GAO Cong.
Department of Neurology,the Second Affiliated Hospital of Guangzhou Medical University,Guangzhou 510260,China.Tel: 020-34153276.
ObjectivesBrain atrophy plays a key role in post-stroke dementia.The current study aims to explore risk factors for brain atrophy in different regions in order to find the ultimate therapeutic strategy.MethodsConsecutive stroke and/or transient ischemic attack(TIA)patientswere recruited from July 2012 to June.The clinical features,neuroimaging findings and risk factors were collected during hospitalization.Logistic regression analysis showed that,except for age,female gender(Odds ratio,OR=2.447,P=0.007)and the number of silent lacuna infarcts(OR=1.414,P=0.027) were independent risk factors for frontal lobe atrophy.Ischemic stroke history(OR=2.224,P=0.024)was the independent risk factor for parietal lobe atrophy.All of extra-/intracranial larger artery diseases(OR=2.584,P=0.015)and whitematter severity score(OR=1.112,P=0.007)aswell as the number of silent lacuna infarcts(OR=1.158,P=0.042)were independent risk factors formedial temporal lobe atrophy.Moreover,diabetes(OR=2.109,P=0.001),atrial fibrillation(OR= 1.934,P=0.015)and whitematter severity score(OR=1.098,P=0.002)were independent risk factors for global brain atrophy.ConclusionRisk factors for brain atrophy included diabetes,atrial fibrillation,silent lacuna infarcts and whitematter changes.We should paymore attention to those patientswith above risk factors in order to slow down the progression of brain atrophy and also prevent them from dementia by early interventions.
Stroke Transient ischemic attack Brain atrophy
R743.3
A
2016-01-24)
(责任编辑:李立)
10.3969/j.issn.1002-0152.2016.10.008
*广州医科大学附属第二医院神经内科(广州 510260)
△佛山市第二人民医院神经内科
