西红花组培球茎诱导关键技术
2016-03-31高广春徐洪娜尹阿丽
李 军,李 白,高广春,徐洪娜,尹阿丽
(1.嘉兴市农业科学研究院,浙江嘉兴 314016; 2.嘉兴学院医学院,浙江嘉兴 314001)
西红花组培球茎诱导关键技术
李 军1,李 白1,高广春2,徐洪娜2,尹阿丽2
(1.嘉兴市农业科学研究院,浙江嘉兴 314016; 2.嘉兴学院医学院,浙江嘉兴 314001)
摘 要:以西红花无菌组培芽为研究材料,研究不同固相支持物和有机添加物对西红花组培球茎的诱导作用。研究发现,以LS为基本培养基,添加0.5 mg·L-1NAA、50 g·L-1香蕉泥、20 g·L-1土豆泥及8 g·L-1卡拉胶对西红花组培球茎诱导效果最好,组培球茎诱导率达100%,球茎平均直径达8.52 mm。
关键词:西红花;球茎;组培
DOI 10.16178/j.issn.0528-9017.20160222
西红花(Crocus sativus L.)又名藏红花、番红花,为鸢尾科番红花属多年生草本植物,以干燥柱头入药。柱头中的有效成分如西红花苷、西红花苦苷、西红花酸及西红花醛等具有抗癌活性,有较高的药用价值和经济价值[1-2]。西红花为三倍体植物,不能进行有性繁殖,主要靠分球繁殖,繁殖系数只有1.5左右,且常年无性使病毒累积易造成品质退化,影响产量和质量。另外,西红花只是柱头入药,产量极低,远不能满足市场需要[2]。
近年植物组织培养技术在药用植物上得到广泛应用,通过组织培养技术可快速获得大量组培苗,解决药用植物资源短缺的问题。关于西红花组培快繁已有较多报道,包括球茎诱导直接成芽[3-8]及球茎诱导愈伤组织然后分化成芽[9-16],另外还有关于藏红花素高产细胞系的筛选等[17]。西红花组培快繁最终目的是获得组培球茎,通过现有技术获得的组培球茎只有5 mm左右,在球茎诱导率、生根及大球茎培育方面还需进一步提高[18],以提高移栽成活率。本研究以西红花无菌组培芽为研究材料,研究不同固相支持物和有机添加物对西红花组培球茎的诱导作用。
1 材料与方法
以通过西红花球茎诱导获得的丛生芽为研究材料,丛生芽保存在嘉兴市农科院组培室内。
丛生芽高3~4 cm时,将丛生芽切成单个芽进行组培球茎诱导试验,每种培养基接种10棵芽,设3次重复。
将单个芽接种到下列培养基上:①LS + NAA 0.5 mg·L-1+琼脂8 g·L-1;②LS +NAA 0.5 mg· L-1+卡拉胶8 g·L-1;③LS + NAA 0.5 mg·L-1+卡拉胶8 g·L-1+香蕉泥50 g·L-1;④LS + NAA 0.5 mg·L-1+卡拉胶8 g·L-1+香蕉泥60 g·L-1; ⑤LS +NAA 0.5 mg·L-1+卡拉胶8 g·L-1+香蕉泥70 g·L-1;⑥LS + NAA 0.5 mg·L-1+卡拉胶8 g·L-1+土豆泥20 g·L-1;⑦LS +NAA 0.5 mg· L-1+卡拉胶8 g·L-1+土豆泥30 g·L-1;⑧LS + NAA 0.5 mg·L-1+卡拉胶8 g·L-1+土豆泥40 g· L-1;⑨LS +NAA 0.5 mg·L-1+卡拉胶8 g·L-1+香蕉泥50 g·L-1+土豆泥20 g·L-1。上述培养基均添加50 g·L-1蔗糖,调pH至5.8。
培养条件为温度(20±2)℃,每日光照16 h,光照强度1 500~2 000 lx。培养60 d后,从培养瓶中取出西红花组培球茎,观察球茎及生根状况,统计球茎数量、直径、生根数及根长,计算3次平均值及球茎诱导率。
2 结果与分析
2.1固相支持物对西红花组培球茎诱导的作用
将西红花组培芽转接到分别以琼脂和卡拉胶作为固相支持物的LS培养基上,添加0.5 mg·L-1NAA,观察不同固相支持物对西红花组培球茎的诱导作用。观察发现,接种芽经过一段时间的培养后,叶鞘内绿色的幼叶逐渐萎缩,基部开始膨大,45 d左右发育为小球茎,同时芽基部开始生根。培养60 d后,分别统计①,②号培养基中球茎数量、直径、生根数及根长。
由表1可知,②号培养基在小球茎诱导率、球茎直径、生根数及根长各方面均优于①号培养基,球茎诱导率达93.3%,平均直径为5.54 mm。另外,①,②号培养基中小球茎生根均出现翘根现象,根质较硬,且直立,长时间培养后根会将小球茎顶离培养基;②号培养基对芽褐化有较好抑制作用,褐化现象较轻。通过比较发现,西红花组培球茎诱导过程中,卡拉胶作为培养基固相支持物优于琼脂。

表1 琼脂和卡拉胶对西红花组培球茎诱导的影响
2.2有机添加物对西红花组培球茎诱导的作用
通过固相支持物对西红花组培球茎诱导作用的研究发现,卡拉胶较适合作为该培养阶段的固相支持物,但获得的球茎较小,同时有翘根现象,影响小球茎养分吸收。为改善球茎根系,提高球茎直径,本研究设定③~⑨号共7种培养基配方,分别添加不同浓度的香蕉泥和土豆泥,研究有机添加物对西红花组培球茎的诱导用。观察发现,同①,②号培养基相似,接种芽经过一段时间培养后,叶鞘内绿色幼叶逐渐萎缩,基部开始膨大,经40 d左右发育为小球茎,同时芽基部开始生根。
统计结果(表2)表明,添加香蕉泥对改善球茎根系有较好的促进作用,根质变软,生根数和根长均有增加,同时球茎也有增大。以添加50 g· L-1香蕉泥效果最好,球茎诱导率达100%,球茎直径达6.77 mm,生根数达9.3;添加土豆泥对改善球茎根系有一定的促进作用,对球茎膨大效果促进作用明显,以添加20 g·L-1土豆泥效果最好,球茎直径达8.22 mm;同时添加50 g·L-1香蕉泥和20 g·L-1土豆泥的⑨号培养基效果最好,均优于单独添加香蕉泥和土豆泥的培养基,球茎诱导率达100%,球茎直径达8.52。因此,香蕉泥和土豆泥对于西红花组培球茎的诱导具有协同作用,香蕉泥可改善根系,土豆泥可提高球茎直径。
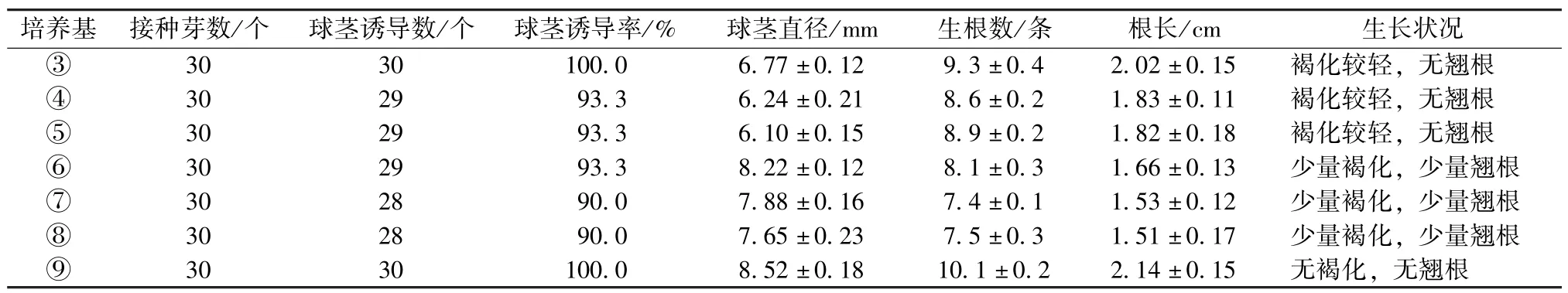
表2 有机添加物对西红花组培球茎诱导的影响
3 讨论
西红花组培球茎的诱导是西红花组培快繁体系建立的关键。通过前期研究发现,以琼脂为固相支持物,在不添加任何有机物的培养基上,培养获得的球茎易出现翘根现象,影响了组培球茎的养分吸收,从而获得的组培球茎较小。本研究以LS为基本培养基,添加0.5 mg·L-1NAA作为外源激素,研究了不同固相支持物和有机添加物对组培球茎的诱导作用。结果发现,以卡拉胶作为固相支持物对于组培球茎褐化现象具有较好的抑制效果,添加香蕉泥对于改善球茎根系效果显著,添加土豆泥对于培育大球茎有促进作用,这与这些物质在其他植物组培快繁体系建立中的研究报道一致[19-20]。通过研究发现,培养基LS + NAA0.5 mg·L-1+卡拉胶8 g·L-1+香蕉泥50 g·L-1+土豆泥20 g·L-1对于西红花组培球茎诱导效果最好,经60 d培养后,组培球茎诱导率达100%,球茎平均直径达8.52 mm,满足移栽要求,有助于提高移栽成活率。相比国内外报道的西红花组培球茎诱导效果而言,本研究在诱导率和球茎大小方面均有提高,为西红花大规模组培快繁提供了理论基础。
参考文献:
[1]KAYE W.Crocus sativus (saffron ):a monograph[J].Australian Journal of Herbal Medicine,2014,26 (1):18-21.
[2]MUSHTAQ A,GUL Z,MEHFUZA H,et al.Saffron (Crocus sativus L.) in the light of biothchnological approaches:A review[J].Scientific Reshearch and Essays,2014,9 (2):13-18.
[3]何凯,颜钫,唐琳,等.藏红花球茎诱导丛生芽及球茎再生[J].四川大学学报(自然科学版),2002,39 (6):1127-1130.
[4]陈书安,陈文浩,王晓东,等.无毒藏红花组培芽的获取及其病毒检测[J].高技术通讯,2006,16 (11 ):1170-1175.
[5]陈文浩,欧元,赵兵,等.番红花球茎的快速高频诱导[J].过程工程学报,2007,7 (1):129-132.
[6]SHARMA K D,RATHOUR R,SHARMA R,et al.In vitro cormlet development in Crocus sativus[J].Biologia Plantarum,2008,52 (4):709-712.
[7]GOLANDAM S,HASSAN E.Interaction of IBA and NAA with enzymes in root induction of Crocus sativus (L)[J].African Journal of Biothchnology,2010,9 (2):217-225.
[8]EVRIM Z,SERTAC O,ZEKI K.Improved in vitro micropropagation method with adventitious corms and roots for endangered saffron[J].Central European Journal of Biology,2012,7 (1):138-145.
[9]陈书安,王晓东,欧阳杰,等.藏红花球茎愈伤组织快速诱导的研究[J].中国药学杂志,2003,38 (4 ):254-256.
[10]王磊,李学文,娄玉霞,等.番红花组织培养的初步研究[J].河南中医学院学报,2006,21 (3):30-31.
[11]张洁,林春来,王力超,等.西红花球茎组织培养的研究[J].西南师范大学学报,2007,32 (1):68-72.
[12]袁丽红,陆玉婷,黄晶.藏红花愈伤组织诱导和褐化抑制[J].南京工业大学学报,2009,31 (6):21-26.
[13]汪洋,韩婷,朱昱,等.番红花组织培养及快速繁殖研究[J].中草药,2009,40 (5):807-809.
[14]SILVIA B,ENRIQUE O,JOSE A H,et al.Somatic embryogenesis in saffron (Crocus sativus L.).Histological differentiation and implication of some components of the antioxidant enzymatic system[J].Plant Cell Tissue & Organ Culture,2009,97:49-57.
[15]王寿芹,赵永钦,刘莉莎,等.藏红花愈伤组织的诱导及植株再生[J].西南农业学报,2011,24 (1):369-372.
[16]GEORGE P S,VISVANATH S,RAVISHANKAR G A,et al.Tissue culture of saffron (Crocus Sativus L.):Somatic embryogenesis and shoot regeneration[J].Food Biotechnology,2012,6 (3):217-223.
[17]陈书安,王晓东,赵兵,等.产藏红花素1 (crocin)愈伤组织的诱导及其细胞系的筛选[J].植物学通报,2004,21 (4):455-460.
[18]MIR J I,AHMED N,SHAFI W,et al.In vitro development and regeneration of microcorms in saffron (Crocus sativus L) [J].African Journal of Biotechnology,2014,13 (26):2637-2640.
[19]李亮,张冬敏,雷华辉,等.植物组织培养中有机添加物应用研究[J].宁夏农林科技,2012,53 (2):28-30.
[20]罗智敏,王炳君,李戌彤,等.卡拉胶和琼脂为固定物对马铃薯脱毒组培苗生长的影响[J].中国马铃薯,1997 (2):73-75.
(责任编辑:张瑞麟)
作者简介:李 军(1981—),男,山东泰安人,博士,主要从事植物生物技术研究工作,E-mail:lijunjx1@163.com。
基金项目:嘉兴市科技计划项目(2013BY26006)
收稿日期:2015-10-22
中图分类号:S567
文献标志码:B
文章编号:0528-9017(2016)02-0211-03
文献著录格式:李军,李白,高广春,等.西红花组培球茎诱导关键技术[J].浙江农业科学,2016,57 (2):211-213.
