沙培林膀胱灌注的临床观察及实验研究
2016-03-30王宁卫超MusaMale王珅彭鄂军叶章群陈志强
王宁 卫超 Musa Male 王珅 彭鄂军 叶章群 陈志强
·临床研究·
沙培林膀胱灌注的临床观察及实验研究
王宁 卫超 Musa Male 王珅 彭鄂军 叶章群 陈志强
目的 初步探索沙培林膀胱灌注治疗的安全性、有效性和作用机制。 方法 ①临床研究:收集膀胱肿瘤术后行沙培林膀胱灌注治疗的患者40例,检测灌注前后尿液中细胞因子IL-2、TNF-α、INF-γ的含量,术后6个月复查膀胱镜。②动物实验:取雌性大鼠75只,分为空白对照组(15只)、生理盐水灌注组(15只)、沙培林灌注组(15只)、BCG灌注组(15只)和大肠杆菌灌注组(15只),每周灌注治疗一次,6周后停止灌注。从每组中随机选取10只大鼠,处死后取其膀胱三角区组织做病理切片,观察并比较免疫细胞浸润情况,同时行免疫组化分析,检测IL-2、TNF-α、INF-γ在组织中的表达情况。剩余25只大鼠不做任何处理,饲养2个月后全部处死,取其膀胱三角区组织做病理切片,观察停止灌注后膀胱组织是否出现慢性炎性改变。 结果 ①临床研究:膀胱肿瘤术后膀胱灌注沙培林,尿中细胞因子IL-2、TNF-α、INF-γ均显著升高。6个月后复查膀胱镜见炎性改变且均未见肿瘤复发,不良反应发生率低。②动物实验:膀胱灌注6周后大鼠膀胱免疫细胞浸润情况与细胞因子IL-2、TNF-α、INF-γ的表达相似:大肠杆菌组>沙培林组≈BCG组>生理盐水组>空白对照组;停止膀胱灌注2个月后,大肠杆菌组表现为膀胱炎性改变,其余各组几乎均表现为正常尿路上皮。 结论 沙培林与BCG等免疫调节剂作用机制相似,通过引起膀胱上皮炎性反应,增强病变部位的免疫功能,从而识别并清除变异细胞,且在一段时间后能自行恢复为正常尿路上皮,不引起慢性炎性改变,沙培林是一种安全、有效的免疫调节剂。
沙培林; 膀胱灌注; 膀胱肿瘤; 细胞因子
沙培林(sapylin,OK-432)是一种由人源A组溶血性链球菌Su株(低毒变异株)经处理后获得的新的免疫调节剂。目前沙培林通过全身或局部途径广泛应用于癌性胸腹水、肺癌、胃癌、肝癌、乳腺癌、淋巴管癌等实体瘤及其转移灶中,并取得了良好疗效[1-3]。有关沙培林在泌尿系肿瘤中的应用,已有文献报道,但具体疗效及作用机理还有待进一步的临床观察[4]。有研究表明沙培林可通过激活免疫细胞分泌细胞因子IL-2、TNF-α、INF-γ,抑制膀胱癌细胞的增殖和转移[5]。 IL-2是T细胞分泌的一种细胞因子, 它能激活自然杀伤细胞、巨噬细胞、细胞毒T淋巴细胞, 并加强T细胞介导的细胞免疫反应。TNF-α、INF-γ由T细胞和巨噬细胞分泌, 能激活巨噬细胞、刺激T细胞增殖, 且对肿瘤细胞有直接的细胞毒作用。本研究通过对细胞因子IL-2、TNF-α、INF-γ的定量、定性分析,探讨沙培林激活细胞免疫,增强局部免疫功能达到预防病变复发的疗效及作用机制。
本研究收集2015年6月至2016年3月于我院行膀胱电切术后辅助沙培林膀胱灌注治疗的40例膀胱占位患者,检测灌注前后尿液细胞因子TNF-α、INF-γ、IL-2的含量,并统计术后6个月患者的复发率和不良反应发生率。同时,通过动物实验观察灌注沙培林后免疫细胞、细胞因子IL-2、TNF-α、INF-γ的表达是否增多及停药后尿路上皮是否发生慢性炎性改变,探讨沙培林的有效性和安全性。
对象与方法
一、一般资料
40例膀胱占位患者,男29例,女11例,年龄38~79岁,平均年龄58岁;单发病例34例,多发6例;初发病例32例,复发病例8例;肿瘤大小0.5~3.7 cm,平均2.1 cm。膀胱电切术后病检结果:34例为低级别膀胱尿路上皮癌,未见肌层浸润;6例为高级别膀胱尿路上皮癌,未见肌层浸润。SD大鼠(购于湖北省疾病预防控制中心,SPF级大鼠)75只,体重(260±20)g,分笼饲养(华中科技大学实验动物中心,屏障系统动物实验室)。
二、材料
沙培林[国药集团鲁亚(山东)制药有限公司];BCG(必赛吉,中国生物技术股份有限公司);尿液(从患者采集);TNF-α、INF-γ、IL-2 ELISA试剂盒(购于联科生物公司);TNF-α、INF-γ、IL-2免疫组化(一抗、二抗购于谷歌生物公司;DAB购于DAKO公司);DH5α(同济医学院);SD大鼠膀胱HE染色组织;电脑体式显微镜(购于德国Leica)、成像系统。
三、临床观察、动物实验方法
1.临床观察:①膀胱灌注:40例患者术后肉眼血尿消失即予沙培林膀胱灌注(所有患者青霉素皮试均为阴性)。排空膀胱,生理盐水40 ml加沙培林5 KE经导尿管灌入膀胱保留2 h以上,嘱患者在床上每15 min改变一次体位,以便药物浸及膀胱各壁。每周1次,连续6次,之后每个月1次,连续6次。②尿液收集:膀胱灌注沙培林前,用无菌干净器皿收集患者晨尿的中段尿10 ml左右,立即送实验室,3 000 r/min,5 min,离心后取上清1 ml, 4 ℃冰箱保存。膀胱灌注后第二天,以同样的方法收集患者尿液。所有尿液收集后当天即应用TNF-α、INF-γ、IL-2 ELISA试剂盒检测尿液中TNF-α、INF-γ、IL-2含量。③随访:每月电话随访一次,详细记录每次灌药后全身及局部反应情况:有无发热症状、有无尿路刺激症状、有无过敏反应、有无肉眼血尿及其他不良反应。术后6个月返院复查膀胱镜,观察是否发生膀胱炎性改变及肿瘤复发情况。
2.动物实验:取75只雌性大鼠,随机分为5组,每组15只,第1组为空白组,不做任何处理;第2组灌注生理盐水;第3组灌注大肠杆菌培养液;第4组灌注120 mg/50 ml BCG溶液;第5组灌注5 KE/40 ml沙培林溶液。每只大鼠灌注量均为0.3 ml,每周灌注1次,连续灌注6周。6周后停止灌注,从各组随机选取10只大鼠,处死后取其膀胱三角区组织做病理切片并行TNF-α、INF-γ、IL-2免疫组化分析。2个月后处死剩余的25只大鼠,取其膀胱三角区组织做病理切片,观察膀胱组织恢复情况。①大鼠膀胱内灌注方法:按30 mg/kg体重腹腔注射1%的戊巴比妥钠麻醉SD雌性大鼠,固定仰卧大鼠,常规消毒会口阴部。将无菌硬膜外导管用无菌液体石蜡润滑后,提起尿道外口的皮肤, 沿尿道后壁插入尿道3 cm 以上。通过抽吸导管排除大鼠残余尿液,分别用 1 ml 注射器向大鼠膀胱注入0.3 ml灌注液,然后退出导管,将大鼠放入鼠笼等待自然苏醒。②大肠埃希菌溶液的制备:无菌条件下,从-70 ℃冰箱取出DH5α大肠埃希菌菌种,挑起单菌落接种在装有10 ml LB培养液中,37 ℃摇晃过夜后,以2%接种量接入100 ml LB培养液中,置于37 ℃恒温摇床,转速200 r/min。4 h后,用分光光度仪测定大肠埃希菌的浓度,测得OD值为0.6~0.8后,将培养瓶置于冰浴中10 min使细菌停止生长,后4 ℃冰箱保存,保持菌种浓度。③膀胱标本的处理:将各组大鼠用25%乌拉坦溶液按1.0 g/kg剂量麻醉,固定仰卧大鼠,剪开会阴部皮肤,提起大鼠膀胱底部,分离至尿道近端剪断。取出膀胱,观察膀胱的大体形态,迅速将膀胱体部和膀胱三角区固定在10%的甲醛溶液中。标本经10%甲醛溶液固定、脱水、透明、石蜡包埋。5 μm厚连续常规切片, 行苏木精-伊红染色或免疫组化抗体孵育、染色。④判断标准:大鼠膀胱组织免疫细胞浸润及免疫组化分级标准(TNF-α、INF-γ、IL-2任意一个达到以下标准):无明显免疫细胞或阳性颗粒(阴性或面积<5%);明显免疫细胞或阳性颗粒1+(面积<25%);免疫细胞或明显阳性颗粒2+(面积介于25%与75%之间);免疫细胞或明显阳性颗粒3+(面积>75%)。
三、统计学方法
所得数据采用SPSS 22.0统计学软件进行处理,计量资料数据符合近似正态分布,以均数±标准差表示,采用配对t检验,等级资料运用完全随机设计多个样本比较的秩和检验(Kruskal-Wallis 检验)。P<0.05为差异有统计学意义。
结 果
一、临床研究
与灌注前比较,沙培林灌注后40例膀胱肿瘤患者尿液中细胞因子TNF-α、INF-γ、IL-2含量显著升高(表1),随访过程中均未出现明显的全身不良反应,仅有3例诉灌注后出现轻度尿路刺激症状,停止灌注后症状消失。6个月后复查膀胱镜检,镜检报告:膀胱电切术后,未见明显占位性病变,膀胱呈炎性改变。

表1 沙培林灌注前后尿液中TNF-α、INF-γ、IL-2含量比较(均数±标准差)
与灌注前比较*P< 0.01
二、动物实验
连续灌注6周后,免疫细胞浸润情况与细胞因子TNF-α、INF-γ、IL-2免疫组化分析情况相似,表现为大肠杆菌组>沙培林组≈BCG组>生理盐水组>空白对照组(表2、图1)。停止灌注2个月后,大肠杆菌灌注组仍表现为严重的炎性改变,而沙培林、BCG灌注组中免疫细胞的浸润及相关细胞因子的表达明显减少,趋向正常。
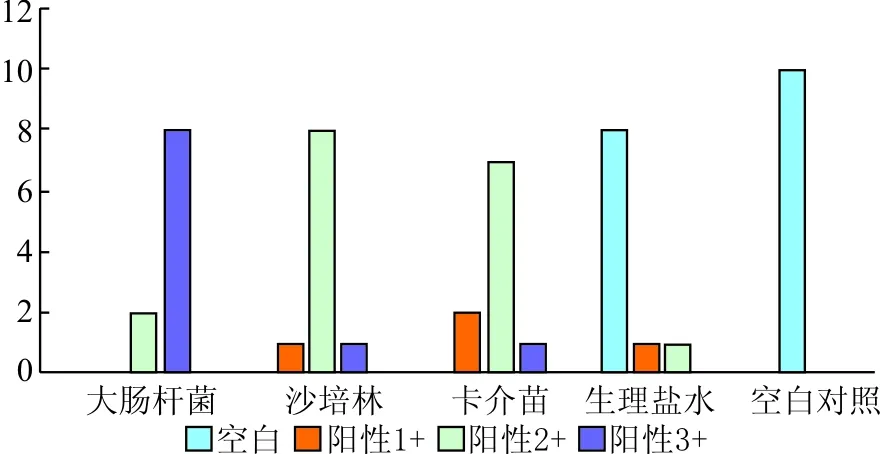
图1 灌注6周后膀胱组织中细胞因子表达情况
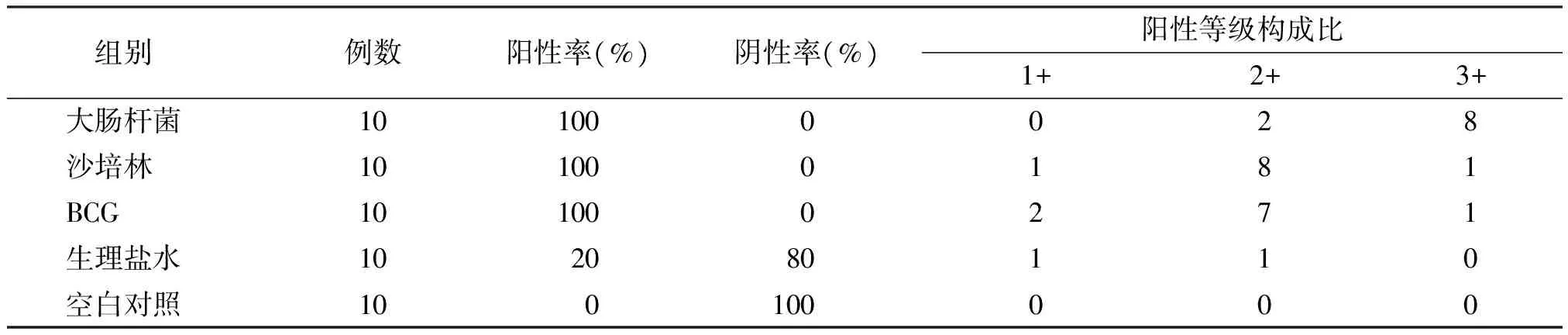
组别例数阳性率(%)阴性率(%)阳性等级构成比1+2+3+大肠杆菌101000028沙培林101000181BCG101000271生理盐水102080110空白对照100100000
卡方=40.843,自由度=4,P<0.01;按α=0.05的检验水准,认为5组的阳性率不全相同
讨 论
膀胱肿瘤术后有一定的复发率,临床上术后常规行膀胱灌注。本研究显示,与灌注前比较,沙培林灌注后患者尿液中IL-2、TNF-α、INF-γ的含量均显著升高,说明沙培林灌注可刺激膀胱产生免疫反应,使免疫细胞聚集并分泌大量的细胞因子,增强膀胱局部免疫功能。与文献报道相符。随访中不良反应发生率低且轻。术后6个月膀胱镜检,此时患者灌注尚未结束,见膀胱内呈炎性改变。动物实验发现,因细胞因子均由免疫细胞合成、分泌,故免疫细胞的浸润与细胞因子的表达情况大致相同。沙培林灌注正常大鼠膀胱,在膀胱组织切片中发现大量免疫细胞聚集,同时行免疫组化分析,发现细胞因子IL-2、TNF-α、INF-γ在膀胱组织中的合成也显著增多,说明灌注沙培林后,膀胱局部免疫系统被激活,主要以细胞免疫为主,而由免疫细胞分泌的细胞因子IL-2、TNF-α、INF-γ能进一步增强和促进免疫细胞的功能,从而发挥更强的抗肿瘤及抗炎作用。停止灌注2个月后,与大肠杆菌组产生慢性膀胱炎不同,沙培林组及卡介苗组大鼠膀胱组织基本恢复正常,说明沙培林膀胱灌注具有安全性和有效性。
目前应用于膀胱灌注的药物主要分为化疗药物和生物免疫制剂,其中化疗药(如羟基喜树碱、丝裂霉素等)存在较高的细胞毒性和刺激性,患者往往难以耐受,灌注后不良反应发生率高,因灌注化疗药物可通过各种途径促进DNA的聚集及阻断复制、转录、翻译等,在杀伤不典型增生细胞的同时也损伤了正常尿路细胞,具有一定的盲目性,浓度高时还有可能造成血管损伤引起化学性膀胱炎[4]。而生物免疫调节剂(如BCG、沙培林OK-432、IL-2)可直接杀伤肿瘤细胞,也可以通过激活机体和/或局部免疫细胞识别和杀伤异型细胞,对正常细胞无损伤,具有一定的选择性;同时分泌的大量细胞因子有增强免疫作用,从而治疗和预防肿瘤[5-6]。从机制上看,生物免疫调节剂明显优于化疗药物。在疗效方面,国外一份关于丝裂霉素和BCG灌注预防膀胱肿瘤复发的研究表明,两者5年生存率差异无统计学意义,但在预防肿瘤复发上,BCG明显优于丝裂霉素[7]。另外一项2 749例患者的meta分析也表明,无论肿瘤复发风险高低,BCG对非浸润性膀胱癌复发的预防作用均优于丝裂霉素[8]。也有一些学者提出将化疗药物与生物免疫制剂联合应用于膀胱灌注,充分利用它们不同的作用机制,从而达到最大疗效和最小的毒副作用,还能消除肿瘤细胞对单一药物的耐药性。国内一项关于沙培林联合羟基喜树碱与单独灌注预防膀胱癌术后复发疗效对比研究表明,联合应用沙培林与羟基喜树碱的疗效优于单独应用,预防复发的疗效更好[9]。
自1976年Morales等[10]报道了应用BCG膀胱灌注治疗浅表性膀胱肿瘤后,免疫调节剂应用于膀胱灌注逐渐为人们所熟知并认可。BCG作为一种有效的生物免疫调节剂在治疗膀胱肿瘤方面取得了良好效果,被认为是目前最为有效的膀胱肿瘤辅助治疗剂之一。但以下因素限制了BCG的临床应用[11-12]:不良反应,包括治疗期间出现膀胱炎,甚至肺部感染、肝肉芽肿等致命的并发症;仍有约20%的患者对其治疗无效;对肌层浸润的肿瘤效果较差;BCG相对短缺,无法普及应用。沙培林的作用机理大致与BCG相似,Nakahara等[13]比较了OK-432与BCG对胃癌患者外周血单核细胞的作用发现,无论是激活NK细胞,还是诱导细胞因子(IL-2、TNF-α、INF等)的分泌方面,OK-432的作用均明显强于BCG。目前已有沙培林应用于膀胱肿瘤的治疗并取得良好疗效的报道。刘波等[14]对50例高危非肌层浸润性膀胱癌行经尿道等离子电切术联合沙培林膀胱灌注,结果亦表明沙培林膀胱灌注有效、安全,但仍缺乏大样本、多中心临床研究及合理的基础实验研究证实。
[1] Sakamoto J, Teramukai S, Nakazato H, et al. Efficacy of adjuvant immunochemotherapy with OK-432 for patients with curatively resected gastric cancer: a meta-analysis of centrally randomized controlled clinical trials[J]. J Immunother,2002,25(5):405-412.
[2] Sato T, Marubashi S, Kenjo A, et al. M1 macrophage infiltrations and histological changes in the liver after portal vein embolization using fibrinogen and OK432 in the rat[J]. Cell Immunol,2016,303:66-71.
[3] Kenjo A, Sato T, Marubashi S, et al. Role of intratumoral infiltrating macrophages after transarterial immunoembolization for hepatocellular carcinoma[J]. J Hepato biliary Pancreat Sci,2016,23(5):298-304.
[4] 曲知专. 沙培林、吡柔比星、丝裂霉素单独膀胱灌注预防表浅膀胱癌术后复发的疗效及副作用比较[D]. 暨南大学,2014.
[5] Tian YF, Tang K, Guan W, et al. OK-432 Suppresses Proliferation and Metastasis by Tumor Associated Macrophages in Bladder Cancer[J]. Asian Pac J Cancer Prev,2015,16(11):4537-4542.
[6] Donin NM, Lenis AT, Holden S, et al. Immunotherapy in the Treatment of Urothelial Carcinoma[J]. J Urol,2017,197(1):14-22.
[7] Malmstrom PU, Wijkstrom H, Lundholm C, et al. 5-year followup of a randomized prospective study comparing mitomycin C and bacillus Calmette-Guerin inpatients with superficial bladder carcinoma. Swedish-Norwegian Bladder Cancer Study Group[J]. J Urol,1999,161(4):1124-1127.
[8] Böhle A, Jocham D, Bock PR. Intravesical bacillus Calmette-Guerin versus mitomycin C for superficial bladder cancer: a formal meta-analysis of comparative studies on recurrence and toxicity.[J]. J Urol,2003,169(1):90-95.
[9] 杨军,肖亚军,鞠文,等. 沙培林联合羟基喜树碱膀胱灌注与单独灌注预防膀胱癌术后复发疗效对比观察[J]. 临床泌尿外科杂志,2009,24(2):127-129.
[10] Morales A, Eidinger D, Bruce AW. Intracavity BCG in the treatment of superficial bladder tumours[J]. J Urol,1976,116(2):180-183.
[11] Van der Meijden AP, Brausi M, Zambon V, et al. Intravesical instillation of epirubicin, bacillus Calmette-Guerin and bacillus Calmette-Guerin plus isoniazid for intermediate and high risk Ta, T1 papillary carcinoma of the bladder: a European Organization for Research and Treatment of Cancer genito-urinary group randomized phase Ⅲ trial[J]. J Urol,2001,166(2):476-481.
[12] Veeratterapillay R, Heer R, Johnson MI, et al. High-Risk Non-Muscle-Invasive Bladder Cancer-Therapy Options During Intravesical BCG Shortage[J]. Curr Urol Rep,2016,17(9):68.
[13] Nakahara S, Tsunoda T, Baba T, et al. Dendritic cells stimulated with a bacterial product, OK-432, efficiently induce cytotoxic T lymphocytes specific to tumor rejection peptide[J]. Cancer Res,2003,63(14):4112-4118.
[14] 刘波,潘铁军,蔡莹,等. 经尿道等离子电切术联合沙培林膀胱灌注治疗高危非肌层浸润性膀胱癌的疗效观察[J]. 现代泌尿生殖肿瘤杂志,2014,6(4):214-216.
(本文编辑:徐汉玲)
Study of intravesical instillation with sapylin on the clinical observation and animal experiment
WANGNing,WEIChao,MusaMale,WANGShen,PENGE-jun,YEZhang-qun,CHENZhi-qiang.
DepartmentofUrology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
PENGE-jun,E-mail:penggejun@126.com
Objective To investigate the efficacy, safety and the mechanism of intravesical instillation of OK-432 (sapylin) by the clinical observation and animal's experiment. Methods ①Clinical research: 40 cases diagnosed with bladder tumor which used OK-432 (sapylin) for intravesical instillation in the postoperative period were collected, and determing the content of cytokine TNF-α, INF-γ and IL-2 in the urine collected before and after infusion respectively, reviewing the cystoscopy 3 months after operation, and counting the adverse effects. ②Animal experiment: divided 75 female rats into five groups: blank control group (15), saline perfusion group (15), sapylin perfusion group (15), BCG vaccine perfusion group (15), E.coli perfusion group (15), perfusion treatment once a week, continuous 6 weeks, then selected 10 rats from each group randomly, killed the rats and took the trigone tissue for pathological salices and immunohistochemical analysis of cytokine TNF-α, INF-γ and IL-2. The rest 25 rats just raised after 2 months without any treatment, after 2 months killed the rest rats and took the trigone tissue for pathological salices. Results ①Clinical research: the content of urine cytokine TNF-α, INF-γ and IL-2, after perfusion of OK-432 (sapylin)rose significantly, after 6 months reviewed the cystoscopy and reported inflammatory changes, no tumor recurrence, and low incidence of adverse reactions. ②Animal experiment: after 6 weeks intravesical instillation with different solutions, infiltration of immune cell in the rat bladder tissue and expression of cytokines TNF-α, INF-γ and IL-2 were similar: E. coli group > sapylin group ≈BCG group > saline group > blank control group; stopped perfusion 2 months was shown as: E. coli group characterized by bladder inflammatory change, almost all the rest of the group was turn to normal transitional epithelium. Conclusions Sapylin's action mechanism is similar with BCG, mainly through activating the bladder epithelial inflammatory reaction enhance the immune function of the lesion site, and than recognize and eliminate the mutant cells, and can recover to normal transitional epithelium after a period of time, therefore sapylin is a kind of safe and effective immune regulator.
Sapylin; Intravesical instillation; Bladder tumor; Cytokines
430030 武汉,华中科技大学附属同济医院泌尿外科
彭鄂军,E-mail:pengejun@126.com
10.3870/j.issn.1674-4624.2016.06.007
2016-09-01)
