193株铜绿假单胞菌临床检出及多重耐药情况分析
2016-03-30孙超
孙超
193株铜绿假单胞菌临床检出及多重耐药情况分析
孙超
【摘要】目的 分析铜绿假单胞菌临床科室检出情况及其多重耐药性,以指导临床合理使用抗生素。方法 收集2012年1月—2015年4月在沈阳医学院附属二院分离得到的193株铜绿假单胞菌,分析其检出情况及多重耐药性。结果 193株铜绿假单胞菌主要分离自痰液,其次是分泌物;主要检出科室为呼吸内科、烧伤科、ICU病房;铜绿假单胞菌对氯霉素、复方新诺明、阿莫西林/克拉维酸敏感性最差,对多黏菌素B、阿米卡星、妥布霉素等抗生素敏感性较高。结论 呼吸内科、烧伤科和ICU铜绿假单胞菌耐药较严重,应给予高度重视。
【关键词】铜绿假单胞菌;多重耐药性;科室;药敏试验
铜绿假单胞菌(PA)在自然界的分布广泛,是一种条件致病菌,也是医院内获得性感染的重要病原菌。近年来,PA的多重耐药日趋严峻,已引起医学界的广泛关注。本研究对PA的临床检出及多重耐药情况进行分析。现报告如下。
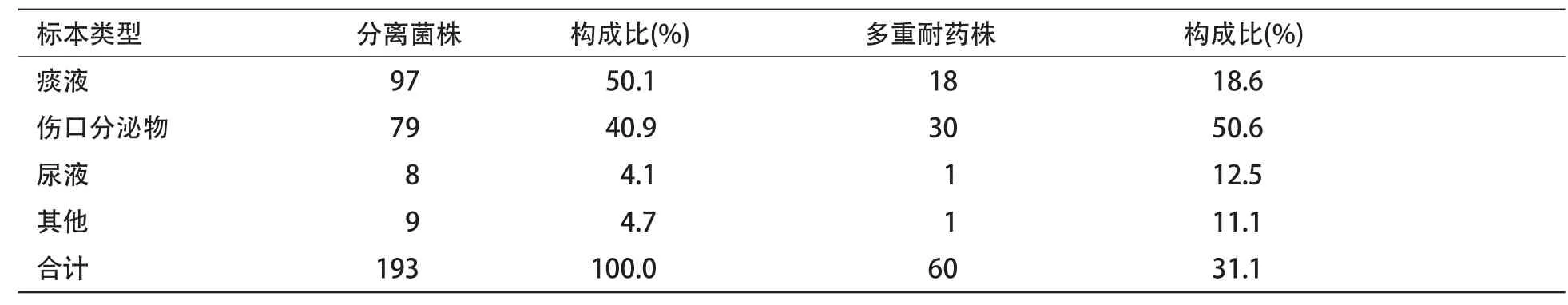
表1 PA标本检出分布及耐药情况
1 材料与方法
1.1 标本收集 收集2012年1月—2015年4月我院微生物实验室分离得到的PA,剔除重复检出菌株,操作按照《临床检验操作规程》执行。
1.2 分离培养 由法国梅里埃公司提供VETIK全自动细菌鉴定分析仪及其配套药敏试剂GN,使用哥伦比亚血琼脂平板、M-H琼脂平板,采用三区划线分离,35℃专性需氧培养。质控菌株ATCC27853购自原卫生部检验中心。
1.3 细菌鉴定 选取可疑菌落,调节菌液浓度0.5麦氏接种于VETIK全自动细菌生化鉴定反应板及药敏反应板,培养24 h进行鉴定。药敏试验按照美国临床实验室标准化协会(CLSI)判断标准执行。
2 结果
2.1 PA检出的标本分布及耐药情况 检出标本分布:痰液中的检出比例最大,占50.1%;其次是伤口分泌物,占40.9%;尿液及其他标本占8.8%;结果显示,我院PA的检出主要是痰和分泌物标本,占>90%。产生≥3种耐药菌株,痰液占18.6%;伤口分泌物多重耐药菌株占50.6%;本实验显示,分离出多重耐药菌株总占比为31.1%。见表1。
2.2 PA检出的科室分布及耐药情况 呼吸科检出最多,占35.2%,出现多重耐药株13株(占13.2%);其次是烧伤科,占30.6%,出现耐药株最多,32株(占54.2%);ICU检出30株,占15.7%,耐药菌株占36.7%;其他科室检出较少耐药菌株,占11.1%。见表2。

表2 PA检出的科室分布及耐药情况
2.3 PA对12种临床常用药物敏感试验结果 PA耐药率较高的几种抗生素为氯霉素90.7%、复方新诺明92.0%、阿莫西林/克拉维酸77.7%;PA对多黏菌素B、阿米卡星、妥布霉素的敏感性较高,耐药率<10%。见表3。

表3 PA对12种临床常用药物敏感试验结果
3 讨论
本研究显示,临床上分离出PA的标本主要来自痰液,占35.2%,这与呼吸科病人(80%的痰液标本来自呼吸科)常进行痰液微生物培养有关[1]。烧伤科分泌物检出PA的耐药率高达54.2%,分析原因:①由于皮肤及呼吸道烧伤导致菌群失调,有利于PA的生长;②烧伤病人均使用大剂量抗生素预防和控制感染,导致抗生素过度使用引起多重耐药发生[2]。ICU病人PA分离占15.7%,耐药性达36.7%,耐药性仅次于烧伤科,位列第2,究其原因主要为ICU病人都患有一些基础性疾病,机体免疫力较低,或长期应用一些激素、抗肿瘤类药物或有侵入性诊疗[3],都会导致PA感染。由于PA广泛存在于环境中,特别是各种原因所致的机体免疫力低下,更容易感染PA,而PA具有多重耐药特性,对多种抗生素耐药。
目前已明确的细菌多重耐药机制有4种:①双组分调节系统[4];②药物外排系统[5];③氯霉素酰基转移酶等酶类能够使氯霉素失去活性[6];④外膜蛋白OprF突变导致PA对头孢噻肟、环丙沙星耐药[7]。本研究PA的感染率、耐药率结果与相关研究相近[8]。
近年来,随着抗生素的广泛使用,多重耐药PA感染已成为医院感染的重要病原菌之一,使治疗更加困难,医院和病人的负担更加严重。通过对细菌耐药性的分析,尽早发现耐药菌株的耐药机制,阻断其传播,是控制感染的重要途径之一。
PA已经对多种抗生素产生了耐药性,如氯霉素的耐药率为90.7%、复方新诺明92.0%、阿莫西林/克拉维酸77.7%[9]。亚胺培南是碳青霉烯类抗生素的代表性药物,其抗菌活性强,在临床上应用广泛,但耐药率正在逐渐上升。本研究显示,PA对多种抗生素的耐药性均较高。因此,应通过药敏试验合理选择敏感药物,为控制感染争取宝贵时间。
参考文献:
[1] 夏静鸿,朱光发,王爱萍,等.铜绿假单胞菌的临床及耐药分析[J].临床肺科杂志,2014,19(6):993-996.
[2] 王秋菊,秦进,袁飞.2 162株铜绿假单胞菌医院感染的临床分布及耐药分析[J].疾病监测,2014,29(6):454-457.
[3] Jones RN. Microbial etiologies of hospital-acquired bacterial pneumonia and ventilator associated bacterial pneumonia[J]. Clin Infect Dis, 2010, 51(Suppl 1): S81-87.
[4] 宁唤唤,李晶,王严,等.铜绿假单胞菌耐药性与致病性共选择机制研究进展[J].中国抗生素杂志,2015,40(5):382-388.
[5] 吕娟,谢芬,张丽,等.我院铜绿假单胞菌对常用药物的耐药性分析[J].中国药师,2013,16(6):898-900.
[6] 潘发愤.铜绿假单胞菌耐药机制研究进展[J].医学综述,2012,22(56):214-218.
[7] 陈旭娜,黄小荣,梁天文,等.铜绿假单胞菌耐药性分析及主要β-内酰胺酶基因检测[J].热带医学杂志,2014,14(3):299-300.
[8] 吕春兰,郝爱军.耐亚胺培南铜绿假单胞菌的感染现状及耐药性分析[J].中国感染与化疗杂志,2012,22(3):606.
[9] 陈越,孙景勇,倪语星,等.2012年中国CHINET铜绿假单胞菌耐药监测[J].中国感染与化疗杂志,2015,15(3):199-204.
特 别 关 注
收稿日期:(2015-08-12)
【文章编号】1672-7185(2016)01-0018-03
doi:10.3969/j.issn.1672-7185.2016.01.009
【中图分类号】R44
【文献标识码】A
基金项目:2015年沈阳医学院青年科技基金项目,沈阳医学院科研课题(20152028)作者单位:110011 沈阳,沈阳医学院附属二院检验科
