临床样品中不同蚀斑表型单克隆轮状病毒VP8基因序列分析
2016-03-29钱雯马波黄永坤陈敏王丽丽张益丽杨晨徐道俊刘馨
钱雯,马波,黄永坤,陈敏,王丽丽,张益丽,杨晨,徐道俊,刘馨
临床样品中不同蚀斑表型单克隆轮状病毒VP8基因序列分析
钱雯,马波,黄永坤,陈敏,王丽丽,张益丽,杨晨,徐道俊,刘馨
作者单位:650106 昆明,云南沃森生物技术股份有限公司(钱雯、马波、陈敏、王丽丽、张益丽、杨晨、徐道俊、刘馨);650032 昆明医学院第一附属医院(黄永坤)
轮状病毒属于呼肠孤病毒属,为没有包膜的双链 RNA病毒,人畜禽共患,其感染每年引起约 50 万婴幼儿死亡[1]。
宿主细胞表面的寡糖分子是一个重要的因子,它们与轮状病毒和细胞的相互识别及吸附有关,同时还影响了病毒的宿主特异性[2]。研究表明,轮状病毒外壳蛋白 VP4 的糖类结合区域位于 VP4 的亚基 VP8,其与细胞表面寡糖分子的相互作用使病毒识别并吸附到细胞表面。轮状病毒对细胞的感染是通过 VP8 与细胞表面多糖,尤其是与内部唾液酸(N-acetyl- and N-glycolylneuraminic acids,Sia)的结合完成的[3]。人株、猴株以及猪轮状病毒 VP8 基因序列在识别细胞表面唾液酸或其衍生物甲基-α 二氮乙酰神经氨酸的位点有显著的差异[1],影响病毒在细胞培养上的敏感性和适应性。
研究发现,分离自猪粪便的轮状病毒在 157 位呈现出Pro 或者 Ser 的多态性;牛轮状病毒株 NCDV 随细胞培养的适应,VP8 基因 157 位由 Pro 突变为 Ser,从而产生了NCDV Cody 和 NCDV Lincoln 两个衍生亚株,这是在VP8 氨基酸 64 ~ 224 区域内发生的唯一的氨基酸突变[4]。分离自人粪便样品轮状病毒的 VP8 基因是否存在上述位点的多态性?
轮状病毒感染细胞后可形成蚀斑,在凝胶的固定下,病毒颗粒不能自由地移动,在一个病毒颗粒进入细胞并产生子代病毒的过程中,细胞死亡并形成蚀斑,一个蚀斑代表了一个单克隆的病毒分子。蚀斑的表型,即蚀斑的大小与病毒感染后产生细胞致病作用(cytopathogenic effect,CPE)的时间和程度有关,蚀斑较大的病毒克隆产生 CPE 的时间较快,也较为剧烈。VP8 基因序列的差异与空斑的大小即蚀斑表型、病毒分子的感染性之间存在怎样的关系?
为了回答上述问题,本文研究了分离自一份临床粪便样品的轮状病毒单克隆的 VP8 基因序列,并分析了序列差异与病毒蚀斑表型之间可能存在的关系。
1 材料与方法
1.1材料
1.1.1临床样品及病毒临床粪便样品来自昆明医学院第一附属医院儿科秋冬季腹泻患儿,经病毒核酸电泳或电镜观察确证为轮状病毒感染。
1.1.2细胞及质粒罗猴肾细胞系 MA104 购自中国典型培养物保藏中心,CCTCC 编号为 GDC041;pGEM-T easy载体为美国 Promega 公司产品。
1.1.3试剂与仪器小量液体样品 RNA 抽提试剂盒、聚丙烯酰胺、硝酸银、中性红购自上海华舜生物技术有限公司;RT-PCR 试剂盒、ExTaq 酶购自大连宝生物工程有限公司;小型垂直电泳槽购自美国 Bio-Rad 公司;MEM 培养基、胎牛血清购自美国 Gibco 公司;胰酶购自美国 BBI 公司;二乙氨乙基葡聚糖(DEAE-dextron)购自美国 GE 公司。
1.2方法
1.2.1临床样品中轮状病毒的分离及 PAGE 鉴定具体方法参见文献[5]。
1.2.2病毒的培养及蚀斑纯化过滤后的病毒上清接种24 孔板 MA104 细胞,扩增 6 ~ 7 代后,做病毒蚀斑实验,并进行 3 轮纯化,具体的方法参见文献[6]。
1.2.3VP8 基因的克隆及测序根据 Genbank 数据库序列,选取人常见 P 血清型 VP8 的保守区域,设计引物如下:克隆引物 5' cttctcactaattcatattc 3'(34 ~ 53 bp),5' tatttc agaccatttataacc 3'(859 ~ 879 bp),测序引物 5' tcccaagaatc taaatgtaa 3'(sense)或 5' ttacatttagattcttggga 3'(antisense)(628 ~ –647 bp),使用抽提的轮状病毒 RNA 为模板,做RT-PCR,将 PCR 产物克隆至 pGEM-T easy 载体后测序,测序由上海生工生物工程有限公司完成。
2 结果
2.1临床样品中轮状病毒的基因型
对 30 份临床粪便样品编号 1 ~ 30,并进行轮状病毒的分离,选取分离结果较好的 5 份样品分别为 1、4、5、6、7 号进行培养。轮状病毒基因组为分 11 节段的双链 RNA,不同血清型的轮状病毒 RNA 基因组在 PAGE 电泳时呈现不同的电泳特征(图1),A 群轮状病毒的 4 个区段中,各带的排列位置为 4:2:3:2,根据前 4 条 RNA 的排列特征又可以进一步区分同属 A 群但不同血清型的病毒株,Wa株(血清型为 P[8]G1)的前 4 条排列为 1-2-1,因此,初步判定 5 号、7 号样品为 P[8]G1 型。
2.2分离轮状病毒培养后的滴度及蚀斑表型
按前述方法在 MA104 细胞上进行连续扩增,临床样品 5 号病毒滴度最高,可达 106TCID50/ml,其 RNA 电泳条带与 Wa 株一致,血清型对应为 P[8]G1,以 10-5稀释度做蚀斑实验,出现了两种表型,一种是较大的,直径大于5 mm,一种是较小的,直径小于 3 mm。选取不同蚀斑表型的轮状病毒克隆进行 3 轮纯化,结果发现,蚀斑表型即蚀斑的大小与母代病毒保持一致(图2)。

图1 临床粪便样品中的轮状病毒 RNA 电泳带型
2.3不同蚀斑表型病毒克隆 VP8 基因测序结果分析
VP8 的 64 ~ 224 位氨基酸是与唾液酸结合的区域[7],而两个主要的位点 157、187 是主要的糖链结合点[2]。对大小蚀斑的 VP8 编码区(869 bp)进行扩增和测序,结果显示,两者 VP8 序列的主要差异集中在 aa 64 ~ 224 区域,
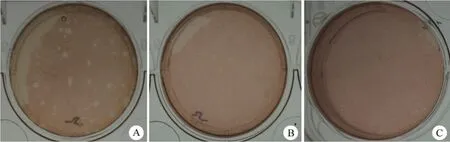
图2 临床样品 5 号分离轮状病毒经 3 轮蚀斑纯化后的表型(A:直径大于 5 mm 的大蚀斑表型;B:直径小于 3 mm 的小蚀斑表型;C:阴性对照)
主要差异见表1。在识别多糖受体的关键位点 157 位,直径较大的蚀斑为 Pro,而直径较小的为 Ser;187 位均为Ser,但 189 位发生了 Ser 到 Asn 的变化。VP8 基因的同源性比对发现,该株病毒 VP8 基因与人 Wa株(血清型为P[8]G1)最为相近,相似度为 95%。

表1 临床样品 5 号大小蚀斑 VP8 氨基酸差异
3 讨论
感染人的轮状病毒主要是 A 群,血清组合常见的有P[8]G1、P[4]G2、P[6]G3 等,且病毒 RNA 电泳的核酸带型有显著的差异排布。VP4 血清型即 P 血清型特异的区域位于 VP4 的亚基 VP8,VP4 氨基酸同源性达 89% 或者更高的可判定属于同一个 VP4 血清型[7-8]。
不同血清型的轮状病毒感染细胞后,一般可以形成裂解性感染,产生典型的 CPE,但病毒的滴度和产生 CPE 的强度因病毒的来源和血清型不同有较大差异。这与病毒是否可以有效地结合于细胞表面并进入细胞内部完成复制有关,即病毒对细胞表面受体的识别和进入细胞的进程影响了病毒的繁殖周期和滴度水平。
轮状病毒入侵人体并导致感染的病毒粒子和宿主细胞之间确切的相互作用特异性机制尚未阐明[1]。最近的研究显示,轮状病毒的外壳蛋白 VP4 经胰蛋白酶裂解后的产物VP8 对于病毒感染来说是必需的,VP8 介导了病毒与细胞膜的融合[2, 9-10]。
本研究中,发现分离自临床粪便样品的轮状病毒 5 号,在蚀斑纯化时呈现出两种不同的表型,即大蚀斑和小蚀斑,通过对其 VP8 基因序列的分析发现,直径较大的蚀斑在157 位氨基酸为 Pro,而直径较小的蚀斑在 157 位氨基酸为 Ser,Pro 到 Ser 的突变减弱了轮状病毒与受体的亲和力[11],从而导致病毒的感染性下降,蚀斑表型变小。但这个序列的代表性还需要进一步分析其他临床样本,选取多个蚀斑纯化病毒进行比较确证。
本文的研究同时提示,作为存在基因重排和变异较高的RNA 双链病毒,轮状病毒疫苗株的筛选,需要对来自临床样品的母代病毒进行多轮的蚀斑纯化,得到基因遗传稳定,纯净的单克隆病毒。
参考文献
[1] Blanchard H, Yu X, Coulson BS, et al. Insight into host cell carbohydrate-recognition by human and porcine rotavirus from crystal structures of the virion spike associated carbohydrate-binding domain (VP8*). J Mol Biol, 2007, 367(4):1215-1226.
[2] Stehle T, Khan ZM. Rules and exceptions: sialic acid variants and their role in determining viral tropism. J Virol, 2014, 88(14):7696-7699.
[3] Fleming FE, Böhm R, Dang VT, et al. Relative roles of GM1 ganglioside, N-acylneuraminic acids, and alpha2beta1 integrin inmediating rotavirus infection. J Virol, 2014, 88(8):4558-4571.
[4] Nishikawa K, Taniguchi K, Torres A, et al. Comparative analysis of the VP3 gene of divergent strains of the rotaviruses simian SA11 and bovine Nebraska calf diarrhea virus. J Virol, 1988, 62(11):4022-4026. [5] Yang ZQ, Huang YK, Liu X. Using optimized PAGE-silver staining technique detecting rotavirus RNA in clinical fecal samples. Chin Med Biotechnol, 2010, 5(4):308-309. (in Chinese)
杨昭庆, 黄永坤, 刘馨. 使用优化PAGE电泳及银染技术检测临床粪便样品中的轮状病毒RNA. 中国医药生物技术, 2010, 5(4):308-309.
[6] Liu X. Effect of pancreatic concentration on rotavirus plaque formation. Chin Med Biotechnol, 2008, 3(2):146-147. (in Chinese)
刘馨. 胰酶浓度对轮状病毒蚀斑形成的影响. 中国医药生物技术, 2008, 3(2):146-147.
[7] Rubio RM, Mora SI, Romero P, et al. Rotavirus prevents the expression of host responses by blocking the nucleocytoplasmic transport of polyadenylated mRNAs. J Virol, 2013, 87(11):6336-6345. [8] Gorziglia M, Larralde G, Kapikian AZ, et al. Antigenic relationships among human rotaviruses as determined by outer capsid protein VP4. Proc Natl Acad Sci U S A, 1990, 87(18):7155-7159.
[9] Estes MK, Cohen J. Rotavirus gene structure and function. Microbiol Rev, 1989, 53(4):410-449.
[10] Hu L, Crawford SE, Czako R, et al. Cell attachment protein VP8* of a human rotavirus specifically interacts with A-type histo-blood group antigen. Nature, 2012, 485(7397):256-259.
[11] Yu X, Dang VT, Fleming FE, et al. Structural basis of rotavirus strain preference toward N-acetyl- or N-glycolylneuraminic acid-containing receptors. J Virol, 2012, 86(24):13456-13466.
·读者·作者·编者·
收稿日期:2015-11-10
通信作者:刘馨,Email:fluidstar@126.com
DOI:10.3969/j.issn.1673-713X.2016.01.015
