野黄芩苷体外促成骨分化作用研究
2016-03-29赵晓丽陈金晶司书毅陈琳峰王真
赵晓丽,陈金晶,司书毅,陈琳峰,王真
野黄芩苷体外促成骨分化作用研究
赵晓丽*,陈金晶*,司书毅,陈琳峰,王真
【摘要】
目的研究野黄芩苷的体外促成骨分化作用。
方法利用荧光素酶报告基因系统检测野黄芩苷对稳定转染 bmp2 启动子的 MC3T3-bmp2-Luc 细胞中 bmp2 转录活性的影响;体外培养小鼠颅骨来源的前体成骨细胞系MC3T3-E1 和小鼠多能间充质干细胞样成纤维细胞C3H10T1/2,采用 MTT 的方法检测野黄芩苷对细胞增殖的影响;p-NPP 法检测野黄芩苷对成骨细胞内碱性磷酸酶活性的影响以及通过茜素红染色的方法考察野黄芩苷对钙化结节形成的影响;Real-time PCR 进一步验证野黄芩苷长时间诱导后对成骨细胞 bmp2 mRNA 水平的影响。
结果野黄芩苷可以在 20 μmol/L 显著上调 bmp2 转录活性(P < 0.001);在 1 ~ 20 μmol/L 的剂量浓度范围内,野黄芩苷作用 72 h 后对 MC3T3-E1 细胞增殖不明显但也无杀伤作用。野黄芩苷在两种实验用细胞中均能剂量依赖地上调 ALP 的活性,其中 10 μmol/L 和 20 μmol/L 最为显著(P < 0.05),并且在 C3H10T1/2 细胞中该作用呈时间依赖性。同时也观察到 24 d 诱导后,野黄芩苷(5 ~ 10 μmol/L)可以增加成骨细胞钙化结节的数目,且诱导 12 d 后,在5 ~ 20 μmol/L 浓度下上调 bmp2 mRNA 的水平。
结论野黄芩苷具有体外促成骨分化的活性,有潜力成为抗骨质疏松候选化合物。
【关键词】骨形态发生蛋白质 2;碱性磷酸酶;成骨分化;野黄芩苷
www.cmbp.net.cn中国医药生物技术, 2016, 11(1):27-31
作者单位:100050 北京,中国医学科学院北京协和医学院医药生物技术研究所(赵晓丽、司书毅、王真);IL 61801,美国伊利诺伊大学香槟分校生化系(陈金晶、陈琳峰)
*同为第一作者
成骨细胞的增殖和分化受多种因素调节,其中骨形态形成蛋白家族尤其是骨形态发生蛋白 2 (BMP2)在成骨细胞分化过程中起着关键作用[1-2],其作为骨形成诱导因子可能成为骨质疏松治疗的新靶点。Mundy 等[3]从以 BMP2 为靶点构建的筛选模型中发现他汀类药物是有效的 BMP2 上调剂,能刺激体内的骨形成。此外,一些天然化合物,包括蛇床子素、橙皮素和大豆苷等也都能通过BMP 通路发挥对骨代谢的保护性作用[4-6],本研究所重点室在前期工作中,成功构建了以 bmp2 启动子为靶点、含有萤火虫荧光素酶报告基因的稳定转染细胞模型,可供抗骨质疏松候选化合物的筛选[7]。实验中发现野黄芩苷(scutellarin,Scu)(结构式见图1)可以上调模型中 bmp2 转录活性,提示它可能具有促进成骨分化的活性。野黄芩苷与黄芩苷的结构有相似性。黄芩苷诱导原代成骨细胞分化[8]的研究已有报道,但野黄芩苷在这一领域的研究尚属空白。所以在后期实验中,采用小鼠颅骨来源的前体成骨细胞系 MC3T3-E1 和小鼠多能间充质干细胞样成纤维细胞 C3H10T1/2,进一步研究了野黄芩苷在细胞水平诱导成骨分化的效应。

图1 野黄芩苷结构式Figure 1 The structure of scutellarin
1 材料与方法
1.1材料
稳定转染 bmp2 启动子的 MC3T3-bmp2-Luc细胞由司书毅教授课题组提供;Luciferase assay system 荧光素酶检测试剂盒购自美国 Promega 公司。野黄芩苷购自南京泽朗医药科技有限公司;β-甘油磷酸、L-抗坏血酸、地塞米松、p-NPP (P4744)、二乙醇胺(D8885)、茜素红均购自Sigma-Aldrich 中国公司;四甲基噻唑蓝(MTT)粉末购自美国 Amresco 公司,溶于水配成 5 mg/ml的储备液;Trizol(15596-018)购自美国 Life Technologies 公司;BCA 蛋白浓度检测试剂盒购自美国 Thermo Scientific 公司;Fast start universalSYBR green master mix 购自瑞士 Roche 公司;5 × PimeScript RT master mix 购自日本 Takara 公司;引物由北京赛百盛基因技术有限公司合成。
1.2方法
1.2.1细胞培养及成骨分化的诱导C3H10T1/2 用 MEM 培养基,MC3T3-E1 用 α-MEM 培养基。各种培养基均加入 10%(v/v)胎牛血清、100 U/ml青霉素和 100 μg/ml 链霉素以制成完全培养液。细胞在含有 5% CO2的 37 ℃ 恒温箱中孵育培养。MC3T3-E1 细胞的成骨诱导液配方:完全培养液,25 μg/ml L-抗坏血酸、5 mmol/L β-甘油磷酸。C3H10T1/2 细胞的成骨诱导液配方:完全培养液,25 μg/ml L-抗坏血酸、5 mmol/L β-甘油磷酸,10 nmol/L 地塞米松。
1.2.2利用 bmp2 表达上调剂模型评价化合物活性消化对数生长期的模型细胞 MC3T3-bmp2-Luc,按每孔 5 × 104个接种至白壁透明底 96 孔板中。待细胞充分贴壁后,加入终浓度为 20 μmol/L野黄芩苷,以与待测样品相同浓度的 DMSO 为空白对照。作用 48 h后移去培养基,使用荧光酶标仪测定荧光素酶活性。按如下公式计算待测样品对荧光素酶活性的相对上调率:
相对上调率(%)=(S/B)× 100%(S:待测样品组细胞荧光素酶活性;B:空白对照组细胞荧光素酶活性)。
1.2.3MTT 测定细胞活力96 孔板每孔接种细胞悬液 100 μl,3000 个细胞,以完全培养液为空白对照。细胞接种后,培养 24 h。稀释野黄芩苷(1 ~ 20 μmol/L),配制浓度应设为工作浓度的2 倍,每孔加 100 μl 配制的药液连续培养 72 h后,每孔加入 20 μl 的 MTT 溶液(5 mg/ml),继续培养 4 h。用低速的真空泵吸出,每孔加 150 μl 的 DMSO,室温振荡 10 min 后,在 570 nm 处测定 OD 值。计算时需要减去空白对照。
1.2.4碱性磷酸酶活性检测细胞接种于 6 孔板,3 × 105/孔,待细胞生长汇合后,换为成骨诱导液,并且加入不同浓度野黄芩苷,每隔 3 天换液,在指定日收集样品。收样时,细胞用冰冷的 PBS 清洗 2 遍,再用 1 ml 超纯水清洗,吸净液体,每孔加入 1 ml 超纯水,用细胞刮刀刮下细胞,转移至预冷的 2 ml EP 管内。冰上超声 30 s,共 2 次。所得细胞裂解液于 4 ℃,12 000 r/min 离心 15 min;转移上清液至新的预冷 EP 管内。取 100 μl 蛋白上清液,加 100 μl 新鲜配制的 p-NPP 溶液(1.0 mg/ml
p-NPP,1 mol/L 二乙醇胺缓冲液,0.5 mmol/L MgCl2);另外取 100 μl 蛋白上清液,加 100 μl BCA 反应液(方法按照试剂盒说明书),于 37 ℃孵育 30 min,碱性磷酸酶(ALP)测定孔加 50 μl浓度为 3 mol/L 的 NaOH 终止反应,于 405 nm 处测定 ALP 反应产物对硝基苯酚的光密度,570 nm处测定蛋白与 BCA 液反应后的光密度。相对碱性磷酸酶活性(%)= 加药组(OD405/OD570)/对照组(OD405/OD570)× 100%。
1.2.5钙化结节形成检测细胞接种于 6 孔板,2 × 105/孔以不同浓度野黄芩苷(5、10 μmol/L)处理 C3H10T1/2 细胞,培养 24 d 后,茜素红染色检测钙化结节形成。用扫描仪扫描图像。
1.2.6Real-time PCR 考察野黄芩苷对细胞 bmp2 mRNA 水平的影响以不同浓度野黄芩苷(5、10、20 μmol/L)成骨诱导 MC3T3-E1 细胞 12 d,Trizol法提取细胞总 RNA。使用 5 × PimeScript RT master mix逆转录 PCR 获得 cDNA。Fast start universal SYBR green master mix 法荧光实时定量,采用 2-ΔΔCT方法进行数据分析。引物设计如表1。
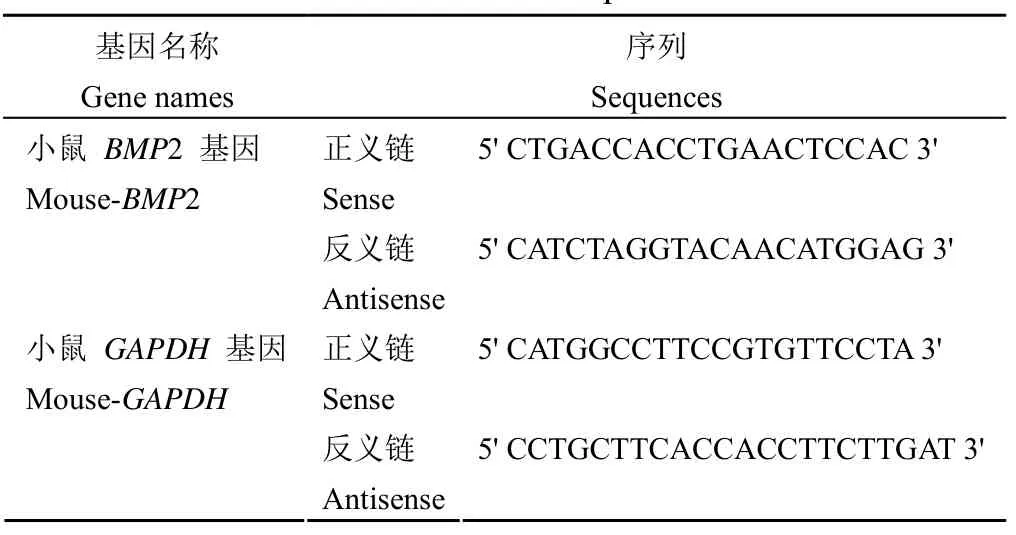
表1 引物序列Table 1 Primer sequences
1.3统计学处理
每次实验至少重复 2 次,数据采用x±s表示,采用 Student's t 检验进行统计学处理。
2 结果
2.1野黄芩苷对模型细胞中 bmp2 的上调作用
应用稳定转染 bmp2 启动子的 MC3T3-bmp2-Luc 细胞发现野黄芩苷能有效上调 bmp2 的转录活性,其中 20 μmol/L 野黄芩苷能使 bmp2 转录活性上调 29.2%(图2),提示它可能具有潜在促成骨分化作用。

图2 野黄芩苷上调模型细胞 MC3T3-bmp2-Luc 中 bmp2转录活性(***P < 0.001)Figure 2 The effect of scutellarin on the transcription of bmp2 promoter in MC3T3-bmp2-Luc (***P < 0.001)

图3 野黄芩苷对细胞增殖的影响Figure 3 Effect of scutellarin on the proliferation of MC3T3-E1 cells
2.2野黄芩苷对细胞增殖的影响
在 1 ~ 20 μmol/L 的剂量浓度范围内,作用72 h,野黄芩苷并不影响 MC3T3-E1 细胞增殖,也不会引起细胞死亡(图3)。
2.3对成骨细胞的促分化作用
碱性磷酸酶活性增强及细胞外基质钙化是成骨细胞分化的两个重要标志。ALP 活性检测结果显示,在 MC3T3-E1 细胞中,野黄芩苷能以剂量依赖的方式上调 ALP 的活性,经 18 d 的诱导后,10 和 20 μmol/L 剂量下的野黄芩苷具有显著性作用(P < 0.01,P < 0.05),20 μmol/L 的野黄芩苷引起最高上调率达 33.4%;在 C3H10T1/2 细胞中,野黄芩苷同样能以时间依赖和剂量依赖的方式增强 ALP的活性,其中经 18 d 的诱导后,10 和 20 μmol/L剂量下的野黄芩苷具有显著性作用(P < 0.05),20 μmol/L 野黄芩苷处理组 ALP 上调达 34.6%(图4)。

图4 野黄芩苷上调 MC3T3-E1(A)和 C3H10T1/2(B)细胞中的碱性磷酸酶活性(*P < 0.05,**P < 0.01)Figure 4 Scutellarin up-regulates the ALP activity in the MC3T3-E1 (A) cells and C3H10T1/2 (B) cells (*P < 0.05,**P < 0.01)

图5 野黄芩苷增加钙化结节的形成Figure 5 Scutellarin promotes the formation of calcified nodules in the C3H10T1/2 cells
钙化结节形成检测结果(图5)显示,在成骨诱导 C3H10T1/2 细胞 24 d 后,野黄芩苷能在 5 ~ 10 μmol/L 浓度下增加钙化结节的形成。
2.4对 bmp2 mRNA 表达的影响
野黄芩苷除了能在早期诱导 bmp2 转录上调外,长时间诱导过程中仍能保持上调 bmp2 转录的状态,表现为野黄芩苷(5、10、20 μmol/L)处理MC3T3-E1 细胞 12 d 后,bmp2 mRNA 表达增加了 2.3 ~ 2.6 倍(图6)。
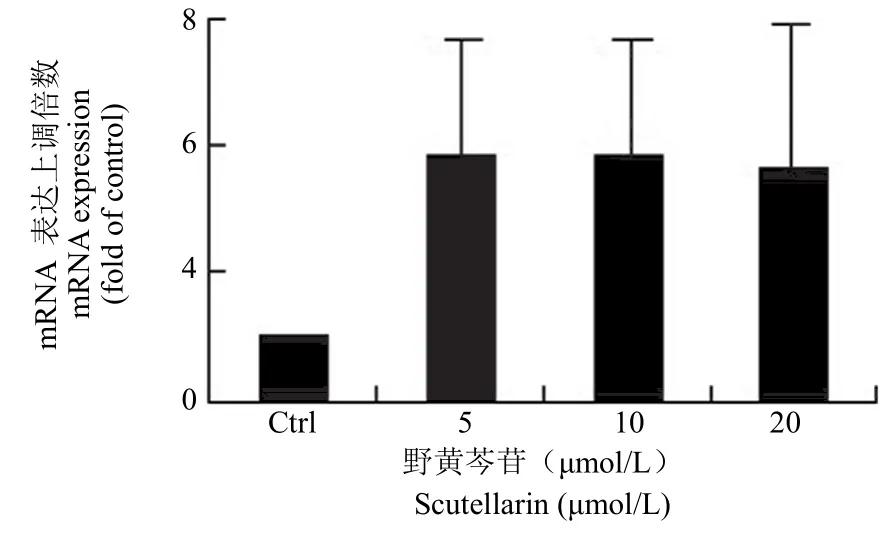
图6 野黄芩苷上调 MC3T3-E1 细胞中 bmp2 mRNA水平Figure 6 Scutellarin up-regulates the expression of bmp2 mRNA in the MC3T3-E1 cells
3 讨论
骨质疏松是一个世界范围的健康问题,筛选安全有效的抗骨质疏松药物具有重要意义。由于天然化合物的结构新颖,功能多效,不良反应少,已成为新药研究的主要源泉之一。
黄酮类化合物是一类在各种蔬果和草药中常见的天然化合物,作为生物活性分子,可改善绝经后妇女因雌激素不足而产生的各种不利影响,被誉为“植物雌激素”。野黄芩苷属于黄酮类化合物,其诱导成骨分化的效应在本研究中首次被发现。事实上,黄酮类化合物调节骨代谢的能力已被广泛报道,其中包括淫羊藿苷、芸香苷、柚苷和染料木素等[9-12]。
野黄芩苷是黄酮类化合物,为灯盏花素的主要活性成分。本研究发现,野黄芩苷在两种体外实验用细胞中均能剂量依赖地上调 ALP 的活性,其中10、20 μmol/L 最为显著(P < 0.05),并且在C3H10T1/2 细胞中作用呈时间依赖性。同时也观察到 24 d 诱导后,野黄芩苷(5 ~ 10 μmol/L)可以增加成骨细胞钙化结节的数目,表现出诱导成骨分化的活性。目前,野黄芩苷主要用于治疗脑血管疾病。研究发现,野黄芩苷还具有抗凋亡,抗氧化,抗炎等作用[13-15]。野黄芩苷除了具有广泛的药理学活性以外,其另一特性是毒性低或者几乎没有毒性。在急性毒性研究中发现,小鼠对野黄芩苷的最大耐受剂量超过 10 g/kg;在亚急性毒性研究中,给大鼠每日口服 100 mg/kg 和 500 mg/kg 剂量的野黄芩苷,连续给药 30 d 并不引起死亡或显著的血液或尿液指标的变化[16]。因此,野黄芩苷如能成为药物,其应用于治疗时安全范围比较广。
本研究中发现野黄芩苷可以上调 BMP2 转录活性和 mRNA 表达水平,野黄芩苷可能通过激活BMP 通路进而诱导成骨分化,对其机制研究提供一定的思路。同时,由于黄酮类抗骨质疏松的活性研究已取得一定的成果,以后对野黄芩苷抗骨质疏松的深入研究也可以参考黄酮类化合物的研究,相应地,对野黄芩苷的研究可以丰富黄酮类化合物的理论研究,甚至可能发现新的作用机制。
参考文献
[1] Aybar B, Emes Y, Atalay B, et al. Effects of bone morphogenetic protein on neonatal rat calvarial osteoblast-like cells: an in vitro study. J Biomed Mater Res A, 2008, 86(2):560-568.
[2] Miron RJ, Saulacic N, Buser D, et al. Osteoblast proliferation and differentiation on a barrier membrane in combination with BMP2 and TGFβ1. Clin Oral Investig, 2013, 17(3):981-988.
[3] Mundy G, Garrett R, Harris S, et al. Stimulation of bone formation in vitro and in rodents by statins. Science, 1999, 286(5446):1946-1949.
[4] Tang DZ, Hou W, Zhou Q, et al. Osthole stimulates osteoblast differentiation and bone formation by activation of beta-catenin-BMP signaling. J Bone Miner Res, 2010, 25(6):1234-1245.
[5] Trzeciakiewicz A, Habauzit V, Mercier S, et al. Hesperetin stimulates differentiation of primary rat osteoblasts involving the BMP signalling pathway. J Nutr Biochem, 2010, 21(5):424-431.
[6] Kim MB, Song Y, Hwang JK. Kirenol stimulates osteoblast differentiation through activation of the BMP and Wnt/β-catenin signaling pathways in MC3T3-E1 cells. Fitoterapia, 2014, 98:59-65.
[7] Li X, Yang J, He X, et al. Identification of upregulators of BMP2 expression via high-throughput screening of a synthetic and natural compound library. J Biomol Screen, 2009, 14(10):1251-1256.
[8] Guo AJ, Choi RC, Cheung AW, et al. Baicalin, a flavone, induces the differentiation of cultured osteoblasts: an action via the Wnt/beta-catenin signaling pathway. J Biol Chem, 2011, 286(32): 27882-27893.
[9] King TJ, Shandala T, Lee AM, et al. Potential effects of phytoestrogen genistein in modulating acute methotrexate chemotherapy-induced osteoclastogenesis and bone damage in rats. Int J Mol Sci, 2015, 16(8):18293-18311.
[10] Wu JB, Fong YC, Tsai HY, et al. Naringin-induced bone morphogenetic protein-2 expression via PI3K, Akt, c-Fos/c-Jun andAP-1 pathway in osteoblasts. Eur J Pharmacol, 2008, 588(2-3):333-341.
[11] Hyun H, Park H, Jeong J, et al. Effects of watercress containing rutin and rutin alone on the proliferation and osteogenic differentiation of human osteoblast-like MG-63 cells. Korean J Physiol Pharmacol, 2014, 18(4):347-352.
[12] Qin S, Zhou W, Liu S, et al. Icariin stimulates the proliferation of rat bone mesenchymal stem cells via ERK and p38 MAPK signaling. Int J Clin Exp Med, 2015, 8(5):7125-7133.
[13] Feng Y, Zhang S, Tu J, et al. Novel function of scutellarin in inhibiting cell proliferation and inducing cell apoptosis of human Burkitt lymphoma Namalwa cells. Leuk Lymphoma, 2012, 53(12):2456-2464. [14] Guo LL, Guan ZZ, Huang Y, et al. The neurotoxicity of β-amyloid peptide toward rat brain is associated with enhanced oxidative stress, inflammation and apoptosis, all of which can be attenuated by scutellarin. Exp Toxicol Pathol, 2013, 65(5):579-584.
[15] Guo H, Hu LM, Wang SX, et al. Neuroprotective effects of scutellarin against hypoxic-ischemic-induced cerebral injury via augmentation of antioxidant defense capacity. Chin J Physiol, 2011, 54(6):399-405.
ObjectiveTo study the effects of scutellarin on osteoblast differentiation in vitro.
MethodsCell model MC3T3-bmp2-Luc stably transfected with mouse bmp2 promoter-luciferase reporter vector was chosen to test the expression of the mouse bmp2 by scutellarin treatment. Then MC3T3-E1 cells and C3H10T1/2 cells were cultured in vitro to evaluate the effects of scutellarin on osteoblast differentiation. The osteogenic differentiation capacity was evaluated by 3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide (MTT) assay, alkaline phosphatase (ALP) assay (p-NPP methods), alizarin red staining and real-time PCR.
ResultsScutellarin was effective in up-regulating the transcription activity of bmp2 in the dose of 20 μmol/L (P < 0.001). The MTT assay showed that it neither promoted the proliferation nor induced cell death in the dose ranging between 1 - 20 μmol/L in MC3T3-E1 cells. Scutellarin could increase ALP activity in both MC3T3-E1 and C3H10T1/2 cell lines, especially in the dose of 10 and 20 μmol/L (P < 0.05). In the dose ranging between 5 - 10 μmol/L, the mineralization of C3H10T1/2 cells was enhanced by treatment with scutellarin. The mRNA synthesis of bmp2 was also promoted by scutellarin treatment for 12 days.
ConclusionScutellarin shows the effects on osteoblast differentiation, deserving further investigation as a potential anabolic agent. 【Key words】 Bone morphogenetic protein 2;Alkaline phosphatase;Osteogenic differentiation;Scutellarin
Author Affiliations: Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (ZHAO Xiao-li, SI Shu-yi, WANG Zhen); University of Illinois at Urbana-Champaign, Department of Biochemistry, IL 61801, U S A (CHEN Jin-jing, CHEN Lin-feng)
www.cmbp.net.cn
Chin Med Biotechnol, 2016, 11(1):27-31
·论著·
[16] Li X, Wang L, Li Y, et al. Acute and subacute toxicological evaluation of scutellarin in rodents. Regul Toxicol Pharmacol, 2011, 60(1):106-111.
Effects of scutellarin on osteoblast differentiation
ZHAO Xiao-li, CHEN Jin-jing, SI Shu-yi, CHEN Lin-feng, WANG Zhen
【Abstract】
Corresponding Author:WANG Zhen, Email: wangzhen@imb.pumc.edu.cn
收稿日期:2015-12-08
通信作者:王真,Email:wangzhen@imb.pumc.edu
基金项目:国家自然科学基金海外及港澳学者合作研究基金(81328024)
DOI:10.3969/j.issn.1673-713X.2016.01.006
