固相微萃取/气相色谱-质谱联用法测定橡胶密封材料中N-亚硝胺
2016-03-25蔡锦安刘志健袁嘉伟潘永红叶元坚
蔡锦安,刘志健,袁嘉伟,潘永红,叶元坚
(广州质量监督检测研究院,广东 广州 511447)
固相微萃取/气相色谱-质谱联用法测定橡胶密封材料中N-亚硝胺
蔡锦安,刘志健,袁嘉伟,潘永红,叶元坚*
(广州质量监督检测研究院,广东广州511447)
摘要:建立了固相微萃取/气相色谱-质谱联用法(SPME/GC-MS)测定橡胶密封材料中N-亚硝基-N-甲基苯胺(NMPhA)、N-亚硝基-N-乙基苯胺(NEPhA)和N-亚硝基二苯基胺(NDPheA)3种N-亚硝胺化合物含量的方法。样品参考国标GB/T 24153-2009进行预处理后,采用固相微萃取进行提取,对影响固相微萃取效率的纤维涂覆种类、萃取时间、搅拌速度和萃取温度等条件进行优化。在优化条件下,方法的线性范围为5~500 μg/L,相关系数(r)均大于0.99,检出限为0.5 μg/kg,回收率为77%~92%,相对标准偏差(RSD,n=6)为3.8%~7.7%。
关键词:橡胶密封材料;固相微萃取;气相色谱-质谱法;N-亚硝胺
橡胶密封材料作为机械基础件,广泛用于生活饮用水管道系统,起密封连接等作用。然而,大部分橡胶材料在生产加工过程均添加有硫化剂和硫化促进剂,以便进行高温硫化成型,使橡胶硫化的同时具有良好弹性。这些硫化促进剂大多数含有仲胺结构,在硫化过程中易产生N-亚硝胺类物质[1]。近年来,多种橡胶制品中均有N-亚硝胺检出[2-6]。
橡胶密封材料中N-亚硝胺的含量较低,然而现阶段测定N-亚硝胺的主要依据标准GB/T 24153-2009[7]的测定下限仅为0.5 mg/kg,且测试前需对预处理样品提取液进行净化,操作繁琐,灵敏度低,无法满足日益严格的检测需要。目前,产品中低浓度N-亚硝胺的检测方法主要有气相色谱-正化学源质谱法(GC-PCI/MS)[8]、气相色谱-串联质谱法(GC-MS/MS)[9]、气相色谱-化学电离源串联质谱法(GC-CI-MS/MS)[10]和液相色谱-串联质谱法(LC-MS/MS)[11]等。但这类方法需要昂贵的仪器,因此橡胶密封材料中痕量N-亚硝胺的检测较难普及。
固相微萃取技术(Solid-phase microextraction,SPME)是一种集采样、萃取、浓缩、进样于一体的样品前处理与富集技术,已在多个领域得到广泛应用[12-16]。本文利用SPME技术进行提取,对影响萃取效率的条件(纤维涂覆种类、萃取时间、搅拌速度和萃取温度等)进行优化,建立了SPME/GC-MS测定饮用水管道系统用橡胶密封材料中3种N-亚硝胺化合物的方法。与国标方法相比,该方法简化了前处理步骤,操作简单,灵敏度高,能在不同实验室开展使用。
1实验部分
1.1仪器与试剂
Agilent 7890B-5977A气质联用仪(GC-MS),配EI源检测器(美国安捷伦公司)。固相微萃取装置及萃取头:100 μm PDMS(聚二甲基硅氧烷);75 μm CAR/PDMS(碳分子筛/聚二甲基硅氧烷);65 μm DVB/PDMS(二乙烯基苯/聚二甲基硅氧烷);85 μm PA(聚丙烯酸酯)(美国Supelco公司)。
N-亚硝基-N-甲基苯胺(NMPhA)、N-亚硝基-N-乙基苯胺(NEPhA)、N-亚硝基二苯基胺(NDPheA)标准溶液,溶剂为甲醇,浓度均为100 mg/L(美国o2si公司)。甲醇(农残级,美国Tedia公司)。
1.2仪器工作条件
1.2.1色谱条件Agilent 1701色谱柱(30 m×320 μm×1.00 μm);升温程序:初始温度50 ℃,保持7 min,以8 ℃/min升至150 ℃后,以15 ℃/min升至240 ℃,保持1.5 min。载气及流速:高纯氦气,流速1.8 mL/min;进样口温度:300 ℃;进样方式:不分流进样。

表1 3种化合物的选择离子扫描参数
*quantitative ion
1.2.2质谱条件电离方式:EI源;电离能量:70 eV;离子源温度:250 ℃;扫描方式:选择离子扫描(SIM),溶剂延迟:3 min;各物质的特征选择离子参数见表1。
1.3实验方法
1.3.1样品预处理参考国标GB/T 24153-2009[7]及文献[4]对样品进行预处理:取代表性试样,用适当工具将其碎至边长为3 mm以下的颗粒,混匀。称取混匀试样5.0 g(精确至0.01 g)置于锥形瓶中,加入30 mL甲醇,超声提取30 min。提取液移入浓缩瓶中,再向锥形瓶中加入20 mL甲醇,重复提取1次,合并提取液。浓缩瓶置于旋转蒸发仪上,控制真空度为21.3~16.3 kPa,于35 ℃水浴中缓慢浓缩至小于4.5 mL。取下浓缩瓶,于旋涡混匀器上充分旋转振荡1 min(以便于瓶壁上所粘附物质溶入提取液),然后将浓缩瓶中样液移入5 mL棕色容量瓶中。另取0.5 mL甲醇淋洗浓缩瓶壁,于旋涡混匀器上充分旋转振荡1 min 后,移入容量瓶合并,用甲醇定容至5 mL,摇匀。
1.3.2固相微萃取处理萃取头为CAR/PDMS。使用前萃取头需置于GC进样口,在载气保护下300 ℃老化1 h以去除原有杂质。预处理后的试液移至有磁力搅拌子的样品瓶中,将SPME萃取头浸入试液中,30 ℃以800 r/min萃取30 min后取出,将萃取头插入GC-MS进样口解析3 min进行检测。
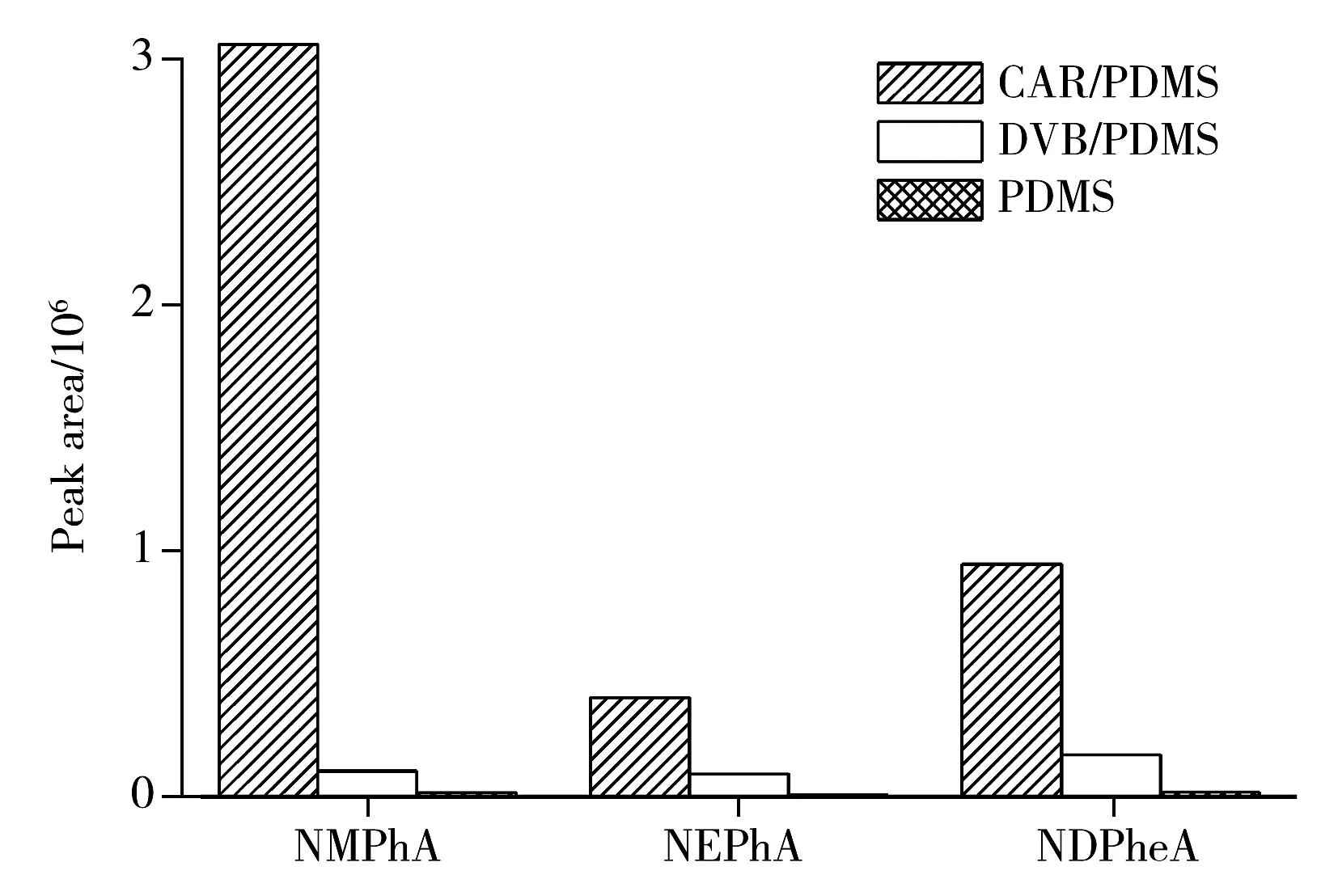
图1 不同萃取头的萃取效果比较图Fig.1 Comparison of nitrosamines response by different SPME fiber coatings
2结果与讨论
2.1萃取条件的优化
本研究对萃取头、萃取时间、搅拌速度及萃取温度4个因素进行了优化,使用溶液为500 μg/L的N-亚硝胺混合标准溶液。
2.1.1萃取头的优化不同萃取头类型对目标物质的萃取吸附能力不同。萃取组分的选择由目标萃取物的极性、固-液两相分配系数等参数共同作用而成。本研究考察了4种萃取头对3种化合物的萃取效果(见图1)。由图1可见,CAR/PDMS对3种化合物均具有较好的吸附,DVB/PDMS次之,PDMS仅有微弱的吸附,而PA萃取头对该3种化合物没有吸附作用,该结果与文献报道相符[13]。可见,CAR/PDMS对多数N-亚硝胺类物质具有较高的提取能力,因此实验选取CAR/PDMS为最优萃取头。
2.1.2萃取时间的选择考察了不同萃取时间(5,15,30,60 min)对萃取效果的影响。结果显示,随着萃取时间的增加,萃取效率逐渐增大。但萃取时间大于30 min后,萃取效率增加缓慢,这是由于萃取目标物在被萃取头萃取时,初始萃取效果随着萃取时间增长明显,但当目标物在萃取头与被测溶液之间达到平衡后,萃取头内部涂层需更多时间才能充分接触到目标物进行萃取,因此萃取效率增加缓慢。考虑到实验效率,本研究最终选取30 min作为SPME的最佳萃取时间。
2.1.3搅拌速度的选择考察了不同搅拌速度(0,400,800,1 200 r/min)对萃取效果的影响。结果显示,随着搅拌速度的增加,萃取效率逐渐增大,这是由于搅拌速度的增加使溶液中分析物的扩散速度加快,减少了因萃取后局部浓度下降带来的影响,使得萃取效率有所增大,当搅拌速度大于800 r/min后,萃取效率无明显变化。综合考虑,最终选取800 r/min为最佳搅拌速度。

图2 3种N-亚硝胺混合标准品的色谱图Fig.2 Chromatogram of 3 N-nitrosamines standard mixture
2.1.4萃取温度的选择考察了不同萃取温度(20,30,40 ℃)对萃取效率的影响。结果显示,随着温度的增加,萃取效率也增大,但由于所用溶剂为甲醇,温度过高会导致溶剂挥发,故选取30 ℃为最佳萃取温度。
在上述最优条件下,萃取500 μg/L N-亚硝胺混标所得的总离子流(TIC)图见图2。
2.2线性范围、检出限、回收率与精密度
在优化条件下,对5,25,50,100,200,500 μg/L系列浓度的N-亚硝胺标准溶液进行SPME萃取,以各组分的浓度(x,μg/L)为横坐标,对应的峰面积(y)为纵坐标,绘制标准曲线。所得线性回归方程和相关系数(r)见表2。以各物质的特征离子峰信噪比S/N≥3为检出限,结合样品前处理的稀释倍数计算得到各化合物的检出限为0.5 μg/kg。
采用标准加入法,在橡胶密封圈空白样品中分别添加不同浓度的混合标准溶液进行测定,每个添加水平(25,100,200 μg/kg)平行测定6次,其加标回收率和相对标准偏差(RSD)见表2。结果显示,方法的平均回收率为77%~92%,RSD(n=6)为3.8%~7.7%。

表2 3种N-亚硝胺的线性方程、相关系数(r)、回收率及相对标准偏差

表3 本方法与标准方法对样品的检测结果(n=6)
*no detected
2.3与标准方法的比较
选取1份橡胶密封圈空白样品,添加不同浓度的混合标准溶液,制成浓度水平为100,500 μg/kg的加标样品,每个加标样分别用本方法与国标GB/T 24153-2009方法进行实验,分别测定6次,加标回收率和RSD结果见表3。由表3可见,对于500 μg/kg的加标样品,两种方法均能测出,且本方法由于利用了SPME的富集浓缩效果,所得回收率优于国标方法;对于100 μg/kg的低浓度加标样品,国标方法无法测出含量,而本方法仍能很好地测出。另外,从实验操作上,SPME萃取法只需浸入试液中即可富集,而国标方法使用固相萃取技术则需要净化浓缩。因此,与国标方法相比,本方法的操作更加简便,灵敏度更高。

表4 橡胶密封材料样品的检测结果
*no detected
2.4实际样品的检测
应用本文建立的方法对10份饮用水管道系统用橡胶密封材料进行检测。结果表明,部分产品中存在一定量的被测物,其中4份样品检出NMPhA,3份样品检出NEPhA,1份样品检出NDPheA(见表4),应引起有关部门的重视。
3结论
本文建立了固相微萃取/气相色谱-质谱联用法测定饮用水管道系统用橡胶密封材料中3种N-亚硝胺的方法。与国标相比,该方法简化了前处理步骤,具有操作简单和灵敏度高等特点,可作为橡胶密封材料产品中N-亚硝胺物质的检测方法。
参考文献:
[1]Zhang R H,Xu D J,Jiang Y,Fei G P,Shao Y W.WorldRubberInd.(章若红,徐德佳,江艳,费国平,邵玉婉.世界橡胶工业),2011,38(4):33-36.
[2]Bouma K,Nab F M,Schothorst R C.FoodAddit.Contam.,2003,20(9):853-858.
[3]Altkofer W,Braune S,Ellendt K,Kettl-Gromminger M,Steiner G.Mol.Nutr.FoodRes.,2005,49(3):235-238.
[4]Tong Y G,Lin W,Lin Z,Fang G W,Cheng Q.LeatherSci.Eng.(童玉贵,林伟,林中,方光伟,程群.皮革科学与工程),2011,21(5):56-60.
[5]Xing Y N,Ni H G,Wang X,Chen Z Y,Huang J M.Chin.J.Anal.Chem.(幸苑娜,倪宏刚,王欣,陈泽勇,黄锦敏.分析化学),2011,39(7):1065-1070.
[6]Feng D,Yi X R,Yang H M,Li Z Z,Zhao L Y.Chin.J.Anal.Lab.(封棣,易馨如,杨慧敏,栗真真,赵丽源.分析试验室),2014,33(1):6-11.
[7]GB/T 24153-2009.Rubber and Elastomer Materials-Determination of N-Nitrosamines.National Standard of the People’s Republic of China(橡胶及弹性体材料 N-亚硝基胺的测定.中华人民共和国国家标准).
[8]Xing Y N,Wang X,Chen Z Y,Huang J M.J.Instrum.Anal.(幸苑娜,王欣,陈泽勇,黄锦敏.分析测试学报),2011,30(5):503-508.
[9]Li P,Bai H,Li H Y,Chen M,Lü Q,Zhang Q.Chin.J.Chromatogr.(李丕,白桦,李海玉,陈明,吕庆,张庆.色谱),2014,32(1):81-88.
[10]Yoon S,Nakada N,Tanaka H.Talanta,2012,97:256-261.
[11]Wang W F,Ren S Y,Zhang H F,Yu J W,An W,Hu J Y,Yang M.WaterRes.,2011,45(16):4930-4938.
[12]Grebel J E,Young C C,(Mel)Suffet I H.J.Chromatogr.A,2006,1117:11-18.
[13]Zhang Q J,Guo Z P,Li M Z,Cui S Y,Cao L B.Chin.J.HealthLab.Technol.(张秋菊,郭祖鹏,李明珠,崔世勇,曹林波.中国卫生检验杂志),2009,19(6):1234-1236.
[14]Li X B,Zhou H M,Li P,Ma J Q,Cheng Y X,Lü Z,Qi X R,Mo Y N.Chin.J.ForensicMed.(李学博,周海梅,李朴,马锦琦,程永学,吕宙,齐孝蕊,莫耀南.中国法医学杂志),2010,25(4):252-254.
[15]Wu Y C,Nie F,Yue Y C.J.Instrum.Anal.(吴迎春,聂峰,岳宇超.分析测试学报),2015,34(6):686-690.
[16]Chen N,Liu K F,Zhang Y P.J.Instrum.Anal.(陈娜,刘坤峰,张裕平.分析测试学报),2014,33(8):959-962.
Determination of N-Nitrosamines in Rubber Sealing Material by SPME/GC-MS
CAI Jin-an,LIU Zhi-jian,YUAN Jia-wei,PAN Yong-hong,YE Yuan-jian*
(Guangzhou Quality Supervision and Testing Institute,Guangzhou511447,China)
Abstract:A solid-phase microextraction(SPME) coupled with gas chromatography-mass spectrometry was developed for the determination of N-nitroso-N-methylaniline(NMPhA),N-nitroso-N-ethylamine(NEPhA) and N-nitrosodiphenylamine(NDPheA) in rubber sealing material.The samples were pretreated by GB/T 24153-2009 standard method,and then extracted by SPME.Influences of fibers species,extraction time,mixing speed and temperature on extraction efficiencies of three N-nitrosamines were optimized.Under the optimized experimental conditions,the linear ranges of NMPhA,NEPhA and NDPheA were between 5 μg/L and 500 μg/L with correlation coefficients(r) larger than 0.99. The method detection limits were 0.5 μg/kg.The average recoveries were in the range of 77%-92% with relative standard deviations(RSD,n=6) of 3.8%-7.7%.
Key words:rubber sealing material;solid-phase microextraction; gas chromatography-mass spectrometry;N-nitrosamine
中图分类号:O657.63; O623.73
文献标识码:A
文章编号:1004-4957(2016)02-0245-04
doi:10.3969/j.issn.1004-4957.2016.02.019
*通讯作者:叶元坚,博士,高级工程师,研究方向:涂料胶粘剂类产品检测,Tel:020-82022369,E-mail:silence_ye@163.com
基金项目:国家质检总局科技计划项目(2013QK283)
收稿日期:2015-10-22;修回日期:2015-11-19
