二氧化钛涂覆中空纤维膜微萃取
2015-09-11王樊何蔓陈贝贝向洋胡斌
王樊+何蔓+陈贝贝+向洋+胡斌


摘 要 采用溶胶-凝胶法制备了TiO2涂覆中空纤维膜,并对其进行了X射线衍射和扫描电镜表征。考察了其对多种金属离子的吸附行为,最佳的萃取条件为试样的pH=8.0,在搅拌速率700 r/min下萃取30 min, 使用100 μL 1 mol/L HNO3进行解吸。基于此,建立了TiO2涂覆中空纤维膜微型化固相萃取-电热蒸发(ETV)-电感耦合等离子体质谱(ICP-MS)联用测定环境水样中痕量重金属的新方法。本方法对Cr, Cu, Cd和Pb的检出限分别为0.039, 0.021, 0.009和0.018 ng/mL,富集倍数为10.3~18.6倍。自制TiO2涂覆中空纤维膜的制备重现性(RSD)为4.5%~6.8%(批内)和7.7%~9.6%(批间)。本方法被成功应用于标准水样、东湖水和雪水中Cr, Cu, Cd和Pb的分析。另外,将TiO2涂覆中空纤维膜与TiO2涂覆中空纤维膜搅拌棒进行了比较,结果表明,TiO2涂覆中空纤维膜不仅制备简单,而且对目标金属离子具有较高的萃取效率和吸附容量。
关键词 二氧化钛涂覆中空纤维膜; 固相微萃取; 电感耦合等离子体质谱; 电热蒸发; 重金属离子
1 引 言
随着科学技术和工农业生产的迅猛发展,重金属的污染也日益严重[1]。以各种化学状态存在的重金属易通过食物链而生物富集,进入生物体,严重威胁人类和生物体的健康安全。因此,建立灵敏、快速、准确的痕量重金属元素分析方法对重金属元素的环境和生物效应研究具有重要的现实意义。环境样品中待测元素含量低,基体复杂,常需要在仪器测定前辅以合适的样品前处理技术。20世纪90年代出现的固相微萃取(SPME)技术不仅继承了固相萃取的优点,而且集采样、萃取、富集、进样于一体,具有操作简单、省时、耗样量少、环境友好且易实现自动化等优点,近年来得到迅速发展[2]。目前,SPME技术的研究主要集中在性能良好的新型萃取涂层的探索[3~8]和新型SPME萃取模式的研究[9,10]。
膜固相萃取技术,作为SPME技术的发展,由于其自身的优点,引起了人们极大的关注[11]。中空纤维膜具有多孔性和柔韧性,多被用作液相微萃取中微量溶剂的支撑体,对复杂基质样品具有微滤作用,而且成本低廉,可一次性使用,能够有效减小记忆效应。中空纤维膜用于微型化固相萃取装置中也有报道。Lee课题组[12]在2004年首次将中空纤维膜与固相微萃取和搅拌棒吸附萃取结合,发展了聚合物涂覆中空纤维膜微萃取技术。与SPME相比,该技术有更高的富集倍数。Hu等[13]结合液相微萃取和分子印迹聚合物固相微萃取装置建立了液-液-固微萃取,该技术既具有分子印迹聚合物固相微萃取的高选择性,又有中空纤维膜液相微萃取的富集清洁能力。Mao等[14]将一段铁芯插入中空纤维膜内腔,两端封口后在其外表面涂覆TiO2制成搅拌棒,与高效液相色谱(HPLC)-ICP-MS联用,成功实现了对生物样品中As的形态分析。
在微型化固相萃取方法中,常得到小体积的洗脱馏分或萃取相,以实现对待测物的富集,因此在后续的进样及分析测定中,需要选择微量进样技术和高灵敏度检测手段相结合的方式。电热蒸发(ETV)作为ICP-MS的一种微量进样技术,具有进样效率高,耗样量少的优点[15],适用于固体和液体样品的分析,是高灵敏ICP-MS检测技术中理想的进样方式之一。ETV-ICP-MS不仅易与微型化的样品前处理技术联用,而且能够在一定程度上降低/消除基体效应及光/质谱干扰,提高分析方法的灵敏度。
本研究以廉价且具有柔韧性的中空纤维膜替代SPME中的石英纤维,利用溶胶凝胶法合成TiO2溶胶,将其涂覆在中空纤维膜的表面,构建一种基于中空纤维膜的新型微型化固相萃取模式,建立TiO2涂覆中空纤维膜微萃取与ETV-ICP-MS联用分析环境水样中Cr, Cu, Cd和Pb的新方法。
2 实验部分
2.1 仪器及主要工作参数
Mettler Toledo 320-S pH计(上海Mettler Toledo仪器有限公司);85-2A型恒温磁力搅拌器(江苏荣华仪器制造有限公司);SY1200超声仪(上海声源超声波仪器设备有限公司);X-650 电子扫描显微镜(日本HITACHI公司);Lab X-3000 X-射线粉末衍射仪(日本岛津公司);Q3/2 Accurel 聚丙烯中空纤维膜(内径600 μm,膜厚200 μm,孔径0.2 μm,德国Membrana, 公司)。
WF-4C型石墨炉(北京第二光学仪器厂)稍加改装后用作电热蒸发器。石墨炉与ICP-MS(Agilent 7500a)之间用改进的接口连接,在石墨炉和ICP炬管之间接一个同轴双层玻璃管,引入辅助载气,用于维持形成的ICP中心通道。用于连接的聚乙烯塑料管(内径6 mm)总长约70 cm。ICP-MS仪器主要操
[FQ(194\.24,Y-WZ][HT5”SS][*4]表1 电热蒸发-电感耦合等离子体质谱(ETV-ICP-MS)工作参数
2.2 试剂和标准溶液
钛酸四正丁酯(天津科密欧化学试剂有限公司); 乙酰丙酮(汕头广东西陇化工厂); 无水乙醇、乙酸(国药集团化学试剂有限公司); HNO3(信阳市化学试剂厂), 均为分析纯;Cr、Cu、Cd和Pb的标准储备液(1.000 mg/mL)分别由Cr(NO3)3·9H2O(优级纯,中国化学试剂工厂)、CuO、CdO (光谱纯,上海第一试剂厂)、Pb(NO3)2(优级纯,上海第一试剂厂)溶解于2% (V/V) HNO3溶液配制,经稀释配成含待测元素的混合储备液,然后再逐级稀释成合适浓度的工作标准溶液。各种干扰离子的标准储备液(1.00 mg/mL)按实验室常规方法配制。
其它所用试剂均为分析纯或优级纯;实验用水均为高纯去离子水(Milli-Q Element 系统,18.2 MΩ·cm, 法国Milli-pore公司);实验中所用容器均在5% HNO3 (V/V)中浸泡24 h以上,并用高纯去离子水冲洗干净后备用。
2.3 二氧化钛涂覆中空纤维膜的制备
2.3.1 TiO2溶胶的合成和TiO2涂覆中空纤维膜的制备 TiO2溶胶的合成与文献[14]相同。采用以下方法制备TiO2涂覆中空纤维膜:将中空纤维膜截成2 cm的小段,在丙酮溶剂中超声15 min,洗涤去除杂质,取出后在空气中自然晾干,以减小中空纤维膜带来的外来污染。将干燥后的聚丙烯中空纤维膜在TiO2溶胶中浸泡2 h,取出,于室温下干燥1 h。整个浸泡-干燥的过程重复4次,即可得到TiO2涂覆中空纤维膜(TiO2-coated HF)。将涂覆后的中空纤维膜于80℃下水浴6 h,取出,在空气中干燥备用。
作为比较,本实验按照文献[14]报道的方法合成了TiO2涂覆中空纤维膜搅拌棒。
2.3.2 实验步骤
用0.1 mol/L HNO3和0.1 mol/L NH3·H2O调节样品溶液至pH 8.0,移取3 mL样品溶液至5 mL样品瓶中,用微量注射器将自制TiO2涂覆中空纤维膜置于样品溶液中,加入磁子后开启磁力搅拌器,在700 r/min下萃取30 min。萃取完成后,将中空纤维膜移出样品溶液,放入解吸管(底部封口的200 μL移液枪枪头)中,用100 μL 1 mol/L HNO3超声解吸10 min,解吸液引入后续ETV-ICP-MS进行检测。为了避免记忆效应,中空纤维膜萃取材料均为一次性使用。TiO2涂覆中空纤维膜搅拌棒吸附萃取操作同上,不需要加入磁子辅助搅拌。
ETV的升温程序列于表1,在石墨炉中加入10 μL解吸液,在干燥步骤开始时,进样孔敞开以除去溶剂,在蒸发阶段前6 s,用石墨锥塞住进样孔,使蒸发的试样随石墨炉载气及辅助载气一起进入等离子体中,分析物信号由ICP-MS检测。
2.3.3 样品处理 用聚乙烯塑料瓶从东湖(武汉)采集水样,瓶中装满水,不留空气,带回实验室后用0.45 μm滤膜过滤,将过滤后的水样用HNO3调至pH 2。用广口塑料烧杯采集当地新鲜雪样,在室温下溶解,用0.45 μm滤膜过滤后,用HNO3调至pH 2。标准水样(GSBZ50009-88(200925)):按照使用说明,先移取适量标样,用1% HNO3(V/V)将其稀释25倍后于4℃条件下保存,使用前再将其稀释100倍。
环境水样在过滤和酸化后,均于4℃条件下保存在塑料瓶中;使用前,用0.1 mol/L HNO3和0.1 mol/L NH3·H2O调至pH 8。
3 结果与讨论
3.1 TiO2涂覆中空纤维膜的表征
3.1.1 X-射线衍射(XRD)分析 对涂覆在中空纤维膜表面的TiO2进行XRD表征,结果显示,在25.27°, 37.84°和 48.07°分别出现了锐钛矿型氧化钛的特征峰,说明本实验方法合成的TiO2具有锐钛矿型结构。
3.1.2 扫描电镜分析 通过扫描电镜(SEM)对中空纤维膜表面的形貌进行表征。由图1可见,涂覆TiO2的聚丙烯中空纤维膜的膜孔结构基本都被TiO2均匀填充,原有的多孔膜结构已被破坏。通过涂覆,TiO2涂层负载在膜的表面,可以与溶液中的金属离子直接接触,提高了传质动力。
图1 涂覆TiO2的聚丙烯中空纤维膜(HF)的扫描电镜图
Fig.1 SEM images of TiO2-coated hollow fiber (HF) and polypropylene HF
longitudinal image of polypropyleneHF (A) and TiO2-coated HF(B), (×100); cross-sectional image of TiO2-coated HF(C); textural image of polypropylene HF(D) and TiO2-coated HF (E)
3.2 ETV参数的优化
为了获得极大的瞬间分析信号,对ETV蒸发温度和蒸发时间进行了优化。最后选择的蒸发温度和蒸发时间分别为2600℃和4 s。
3.3 萃取条件的优化
在TiO2涂覆中空纤维膜微萃取中影响Cr, Cu, Cd和Pb萃取效率的主要因素有:样品pH值、萃取时间、搅拌速率、解吸剂浓度和体积,解吸时间及样品体积等。分别考察了这些因素的影响。
3.3.1 pH值 TiO2是两性氧化物,其表面存在着两种不同性质的端羟基和桥羟基,其结构式如下:
TiOH(Terminal)OHHOOTiOHOTiHOHO Bridged
OHTiTi+Mn+1OTiTi---Mn++H+(1)
Ti-OH+2OH
TiOH
O
TiOH
O
n+1(L)x+1TiOH
OMn+(L)x+L(2)
桥羟基容易被金属离子极化而显酸性,端羟基则显碱性。金属阳离子在TiO2表面的吸附过程中,两种表面羟基都参与了作用,吸附反应分别表示为(1)式和(2)式,其中L是络合剂,Mn+是金属阳离子。当酸度较高时(pH值小于TiO2的等电点6.02),部分金属阳离子可通过与桥羟基进行交换反应而吸附在TiO2表面,如反应(1);当溶液酸度较低(pH﹥6.02)时,端羟基被OH
覆盖而带上负电荷,可以通过静电作用吸附金属阳离子[16],如反应(2)。因此,溶液的pH值对金属离子在TiO2表面的吸附起着至关重要的作用。考察了pH值在4.0~9.5的范围内变化时对4种待测金属离子在TiO2涂覆中空纤维膜上吸附行为的影响。由图2可见,随着样品溶液pH值增大,各金属离子的萃取效率增大,当pH≥8时,各种金属离子吸附率变化不甚明显。因此,后续实验中选择样品溶液的酸度为pH 8.0。
图2 pH值对涂覆TiO2的聚丙烯中空纤维膜吸附性能的影响
Fig.2 Effect of pH on the adsorption of analytes on TiO2-coated HF
Extraction time, 30 min; stirring rate, 700 r/min; sample volume, 3 mL; concentrations of each analytes, 10 ng/mL.
3.3.2萃取时间和搅拌速率 考察了10~50 min范围内待测元素的信号强度与萃取时间之间的关系,结果表明,Cr和Cd在20 min后萃取信号基本达到平台,而其它两种元素的萃取信号在30 min后达到平台。因此,本研究的萃取时间选择30 min。
考察了搅拌速率对萃取信号的影响,搅拌速率过大(>1000 r/min)时,样品溶液中部形成较大的漩涡,易使中空纤维膜在转动过程中与磁子发生碰撞,导致中空纤维膜的转动不稳定。为了避免这种情况,考察了400~900 r/min范围内搅拌速率对萃取信号的影响,结果表明,在400~600 r/min范围内,萃取信号随着搅拌速率的增加而增大,当搅拌速率在600~900 r/min范围内变化时,萃取信号基本保持不变。因此,本工作选择搅拌速率为 700 r/min。
3.3.3 解吸条件 由图3可见,溶液酸度较高时各待测元素在涂覆TiO2的中空纤维膜上的吸附效率很低,因此,可以采用较高浓度的酸将吸附的待测元素从TiO2涂覆中空纤维膜上解吸下来。本实验以HNO3作为解吸溶剂,考察了解吸剂体积为100 μL时,不同浓度(0.1, 0.5, 1.0, 1.5和2.0 mol/L) HNO3作为解吸剂对各待测元素解吸的影响。由图3a可见,各待测元素的信号强度随HNO3浓度的增加而增大,当HNO3浓度大于1 mol/L时,解吸液中各待测元素的信号强度达到平台,因此,在后续实验中选择1 mol/L HNO3溶液作为解吸剂。
在本实验所用解吸管中,100 μL解吸剂恰好可以使中空纤维膜完全浸没。为了考察解吸剂体积对解吸的影响,分别采用100 μL 1 mol/L HNO3先后两次对萃取后的TiO2涂覆中空纤维膜进行解吸,并将两次解吸液中待测元素信号强度与HNO3的空白信号相比较(图3b),第二份解吸液的信号强度与空白信号强度相差不大,说明100 μL 1 mol/L HNO3足够将被吸附的待测元素定量解吸下来。因此,后续实验中均使用100 μL 1 mol/L HNO3进行解吸。
另外,考察了室温条件下超声时间对待测元素解吸效率的影响,结果表明,解吸时间达到5 min后,Pb的信号强度达到平台,其它3种元素在10 min以后解吸信号均达到最大值,因此,本实验的解吸时间选择为10 min。在实验过程中发现,中空纤维膜上的TiO2涂层在超声解吸的作用下部分脱落,因此每根涂覆TiO2的中空纤维膜仅使用一次,这样也有效避免了记忆效应。
3.3.4 样品体积 固定样品溶液中各待测金属离子的浓度不变,考察了样品体积分别为1.5, 3, 5, 10, 15, 20和30 mL时的萃取情况,结果表明,当样品体积从1.5 mL增大到 3.0 mL时,信号强度有所提高;当样品体积大于 3.0 mL时,各待测元素的信号强度没有明显变化。因此, 样品体积选择3 mL。
3.4 干扰离子的影响
固定待测元素的浓度为10 ng/mL,考察了环境水样中常见的共存离子K+, Na+, Ca2+, Mg2+, Zn2+, Al3+, Fe3+, Ba2+, Mn2+, SiO2
SO2
HCO
Cl
对各待测元素分析测定的影响。将不同浓度的干扰离子分别加入3 mL 10 ng/mL样品溶液中进行萃取,对比加入和不加入干扰离子的样品溶液的解吸信号,当待测元素信号强度测定误差在±10%以内时,认为所加干扰离子对待测元素的萃取和测定不产生干扰。在选定的实验条件下,得到各干扰离子的最大允许量。由表2可知,对于水体中常见的阳离子K+, Na+, Ca2+, Mg2+, Al3+, Fe3+, Ba2+, Mn2+,其最大允许量在20~3000 μg/mL范围内;常见水体阴离子SiO2
SO2
HCO
Cl
的最大允许量在500~2000 μg/mL之间。说明本方法的抗干扰能力较好,可应
用于实际环境水样的分析。
3.5 TiO2涂覆中空纤维膜的性能评价
3.5.1 材料制备的重现性 在优化的实验条件下,固定待测元素的浓度为0.5 ng/mL,分别考察了同一批次(9根)和不同批次(7根)制备的TiO2涂覆中空纤维膜对待测元素的萃取效率的重现性。由表3可知,自制TiO2涂覆中空纤维膜批内的相对标准偏差(RSD)在4.5%~
3.5.2 吸附容量 吸附容量是评价吸附材料性能的重要因素。考察了所制备的TiO2涂覆中空纤维膜
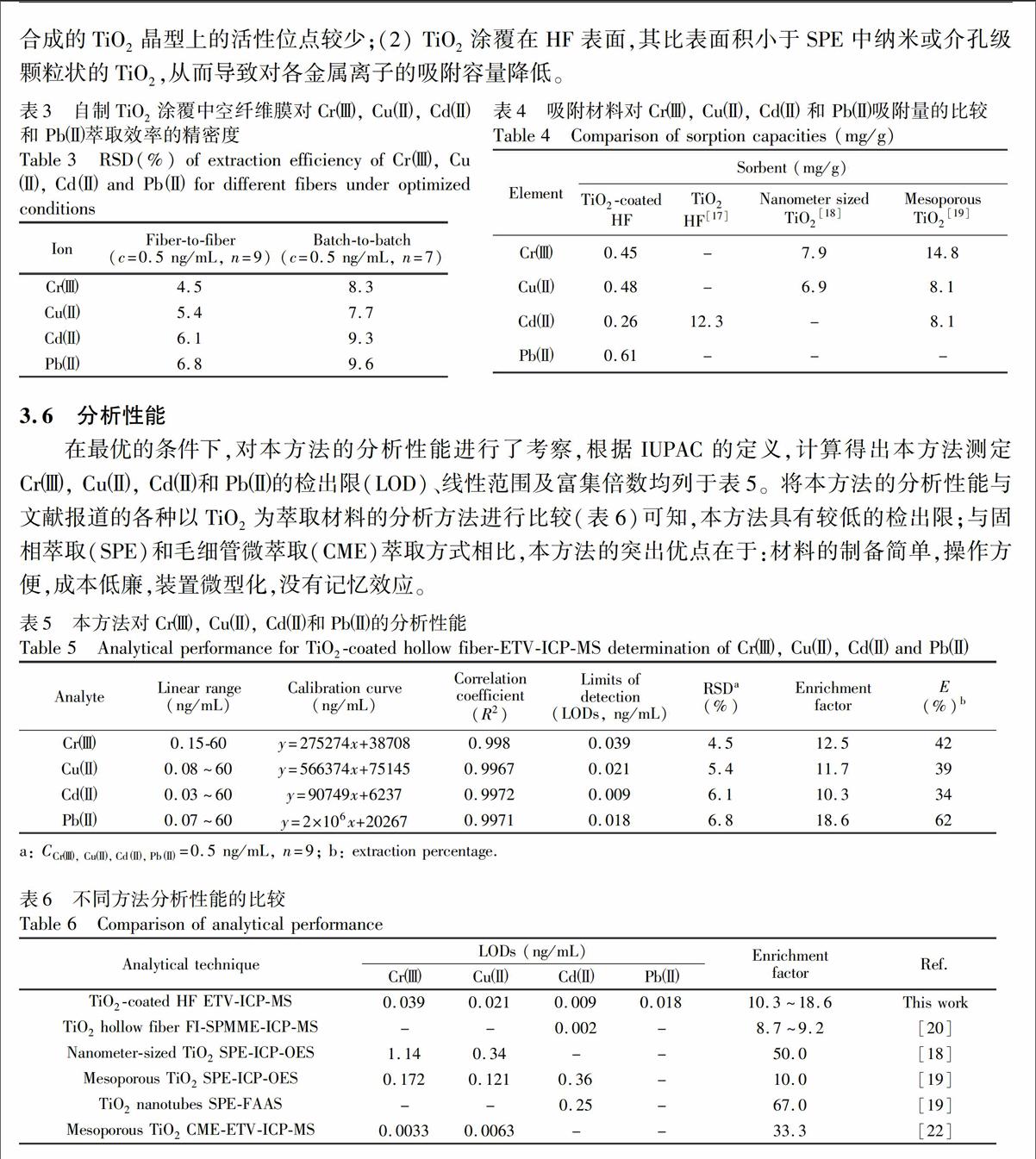
对Cr, Cu, Cd和Pb的吸附容量。方法如下:配制系列浓度的样品溶液,在选定的实验条件下进行萃取,检测解吸液中目标分析物的信号强度。当信号强度达到平台时,表示各元素的吸附已达到饱和。依此得到4种离子的吸附容量分别为0.45,0.48,0.26和0.61 mg/g。将本方法所制备TiO2与文献报道的TiO2膜、纳米TiO2和介孔TiO2的吸附容量进行对比。由表4可知,本实验经低温(80℃)合成的TiO2的吸附容量小于高温 (>300℃) 条件下合成的其它类型TiO2。可能原因有两方面:(1)低温合成的TiO2晶型上的活性位点较少;(2) TiO2涂覆在HF表面,其比表面积小于SPE中纳米或介孔级颗粒状的TiO2,从而导致对各金属离子的吸附容量降低。
3.6 分析性能
在最优的条件下,对本方法的分析性能进行了考察,根据IUPAC的定义,计算得出本方法测定Cr, Cu, Cd和Pb的检出限(LOD)、线性范围及富集倍数均列于表5。将本方法的分析性能与文献报道的各种以TiO2为萃取材料的分析方法进行比较(表6)可知,本方法具有较低的检出限;与固相萃取(SPE)和毛细管微萃取(CME)萃取方式相比,本方法的突出优点在于:材料的制备简单,操作方便,成本低廉,装置微型化,没有记忆效应。
[HT5”SS][*4]表5 本方法对Cr, Cu, Cd和Pb的分析性能
Table 5 Analytical performance for TiO2-coated hollow fiber-ETV-ICP-MS determination of Cr, Cu, Cd and Pb
[HT6SS][BG(][BHDFG4,WK7。2,WK10,WK7。2,WK6,WK7,WK6W]AnalyteLinear range(ng/mL)Calibration curve (ng/mL)Correlation
coefficient(R2)Limits of
detection(LODs, ng/mL)RSDa(%)
EnrichmentfactorE
(%)bCr0.15-60y=275274x+387080.9980.039
4.512.542Cu0.08~60y=566374x+751450.9967
0.0215.411.739
Cd0.03~60y=90749x+62370.99720.0096.1
10.334Pb0.07~60y=2×106x+202670.99710.018
6.818.662[BHDFG3,WKZQ0W]a: CCr, Cu, Cd, Pb =0.5 ng/mL, n=9; b: extraction percentage. [BG)W][HT5][]
3.7 与TiO2涂覆中空纤维膜搅拌棒的比较
TiO2涂覆中空纤维膜搅拌棒(TiO2-coatedHF SBSE)的萃取过程与本方法相比,只有搅拌形式有所不同,本方法借助聚四氟乙烯磁子完成搅拌,因为金属离子不会被其吸附,所以不存在搅拌磁子的吸附干扰问题;TiO2-coated HF SBSE则在萃取的过程中可以自身完成搅拌。在其它萃取条件保持不变的情况
下,对TiO2-coated HF SBSE萃取中搅拌速率进行了优化。结果表明,待测离子的萃取信号在300~600 r/min范围内随着搅拌速率的增加而增大,在600 r/min时达到最大值,当搅拌速率继续增大时,萃取信号有所降低,可能是搅拌棒在剧烈的转动下与样品瓶底部产生摩擦,造成TiO2涂层的脱落,从而使萃取效率降低。所以选择TiO2-coated HF SBSE最佳的搅拌速率为600 r/min。
在最优条件下,将TiO2-coated HF和TiO2-coated HF SBSE两种萃取方式对4种金属离子的萃取效率和吸附容量分别进行了比较(图4),同样长度的TiO2-coated HF对待测离子的萃取效率和吸附容量相对于TiO2-coated HF SBSE略有增大。此结果可以从两种材料的制备过程加以解释,在TiO2-coated HF的制备中,中空纤维膜浸泡在TiO2溶胶中完成涂覆,其外表面和内表面均涂覆有TiO2,而TiO2-coated HF SBSE只有中空纤维膜的外表面涂有TiO2,从而导致萃取效率和吸附容量相对较小。
与TiO2-coated HF SBSE萃取方式相比,本方法在萃取过程中虽然需要使用磁子辅助完成搅拌,但是并不会带来磁子对待测金属离子的吸附干扰问题,甚至避免了搅拌棒萃取过程中因为与样品瓶底部之间剧烈摩擦而造成涂层脱落的现象,而且本方法省略了在中空纤维膜中插入铁芯这一步骤,材料的制备相对简单。
3.8 样品分析
为了验证方法的准确性,将本方法应用于国家标准水样GSBZ50009-88(200925)的分析,测定结果(表7)表明,本方法的测定值与标准值吻合良好。将本方法应用于雪水(武汉),东湖水(武汉)中痕量Cr, Cu, Cd和Pb的分析测定,分析结果及加标回收率
4 结 论
本研究构建了一种基于中空纤维膜的新型微型化固相萃取方式,建立了TiO2涂覆中空纤维膜微萃取分离富集和ETV-ICP-MS联用测定环境水样中痕量Cr, Cu, Cd和Pb的新方法。与传统SPME相比,本方法以中空纤维膜作为TiO2涂覆材料的载体,具有材料制备简单、成本低廉,装置简便,无有记忆效应的优点。与TiO2涂覆中空纤维膜搅拌棒相比,自制TiO2涂覆中空纤维膜不仅具有较高的萃取效率和吸附容量,在材料的制备上更容易操作,还有效避免了搅拌过程中涂层易脱落的问题。
References
1 Zhang H, Ma D, Xie Q, Chen X. Environ. Geol., 1999, 38: 223-228
2 Ouyang G, Pawliszyn J. Anal. Bioanal Chem, 2006, 386(5): 1059-1073
3 Liu M M, Zeng Z R, Fang H F. J. Chromatogr. A, 2005, 1076(1-2): 16-26
4 Liu M M, Zeng Z R, Xiong B. J. Chromatogr. A, 2005, 1065(2): 287-299
5 PENG Ying, ZHUANG Yuan, HE Huan, SUN Cheng, YANG Shao-Gui. Chinese J. Anal. Chem., 2014, 42(9): 1359-1363
彭 英, 庄 园, 何 欢, 孙 成, 杨绍贵. 分析化学, 2014, 42(9): 1359-1363
6 HUANG Jian-Xiang, HU Yu-Ling, LI Gong-Ke. Journal of Analytical Science, 2008, 24(1): 97-102
黄健祥, 胡玉玲, 李攻科. 分析科学学报, 2008, 24(1): 97-102
7 Cha D, Liu M, Zeng Z, Cheng D E, Zhan G. Anal. Chim. Acta, 2006, 572(1): 47-54
8 ZHOU Rui-Juan, XING Jun. Chinese J. Anal. Chem., 2013, 41(7): 1115-1119
周瑞娟, 邢 钧. 分析化学, 2013, 41(7): 1115-1119
9 Hu C, He M, Chen B B, Zhong C, Hu B. J. Chromatogr. A, 2014, 1356: 45-53
10 Liu X, He M, Chen B, Hu B. Spectrochim Acta, B, 2014, 101: 254-260
11 Carasek E, Merib J. A review. Anal. Chim. Acta, 2015, 880: 8-25
12 Basheer C, Suresh V, Renu R, Lee H K. J. Chromatogr. A, 2004, 1033(2): 213-220
13 Hu Y, Wang Y, Hu Y, Li G. J. Chromatogr. A, 2009, 1216(47): 8304-8311
14 Mao X J, Chen B B, Huang C Z, He M, Hu B. J. Chromatogr. A, 2011, 1218(1): 1-9
15 Hu B, Li S, Xiang G, He M, Jiang Z. Appl. Spectrosc. Rev., 2007, 42(2): 203-234
16 Vassileva E, Proinova I, Hadjiivanov K. Analyst, 1996, 121(5): 607-612
17 Huang C Z, Jiang Z C, Hu B. Talanta, 2007, 73(2): 274-281
18 Liang P, Qin Y C, Hu B, Peng T Y, Jiang Z C. Anal. Chim. Acta, 2001, 440: 207-213
19 Zhou Q X, Zhao X N, Xiao J P. Talanta, 2009, 77(5): 1774-1777
20 Huang C Z, Hu B. Analyst, 2011, 136(7): 1425-1432
21 Liang P. Hu B, Jiang Z C, Qin Y C, Peng T Y. J. Anal. At. Spectrom., 2001, 16(8): 863-866
22 Wu Y W, Hu B, Hu W L, Jiang Z C, Li B Y Z. J. Mass Spectrom., 2007, 42(4): 467-475
