高效液相色谱-串联质谱法测定地表水样品中5种有机磷酸酯代谢物
2016-03-25李闯修赵晓丽高立红史亚利谭伟强蔡亚岐
李闯修,赵晓丽,高立红,史亚利,谭伟强*,蔡亚岐*
(1.青岛理工大学 环境与市政工程学院,山东 青岛 266033;2.中国环境科学研究院 环境基准与
风险评估国家重点实验室,北京 100012;3.中国科学院生态环境研究中心 环境化学与
生态毒理学国家重点实验室,北京 100085)
高效液相色谱-串联质谱法测定地表水样品中5种有机磷酸酯代谢物
李闯修1,赵晓丽2,高立红3,史亚利3,谭伟强1*,蔡亚岐3*
(1.青岛理工大学环境与市政工程学院,山东青岛266033;2.中国环境科学研究院环境基准与
风险评估国家重点实验室,北京100012;3.中国科学院生态环境研究中心环境化学与
生态毒理学国家重点实验室,北京100085)
摘要:将固相萃取(SPE)和高效液相色谱-串联质谱(LC-MS/MS)结合,建立了河水样品中5种有机磷酸酯(OPEs)代谢物的分析方法。样品过滤后,使用HLB固相萃取小柱进行富集净化,采用6 mL甲醇洗脱后氮吹定容。以Luna Phenyl-Hexyl色谱柱为分离柱,甲醇和50 mmol·L-1乙酸铵水溶液为流动相梯度洗脱,在电喷雾负离子模式下,采用多反应监测模式(MRM)进行测定。优化条件下,仪器测定限(IDL)为0.002~1.15 μg·L-1,方法检出限(MDL)为0.15~4.48 ng·L-1,实际水样加标浓度为10 ng·L-1和50 ng·L-1时回收率分别为54.1%~83.6%和57.8%~102%,相对标准偏差(RSD)分别为5.3%~19.5%和2.8%~15.7%。考察了基质效应对5种化合物分析的影响,同时应用该方法对武汉7个湖水样品进行分析,除DEHP外其它4种OPEs代谢物均有检出。该方法具有良好的精密度和准确度,可用于有机磷酸酯代谢物的环境行为研究。
关键词:有机磷酸酯代谢物;高效液相色谱-串联质谱;河水;固相萃取
随着多溴联苯醚(Polybrominated diphenyl ethers,PBDEs)等溴代阻燃剂在世界范围内逐步被禁用,有机磷酸酯(Organophosphate esters,OPEs)阻燃剂成为其主要替代品。由于阻燃效果好、生产成本低等优点,OPEs阻燃剂的使用量逐年增加[1-2]。除了用作阻燃剂外,OPEs还常作为增塑剂应用于地板抛光、涂料、工程塑料、环氧树脂和电子产品等领域[3-4]。在大多数情况下,添加到产品中的OPEs主要通过物理作用与材料结合,因此,有机磷酸酯易通过磨损和挥发作用释放到环境中[5-6]。目前,有研究表明OPEs广泛存在于水体、沉积物、室内空气和灰尘等各种环境介质中,以及鱼类和人体血液等生物介质中[7],并且会对人体健康产生负面影响,如磷酸三氯乙酯(Tris-2-chloroethyl,TCEP)具有致癌性、高毒性和环境持久性,非氯代的OPEs如磷酸三正丁基酯(Tri-n-butyl phosphate,TnBP)在慢性暴露后表现出神经毒性[8-9]。OPEs进入人体后会迅速代谢生成二烷基和二苯基类磷酸酯等代谢产物,并且可通过尿液等途径排出体外,例如在尿液中检出了作为主要代谢物的磷酸二苯基酯(Diphenyl phosphate,DPhP)[10-11]。虽然二烷基和二苯基类磷酸酯在人体内也会进一步水解为单烷基和单苯基类磷酸酯,但尿液中多数单酯含量均低于相应的二烷基和二苯基类磷酸酯的含量[12]。
鉴于有机磷酸酯在环境、生物体和人体中较高程度的降解代谢及普遍性,准确分析环境样品中有机磷酸酯代谢物对于深入研究OPEs的迁移转化和生物富集等环境行为具有重要意义。目前,关于OPEs代谢物的分析方法研究较少,仅有少数采用气相色谱-串联质谱联用(GC-MS/MS)以及液相色谱-串联质谱联用(LC-MS/MS)分析的报道[10-11,13-15]。虽然GC-MS/MS无明显的基体效应,但由于有机磷酸酯代谢物的极性较大,分析前必须进行衍生,因此这类方法的应用较少[11,13]。而LC-MS/MS分析有机磷酸酯代谢物的方法仅处于研究阶段,在实际环境样品分析中的应用较少[10-11,14-15],其萃取方法和色谱分离仍有待进一步优化。
本研究采用固相萃取为水样前处理技术,经浓缩净化后的样品用LC-MS/MS方法进行分离检测,建立了实际水样中5种OPEs代谢物的分析方法,可以满足OPEs代谢物的检测要求。
1实验部分
1.1仪器、试剂与材料
液相色谱仪(UltiMate 3000,美国Thermo Fisher公司)和Chromeleon 6.70色谱工作站;Phenomenex Luna Phenyl-Hexyl色谱柱(150 mm×2.0 mm,5 μm)和Acclaim 120(150 mm×2.1 mm,5 μm)色谱柱。API3200三重四极杆串联质谱仪(美国AppliedBiosystems公司):包括电喷雾离子源(ESI)和Analyst 1.4.1工作软件;固相萃取小柱包括Waters Oasis HLB(6 mL,200 mg)、HypeSep Retain PEP(6 mL,200 mg)和Water Oasis WAX(6 mL,150 mg),GF/C玻璃纤维滤膜(英国Whatman公司,1.2 μm)。 Votex涡旋混合器(海门市其林贝尔仪器制造有限公司)。
5种OPEs代谢物标准品:磷酸二苯基酯(DPhP)、磷酸二(1,3-二氯-2-丙基)酯(BDCPP)、磷酸二异丁基酯(DiBP)、磷酸二正丁基酯(DnBP)、磷酸二乙基己基酯(DEHP)以及全氘代同位素内标物BDCPP-d10、DPhP-d10(纯度95%)均购自美国TRC公司。甲醇、乙腈(色谱纯,美国Fisher Scientific公司),乙酸铵(美国Alfa Aesar公司),实验所用超纯水由Milli-Q纯水仪(美国Millipore公司)制得。
OPEs代谢物单标储备液(1 000 mg·L-1)用甲醇配制,5种OPEs的混标储备液(10 mg·L-1)用甲醇稀释单标储备液配制。OPEs代谢物同位素内标(DPhP-d10,1 mg·L-1;BDCPP-d10,10 mg·L-1)采用甲醇配制。所有储备液置于-20 ℃冰箱中保存。
1.2色谱-质谱条件
色谱条件:Phenomenex Luna Phenyl-Hexyl色谱柱(150 mm×2.0 mm,5 μm),柱温25 ℃。流动相为甲醇(A)-50 mmol/L乙酸铵水溶液(B),梯度洗脱条件:0~1 min,50%~100% A;1~11 min,100%A;11~11.5 min,100%~50%A;11.5~20 min,保持50%A。流速:0.2 mL·min-1,进样量:15 μL。
质谱条件:采用电喷雾离子源(ESI),分析物在负离子扫描下以多反应监测(MRM)模式分析。采用针泵进样,分别进行Q1和Q3扫描确定母离子和子离子,优化解簇电压(DP)、入口电压(EP)等参数(见表1)。在选定色谱条件下,接入检测流动相后优化Gas1、Gas2和离子喷雾电压等参数,使信号稳定,灵敏度最高。优化后的质谱条件:气帘气压力0.07 MPa;碰撞气压力0.02 MPa;离子喷雾电压-4 500 V;雾化温度500 ℃;离子源Gas1:0.34 MPa,Gas2:0.34 MPa。

表1 质谱检测条件
*quantitative ion
1.3样品前处理
地表水样品为采自武汉某地的湖水,样品保存于500 mL玻璃瓶中。
采用1.2 μm的玻璃纤维滤膜过滤水样后,准确量取200 mL,加入50 μL同位素内标(内标物DPhP-d10和BDCPP-d10的质量浓度分别为50 μg·L-1和500 μg·L-1),样品通过Oasis HLB固相萃取小柱(6 mL,200 mg)进行萃取净化。上样前依次用5 mL甲醇和5 mL超纯水活化小柱,上样流速为3 mL·min-1,上样完成后用10 mL超纯水淋洗HLB小柱,然后在负压下抽干,最后用6 mL甲醇洗脱,洗脱液在40 ℃下氮吹浓缩至0.5 mL以下,再用初始比例流动相定容至1 mL,待测。
2结果与讨论
2.1样品前处理条件的优化
2.1.1固相萃取小柱的选择采用纯水加标回收实验分别考察了HLB、PEP和WAX 3种固相萃取小柱的萃取效果,结果发现,PEP和WAX小柱对DiBP和DnBP的回收率较低(0~14.2%),其中WAX小柱对这两种化合物的加标回收率为0,而HLB小柱的萃取回收率在50.2%~85.8%之间,可以满足微量分析的要求,因此本文采用HLB小柱对水样进行萃取富集。

图1 未分离的DiBP和DnBP色谱图(100 μg·L-1)Fig.1 Chromatogram of inseparable DiBP and DnBP(100 μg·L-1)
2.1.2洗脱液的选择采用HLB小柱进行萃取富集,分别采用6 mL甲醇和乙腈作洗脱液进行加标回收实验。结果表明,采用甲醇作洗脱液时5种OPEs代谢物的回收率较高,为61%~113%;乙腈作洗脱液时的回收率为16.5%~200%,其中对DEHP的平均回收率较低(16.5%),而对DiBP和DnBP的平均回收率较高(200%)。本研究采用内标法定量,由于DiBP和DnBP的内标物DPhP-d10回收率较低,造成DiBP和DnBP的相对回收率较高。因此,本文采用甲醇作为洗脱液。
2.2HPLC-MS/MS条件优化
在流动相为甲醇和50 mmol·L-1乙酸铵水溶液条件下,使用Acclaim 120型色谱柱不能将同分异构体DiBP和DnBP有效分离(如图1所示),通过优化梯度洗脱条件也无法得到改善。而选用Luna Phenyl-Hexyl色谱柱可以实现两种同分异构体的分离,在该体系下,优化流动相梯度洗脱条件后得到DiBP和DnBP的色谱图(见图2)。因此,本文采用Luna Phenyl-Hexyl色谱柱对5种OPEs代谢物进行分离。
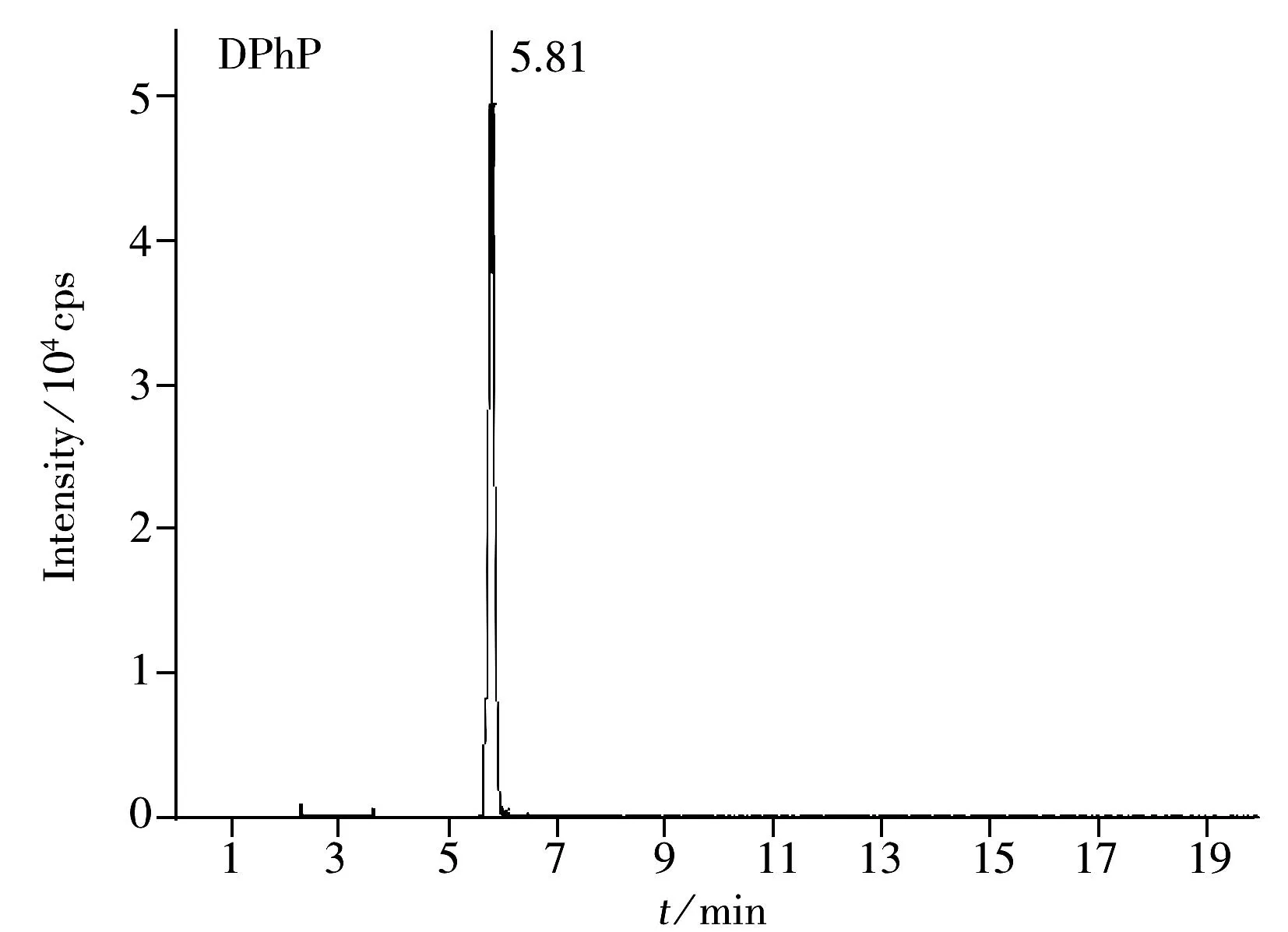


采用Luna Phenyl-Hexyl色谱柱对5种OPEs代谢物进行分离,在梯度洗脱条件下,以甲醇-50 mmol·L-1乙酸铵水溶液作流动相时,5种OPEs代谢物的灵敏度较高,峰形尖锐对称,但DiBP,DnBP和DPhP的分离度小。实验采用甲醇和1 mmol·L-1四丁基氢氧化铵+1 mmol·L-1乙酸水溶液作流动相进行对比,以离子对试剂作为缓冲盐,增强目标化合物的保留能力,以期达到更好的分离效果。研究发现,甲醇和1 mmol·L-1四丁基氢氧化铵+1 mmol·L-1乙酸水溶液作为流动相时,以上3种OPEs代谢物的分离度仍未得到改善,而且离子对试剂对色谱柱伤害较大。因此,本文采用甲醇和50 mmol·L-1乙酸铵水溶液作为流动相进行梯度洗脱,5种OPEs代谢物标准溶液的色谱图如图2所示。
2.3线性范围与检出限
用初始流动相(50%甲醇水溶液)分别配制0.2,0.5,1.0,3.0,5.0,10,100,500,1 000 μg·L-1系列浓度的混合标准溶液(内标物DPhP-d10和BDCPP-d10的质量浓度分别为50 μg·L-1和500 μg·L-1),在优化的色谱和质谱条件下,以内标法进行定量,得出分析方法的线性范围和检出限等参数(见表2)。结果表明,5种化合物在较宽的质量浓度范围内具有良好的线性,仪器测定下限(IDL,S/N=3)为0.002~1.15 μg·L-1,仪器定量下限(LOQ,S/N=10)为0.005~2.92 μg·L-1。本方法采用水样体积为200 mL,经过前处理后最终定容至1 mL进行测定,根据河水样品中5种化合物的实际浓度,估算3倍信噪比(S/N=3)时OPEs代谢物对应的浓度,得到方法检出限(MDL)为0.15~4.48 ng·L-1。

表2 OPEs代谢物的线性回归方程及相关参数
2.4精密度与准确度
对去离子水(加标浓度为25,250 ng·L-1)和实际河水样品(加标浓度为10,50 ng·L-1)进行加标回收实验,按本方法对水样进行处理,平行处理5份再测定,考察方法的精密度和回收率(见表3)。结果表明,本文建立的分析方法对5种OPEs代谢物的检测有良好的精密度与准确度。另外,为考察基质效应的影响,实际水样经前处理后,在平行样洗脱液中加入50 μL同位素内标(内标物DPhP-d10和BDCPP-d10质量浓度分别为50 μg·L-1和500 μg·L-1),再分别加入质量2 ng或10 ng的混标溶液,使实际水样加标浓度为10 ng·L-1或50 ng·L-1,根据如下公式计算基质效应(Matrix effect,ME):ME= [(Ase-Ab)/At]× 100%,Ase是加标后的实际水样经SPE浓缩净化处理后进样所得峰面积,Ab是未加标的实际水样经SPE浓缩净化处理后进样所得峰面积,At是标准溶液直接进样所得峰面积。从表3可以看出,该方法对实际水样中BDCPP和DEHP的测定存在一定的基质效应,但在两个加标水平下,除DiBP的回收率较低(54.1%和57.8%)外,其他代谢物的回收率均在66.9%~102%之间,因此对于低浓度的环境样品,该方法的分析结果可以满足环境分析的要求。

表3 去离子水和河水中OPEs代谢物的加标回收率及基质效应(n=5)
* no detected
2.5实际水样的测定
采用优化的前处理方法和HPLC-MS/MS检测条件,对武汉7个湖水样品进行分析。结果表明,除DEHP均未检出外,其它4个代谢物均有不同程度的检出,其中1#水样中OPEs代谢物的检出浓度最高,DiBP达到42.8 ng·L-1,说明这些OPEs的降解代谢产物在水环境中普遍存在。
表4武汉湖水样品中OPEs代谢物的浓度
Table 4Concentration of OPEs metabolites in lake water samples of Wuhan
(ng·L-1)

Analyte1#2#3#4#5#6#7#DPhP1.442.533.312.15-*--BDCPP18.3------DiBP42.82.252.329.4817.52.616.15DnBP13.82.576.937.8515.13.406.75DEHP-------
* no detected;1-7# represent seven lake water samples of Wuhan,respectively
3结论
本文将固相萃取与LC-MS/MS技术联用建立了环境水样中5种OPEs代谢物的分析方法,该方法具有灵敏度高、重现性好和可同时分析多种OPEs代谢物等优点,可以满足环境中OPEs代谢物检测的需求,为进一步开展有机磷阻燃剂的迁移转化等环境行为研究奠定基础。应用该方法对武汉湖水样品进行分析,在水体中检出了部分OPEs代谢物。
参考文献:
[1]Gao L H,Li W H,Shi Y L,Liu J M,Cai Y Q.Environ.Chem.(高立红,厉文辉,史亚利,刘杰民,蔡亚岐.环境化学),2014,33(10):1750-1761.
[2]He L X,Cao S X,Zeng X Y,Yu Z Q,Sheng G Y,Fu J M.J.Instrum.Anal.(何丽雄,曹曙霞,曾祥英,于志强,盛国英,傅家谟.分析测试学报),2013,32(4):437-441.
[3]van der Veen I,de Boer J.Chemosphere,2012,88(10):1119-1153.
[4]Brandsma S,de Boer J,Leonards P E G,Cofino W,Covaci A.Trac-TrendsAnal.Chem.,2013,43:217-228.
[5]Marklund A,Andersson B,Haqlund P.Chemosphere,2003,53(9):1137-1146.
[6]Wensing M,Uhde E,Salthammer T.Sci.TotalEnviron.,2005,339(1/3):19-40.
[7]Salamova A,Ma Y,Venier M,Hites R A.Environ.Sci.Technol.Lett.,2014,1(1):8-14.
[8]Venier,M,Dove A,Romanak K,Backus S,Hites R.Environ.Sci.Technol.,2014,48(16):9563-9572.
[9]Yang F X,Ding J J,Huang W,Xie W,Liu W P.Environ.Sci.Technol.,2014,48(1):63-70.
[10]Hoffman K,Daniels J L,Stapleton H M.Environ.Int.,2014,63:169-172.
[11]van den Eede N,Neels H,Jorens P G,Covaci A.J.Chromatogr.A,2013,1303:48-53.
[12]Reemtsma T,Lingott J,Roegler S.Sci.TotalEnviron.,2011,409(10):1990-1993.
[13]Schindler B K,Foerster K,Angerer J.J.Chromatogr.B,2009,877(4):375-381.
[14]Cequier E,Marce R M,Becher G,Thomsen C.Anal.Chim.Acta,2014,845:98-104.
[15]Cooper E M,Covaci A,van Nuijs A L,Webster T F,Stapleton H M.Anal.Bioanal.Chem.,2011,401(7):2123-2132.
Determination of Five Organophosphate Ester Metabolites in Surface Water Samples by LC-MS/MS
LI Chuang-xiu1,ZHAO Xiao-li2,GAO Li-hong3,SHI Ya-li3,TAN Wei-qiang1*,CAI Ya-qi3*
(1.School of Environmental and Municipal Engineering,Qingdao Technological University,Qingdao266033,China;2.State Key Laboratory of Environmental Criteria and Risk Assessment,Chinese Research Academy of Environmental Sciences,Beijing100012,China;3.State Key Laboratory of Environmental Chemistry and Ecotoxicology,Research Center for Eco-environmental Sciences,Chinese Academy of Sciences,Beijing100085,China)
Abstract:A liquid chromatography-tandem mass spectrometric(LC-MS/MS) method was developed for the determination of five organophosphate ester metabolites in river water samples.The filtered water samples were enriched and purified by solid phase extraction(SPE) using a HLB cartridges,and then eluted with 6 mL methanol.The eluent was concentrated to a volume of 0.5 mL under gentle nitrogen stream and then diluted to 1 mL by initial mobile phase(50% methanol).Instrumental analysis was accomplished by HPLC-MS/MS under negative electrospray ion and multiple reaction monitoring(MRM) mode.Separation of the analytes was performed on a Luna Phenyl-Hexyl column,and a mixture of methanol and 50 mmol·L-1ammonium acetate solution was selected as mobile phase for gradient elution.The recoveries of five organophosphate ester metabolites in river samples were in the range of 57.8%-102% at a spiked concentration of 50 ng·L-1with relative standard deviations(RSD) of 2.8%-15.7%.At a spiked concentration of 10 ng·L-1,the recoveries were in the range of 54.1%-83.6% with RSDs of 5.3%-19.5%.The instrumental detection limits(IDL) ranged from 0.002 μg·L-1to 1.15 μg·L-1and the method detection limits(MDL) ranged from 0.15 ng·L-1to 4.48 ng·L-1.The matrix effect of river samples was also investigated in this study.The proposed method was successfully applied in the determination of organophosphate ester metabolites in lake water samples collected from Wuhan,Hubei.Except for DEHP,the other four OPEs metabolites were all detectable in lake water.The method showed good precision and accuracy,and was suitable for the analysis of five organophosphate ester metabolites in surface water samples.
Key words:organophosphate ester metabolites;liquid chromatography-tandem mass spectrometry(LC-MS/MS);river water;solid phase extraction
中图分类号:O657.63;TQ314.248
文献标识码:A
文章编号:1004-4957(2016)02-0194-06
doi:10.3969/j.issn.1004-4957.2016.02.010
*通讯作者:谭伟强,副教授,研究方向:有机合成与催化,Tel:0532-85071266,E-mail:tlong958@163.com
基金项目:国家高技术研究发展计划(863计划)(2013AA065201);国家自然科学基金项目(21477143,21321004)
收稿日期:2015-07-21;修回日期:2015-08-20
蔡亚岐,研究员,研究方向:环境化学,Tel:010-62849239,E-mail:caiyaqi@rcees.ac.cn
