海藻酸钠/CaCO3医用封闭剂凝胶化时间的调控
2016-03-24吴国华纪晓寰华艳萍
吴国华, 张 恒, 纪晓寰, 华艳萍, 孙 宾, 王 炜, 邢 程
(1. 东华大学 a. 纤维材料改性国家重点实验室; b. 材料科学与工程学院; c. 化学化工与生物工程学院;
d. 生态纺织教育部重点实验室, 上海 201620; 2. 苏州安德佳生物科技有限公司, 江苏 苏州 215123)
海藻酸钠/CaCO3医用封闭剂凝胶化时间的调控
吴国华1a, 1c, 张 恒2, 纪晓寰1a, 1b, 华艳萍1a, 1b, 孙 宾1a, 1b, 王 炜1c, 1d, 邢 程2
(1. 东华大学 a. 纤维材料改性国家重点实验室; b. 材料科学与工程学院; c. 化学化工与生物工程学院;
d. 生态纺织教育部重点实验室, 上海 201620; 2. 苏州安德佳生物科技有限公司, 江苏 苏州 215123)
采用4种典型碳酸钙(微米碳酸钙、纳米碳酸钙、轻质碳酸钙和重质碳酸钙),分别与葡萄糖酸内酯(GDL)组成钙离子释放体系,使海藻酸钠水溶液可控凝胶化,研究了碳酸钙与海藻酸钠羧酸根的摩尔比(f)、GDL与碳酸钙的摩尔比(n)和海藻酸钠质量分数(c)对海藻酸钠水凝胶的凝胶化时间及力学性能的影响.研究结果表明:在温度为37 ℃,f值为0.8、n值为1.4、c值为2.0%时,轻质碳酸钙体系的凝胶化时间为2.5 min,且形成凝胶的抗压强度为0.145 MPa,因而该凝胶具备一定的力学性能,可作为医用封闭剂的基体.
海藻酸钠; 碳酸钙; 凝胶化时间; 力学性能; 医用封闭剂
缝线止血会导致手术中的血流失量增多和缝合时间延长,而医用封闭剂的使用不仅可以有效减少手术中的血流失量,而且其较快的固化速度给手术带来了方便[1].理想的止血封闭剂必须满足以下条件:与组织相容性好,能被机体代谢或生物降解,无异物残留;有一定的黏性和流动性,能暂时黏接或阻止吻合口两端缘的分离;能迅速润湿和填充吻合口的裂隙;常温下,能迅速成膜、固化,形成不溶于水的膜状物,从而有效阻隔、降低胶体毒性[2-3].
目前的医用止血封闭剂有纤维蛋白胶[4]、α- 氰基丙烯酸酯类[5]、明胶[6-7]、壳聚糖[8],以及使用得较多的海藻酸盐凝胶类[9-13].虽然这些封闭剂已经得到广泛的应用,但都存在一些问题.如纤维蛋白胶容易被肺组织吸收,无法实现长久的肺漏气封闭,而且纤维蛋白胶医用密封剂与肺组织结合过于强烈,导致肺的活动受限制[4];α- 氰基丙烯酸酯类作为医用黏合剂具有独特的优点,但是其对生物组织有异反应、与组织黏结不牢固也易使组织老化[14];明胶使用甲醛和戊二醛为交联剂,毒性较大,难以在手术中使用;壳聚糖成膜需要用冰醋酸,冰醋酸对机体有很强的刺激性和毒性[8].而由海藻酸钠(SA)制备的封闭剂优点突出,SA是来自海藻的天然高分子,少量CaCl2对生物体的影响也不大[10-11],故该类封闭剂的生物相容性好;SA有很好的水溶性,其溶液有一定的流动性和黏性,与CaCl2溶液混合后即能凝胶化,制备方法简单且使用简便;凝胶化形成的膜不溶于水,在水中浸泡24 h后,膜仍能保存完好,故有较好的封闭性.但这类封闭剂的缺点是SA溶液与CaCl2反应速率较快,导致形成的凝胶不均匀,影响其封闭性能,从而提高了对手术操作的要求.采用CaCO3/葡萄糖酸内酯(GDL)作为复合离子交联体系制备海藻酸盐水凝胶,通过GDL水解缓慢释放H+,使Ca2+缓慢释放出来与海藻酸钠分子交联形成结构均一的水凝胶,可避免海藻酸钙快速反应而造成的凝胶结构不均匀性[15].文献[15]选用平均粒径为20 μm 的CaCO3做钙源,凝胶化时间大于8 min.
较短的凝胶化时间有利于临床手术,为此,本文选用4种典型的CaCO3,即微米碳酸钙、纳米碳酸钙、轻质碳酸钙和重质碳酸钙,分别与GDL结合作为钙离子缓释体系,研究CaCO3与海藻酸钠羧酸根的摩尔比(f)、GDL与CaCO3的摩尔比(n)和海藻酸钠的质量分数(c)对海藻酸盐水凝胶的凝胶化时间及力学性能的影响,以达到调控凝胶化时间的目的,为海藻酸钠水凝胶的制备奠定基础.
1 试 验
1.1 原料
海藻酸钠,黏度(10 g/L, 20 ℃)≥0.02 Pa·s,分析纯,国药集团化学试剂有限公司;微米碳酸钙,分析纯,国药集团化学试剂有限公司;纳米碳酸钙,分析纯,上海跃江钛白化工制品有限公司;轻质碳酸钙,分析纯,上海跃江钛白化工制品有限公司;重质碳酸钙,分析纯,上海聚千化工有限公司;GDL,分析纯,梯希爱(上海)化成工业发展有限公司.
1.2 海藻酸盐水凝胶的制备
海藻酸盐水凝胶的制备过程如图1所示.将一定质量的CaCO3微粒加入海藻酸钠溶液中,超声分散均匀后,往其中加入GDL,迅速搅拌混合均匀后将混合液倒入24孔细胞培养板(孔直径d=2 cm)中,混合溶液经一定时间后形成凝胶.
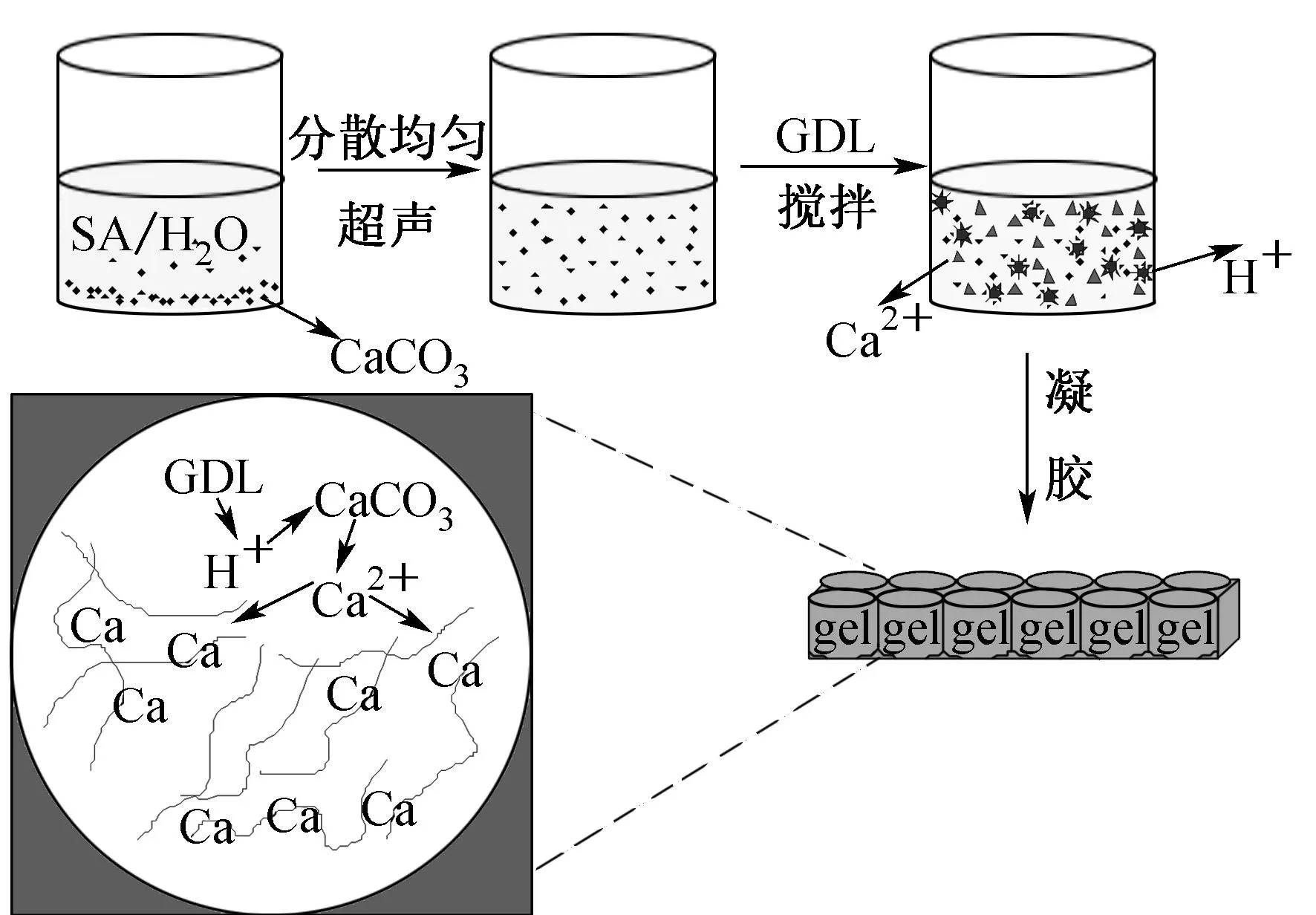
图1 海藻酸盐水凝胶制备过程示意图Fig.1 Schematic illustration of the preparation process of alginate hydrogel
1.3 凝胶的结构与性能测试
1.3.1 海藻酸钠溶液黏度
用美国BROOKFIELD公司生产的R/S-Plus型计算机控制黏度仪测试不同含量的海藻酸钠溶液的表观黏度(动力黏度),采用高黏度的短套筒,温度为37 ℃.设定程序:第一阶段(前100 s),剪切速率从0 s-1升至800 s-1;第二阶段(后100 s),剪切速率保持800 s-1.
1.3.2 凝胶化时间
采用试管倾斜法在37 ℃(水浴)下测定样品的凝胶化时间.每隔30 s倾斜盛装有10 mL凝胶样品的试管,直至样品停止流动,记录所需时间.
组成。装置内部无扎线,使用WB500总线背板。351F采用现场总线CAN网技术,与主控单元的通信采用深圳所的《ISA300基于CAN网保护测控通信规约》V3.01;接地变及站用变 351F软件信息均为:ISA-351F-FG-11C-V1.54-20041118。
1.3.3 CaCO3颗粒的形貌尺寸及其在海藻酸钠复合膜中的分散性
将4种CaCO3分别超声分散在去离子水中,然后滴加到铝箔纸上并烘干,用日本JSM-5600 LV型扫描电子显微镜(SEM)拍摄CaCO3颗粒形态.
分别将0.2 g微米碳酸钙、纳米碳酸钙、轻质碳酸钙和重质碳酸钙添加至50 g质量分数为2%的海藻酸钠溶液中,搅拌均匀,超声分散1 h后,将混合液分别放入表面积相同的培养皿中,置于60 ℃烘箱中烘干成膜.用Nikon公司生产的ALPHAPHOT-2 YS2型双目生物显微镜放大100倍拍照片,对共混膜的表面进行表征.
1.3.4 凝胶力学性能
将凝胶化24 h后得到的凝胶样品,用长春科新实验仪器公司生产的20KNWDW 3020型万能材料试验机测试样品的抗压强度.加载速度为2 mm/min, 每组样品平行测定5次,取平均值.
2 试验结果与讨论
2.1 海藻酸钠溶液流变性
海藻酸钠的质量分数是决定其凝胶化能力和溶液流动性的关键因素.在稀溶液下,海藻酸钠分子链处于分离状态,难以凝胶化;而溶液浓度过高,其流动性变差,会给后续操作,包括与其他试剂的混合和手术操作带来不便和困难.为此,本文首先研究了海藻酸钠溶液黏度随其质量分数的变化,进而得到其临界质量分数,为凝胶化调控提供基础.
温度精确控制在37 ℃,测定不同质量分数(0.1%, 0.2%, 0.5%, 0.8%, 1.0%, 1.5%, 2.0%, 2.5%, 3.0%, 4.0%, 5.0%)的海藻酸钠溶液的表观黏度随剪切速率的变化,结果如图2所示. 由图2可知,海藻酸钠溶液的表观黏度对其质量分数具有依赖性,即海藻酸钠溶液的黏度随质量分数的升高而增大.这是由于海藻酸钠大分子间相互接触,彼此间链段缠结,分子间范德华力以及氢键作用等导致海藻酸钠溶液黏度增大.
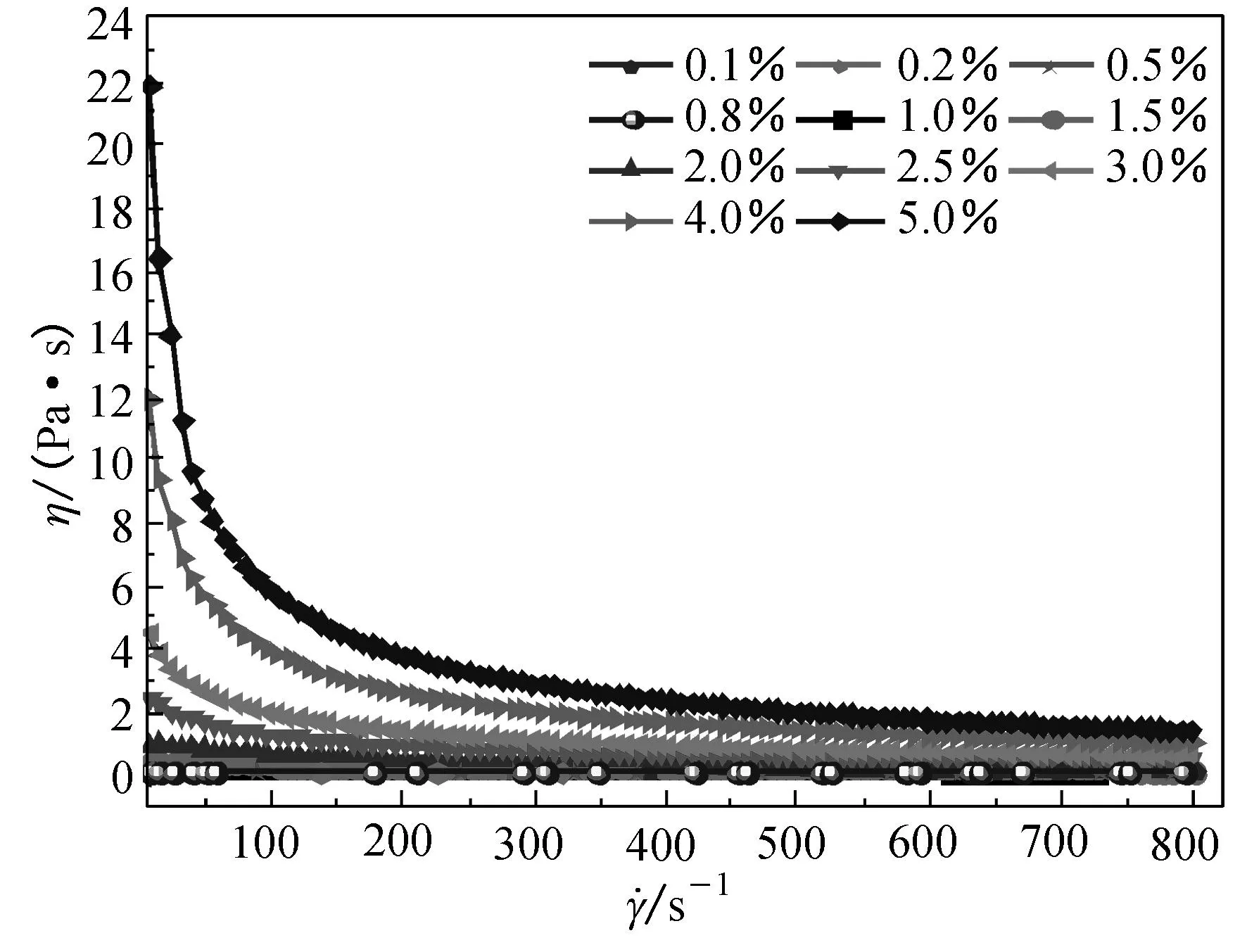
图2 不同质量分数海藻酸钠溶液的表观黏度曲线Fig.2 Curves of apparent viscosity of sodium alginate solution with different mass fractions
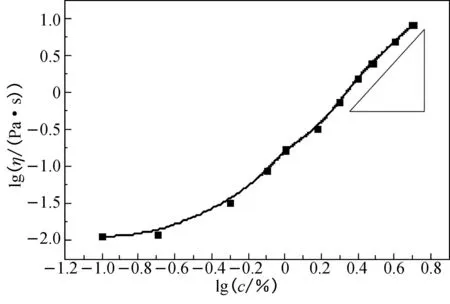
图3 海藻酸钠溶液的黏度与海藻酸钠质量分数的对数关系
Fig.3 The logarithmic relationship between the viscosity of the sodium alginate solution and the mass fraction of sodium alginate
由图3可知,当海藻酸钠质量分数较小时,lgη-lgc呈现曲线变化关系;当质量分数增加到某一值时,lgη-lgc呈现线性关系,这时聚合物开始相互穿插交叠,该质量分数称为临界质量分数c*.低于临界质量分数c*时,海藻酸钠分子在溶液中是分离的,表现出低黏度;而当高于临界质量分数c*时,海藻酸钠大分子互现穿插,分子之间范德华力以及氢键作用等导致海藻酸钠溶液黏度急剧增大[16-17].对图3中较高质量分数时的lgη-lgc进行线性拟合,质量分数为1.5%(lg 1.5=0.18)时其相关系数R2仅为0.9849,而质量分数为2.0%(lg 2.0=0.30)时的相关系数R2达0.9939,说明质量分数大于2.0%时lgη-lgc呈现线性关系,所以选定海藻酸钠的临界质量分数c*为2.0%.在临界质量分数下海藻酸钠溶液的流动性适当,且分子链间已存在一定的相互作用,易于形成一定强度的凝胶,故本文在海藻酸钠质量分数为2.0%条件下进行后续的凝胶化时间调控.
2.2 CaCO3的形貌尺寸及其在海藻酸钠基体中的分散性
CaCO3的形貌尺寸、密度及其在海藻酸钠基体中的分布状态,影响其与GDL反应释放Ca2+的速度,从而影响凝胶化时间和凝胶的性能.本文采用扫描电子显微镜对4种CaCO3进行了观察,结果如图4所示.由图4可见,微米碳酸钙(图4(a))和纳米碳酸钙(图4(b))颗粒平均粒径分别约为20 和1 μm.其中,纳米碳酸钙呈团聚体粒子形貌,团聚后颗粒属于微米级粒子,每个颗粒都是由很多初级粒子团聚而成,团聚后颗粒不够规则.轻质碳酸钙(图4(c))及重质碳酸钙(图4(d))颗粒平均粒径分别为2 和5 μm左右,前者由化学反应制得,颗粒基本呈棒球状,后者由机械粉碎方法制得,颗粒形状不规则.

(a) 微米碳酸钙

(b) 纳米碳酸钙

(c) 轻质碳酸钙

(d) 重质碳酸钙
由4种CaCO3与海藻酸钠的复合溶液分别制备共混膜,通过双目生物显微镜放大100倍拍照片观察CaCO3微粒在膜表面的分布,结果如图5所示.

(a) 微米碳酸钙

(b) 纳米碳酸钙

(c) 轻质碳酸钙

(d) 重质碳酸钙
由图5可见,4种CaCO3均呈现出形貌明显可分辨的颗粒,其中,重质、轻质和纳米碳酸钙基本未见较大的颗粒团聚体,分布状况均较微米碳酸钙好.这表明除微米碳酸钙因颗粒较大在溶液复合制样时较难混合均匀外,其他3种碳酸钙原料与海藻酸钠基体均有着较好的相容性.
2.3 凝胶化时间
以上述CaCO3微粒与GDL反应释放的Ca2+制备水凝胶,研究CaCO3与海藻酸钠中羧酸根的摩尔比(f)、GDL和CaCO3的摩尔比(n)和海藻酸钠质量分数(c)对凝胶化时间的影响,结果如图6所示.

(a) c=2.0%, n=1.4
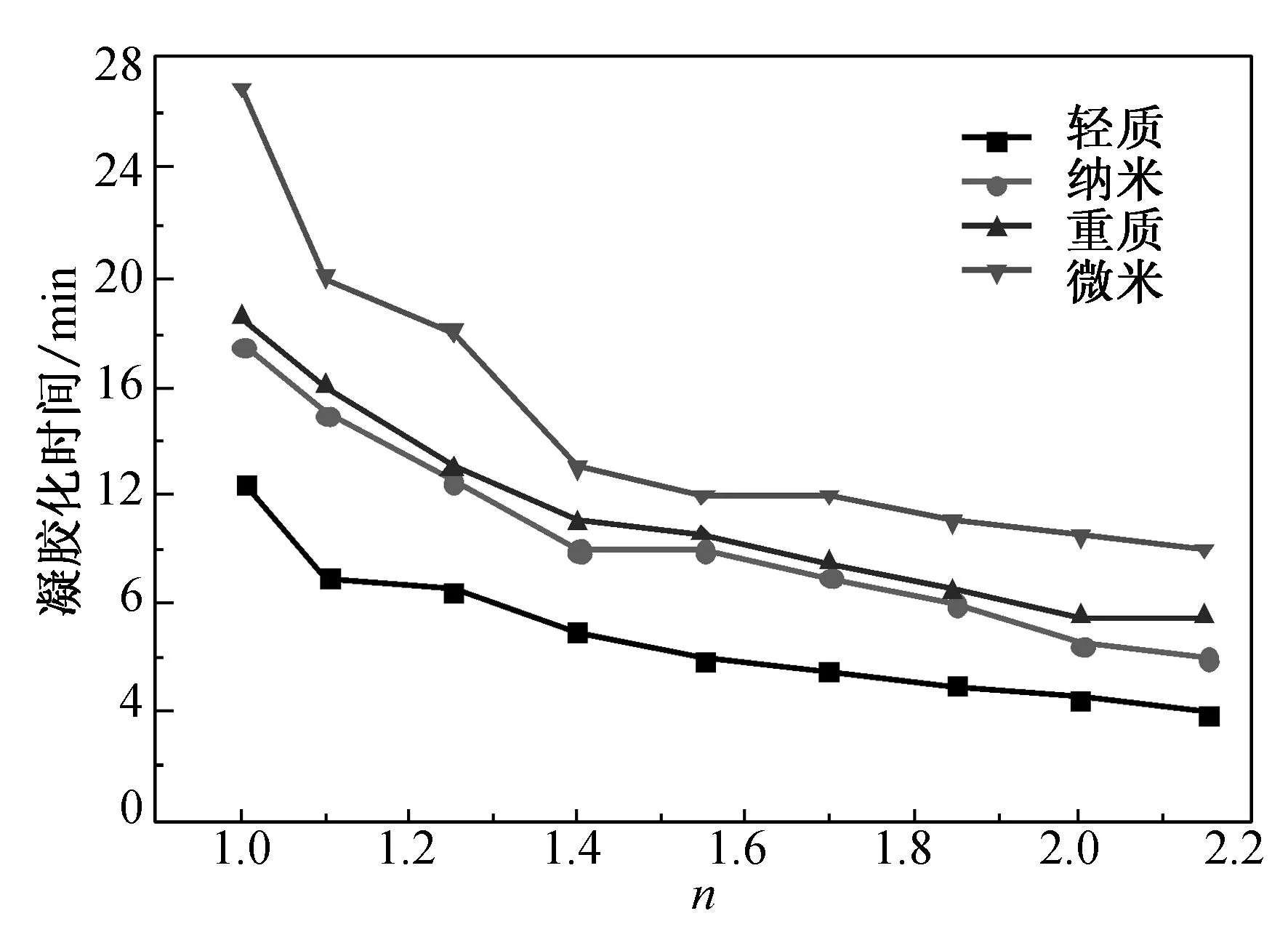
(b) c=2.0%, f=0.5
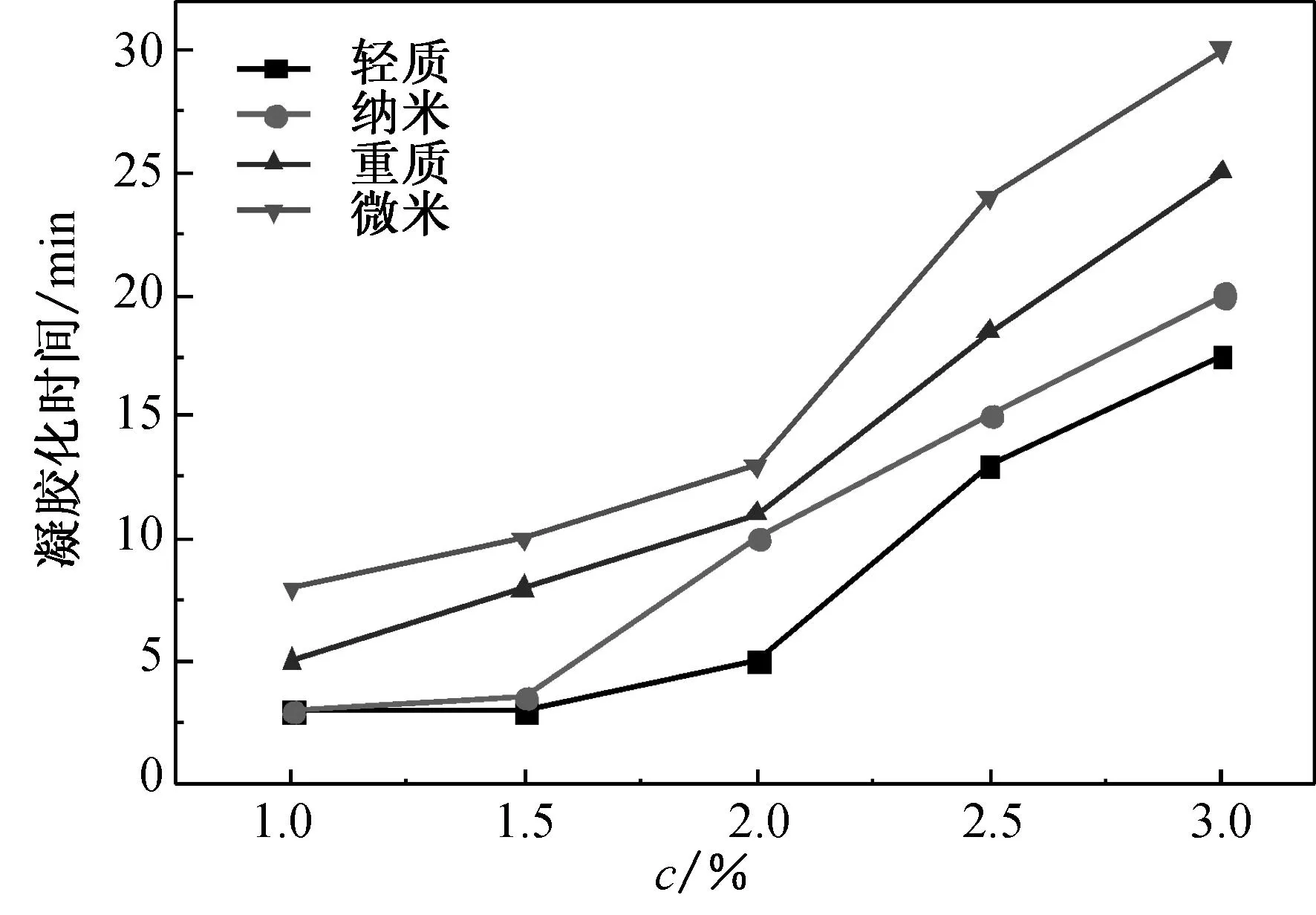
(c) n=1.4, f=0.5
Fig.6 The gelation time of alginate hydrogels
由图6可见,海藻酸钠水凝胶的凝胶化时间随着f值和n值的增大而减小,随着c值的增大而增大.这是由于f值的增大使得体系单位体积中有更多的Ca2+与海藻酸钠的羧酸盐结合,使凝胶化过程变得容易,凝胶化时间缩短;n值的增大使单位时间内有更多的Ca2+从CaCO3微粒中释放出,使得海藻酸钠分子链与Ca2+的螯合作用更加容易,同样使凝胶化时间缩短.而随着海藻酸钠质量分数逐渐增大,单位羧酸钠可结合的Ca2+量逐渐减小,使得凝胶化时间延长. 在相同条件下,不同CaCO3制备的水凝胶凝胶化时间由短到长依次为:轻质碳酸钙<纳米碳酸钙<重质碳酸钙<微米碳酸钙,其中轻质碳酸钙作为钙离子源的复合体系具有最短的凝胶化时间. 由图6(a)可知,在f值为0.8、n值为1.4、c值为2.0%时,轻质碳酸钙体系的凝胶化时间仅为2.5 min,而纳米碳酸钙体系和重质碳酸钙体系分别为4.0和4.5 min,微米碳酸钙则达9.5 min.试验结果表明CaCO3密度的影响更为关键.轻质碳酸钙为化学反应制得,具有更大的沉降体积且密度小[19],分子堆砌较为松散,H+与CaCO3颗粒沿径向的反应速率更快,在单位时间内释放出的Ca2+可能比纳米碳酸钙更多,故尽管其颗粒尺寸比纳米碳酸钙大,但凝胶化时间更短.
2.4 凝胶的力学强度
海藻酸钠水凝胶的抗压强度随CaCO3与羧基的摩尔比f值、GDL与CaCO3的摩尔比n值和海藻酸钠质量分数c的变化规律如图7所示.
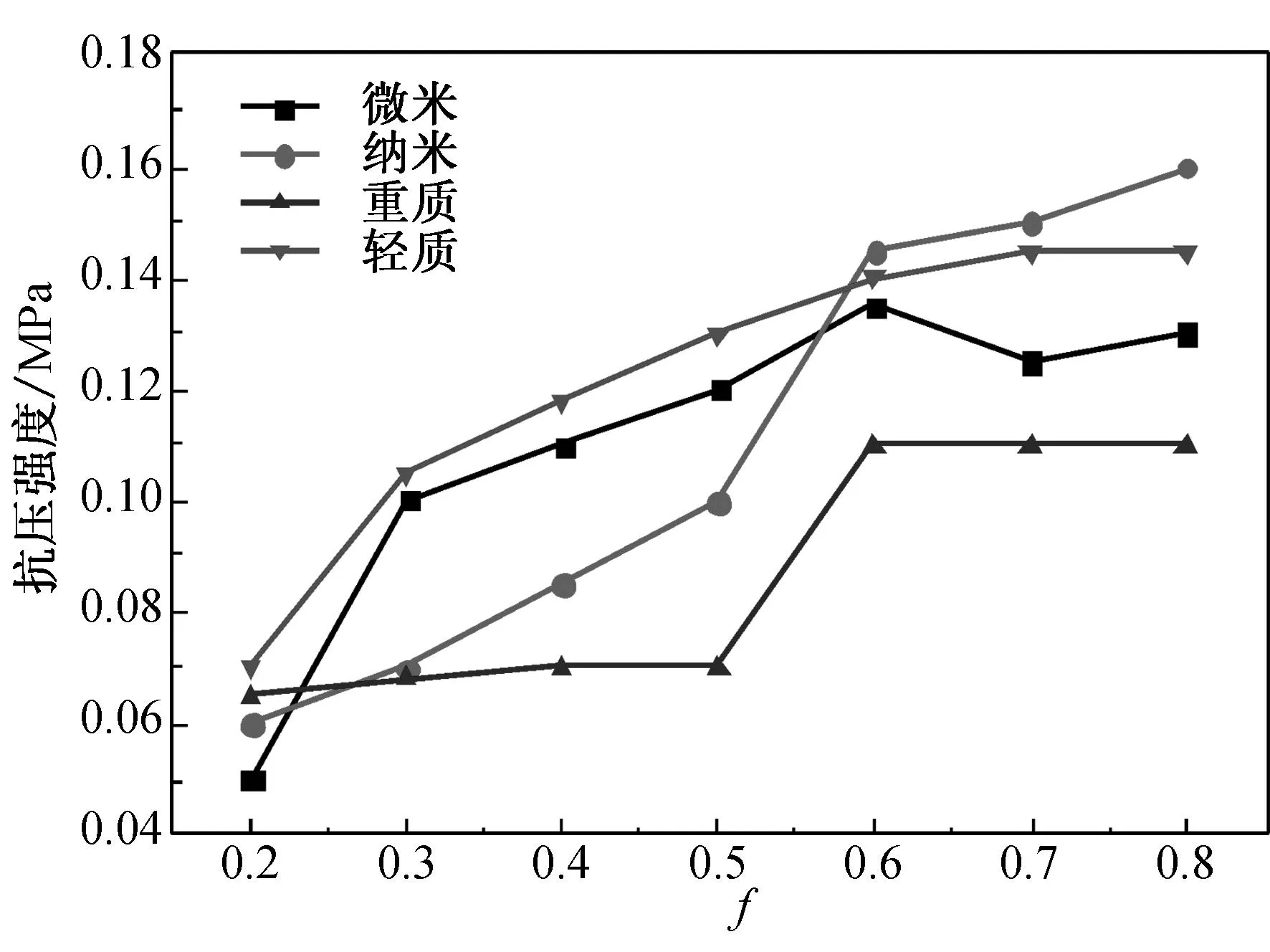
(a) c=2.0%, n=1.4

(b) c=2.0%, f=0.5
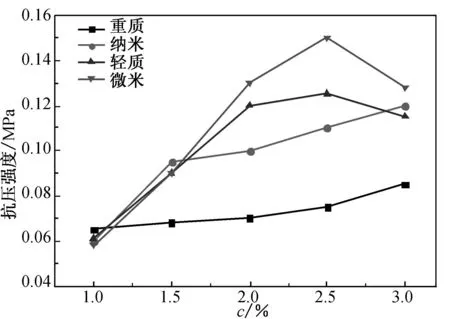
(c) n=1.4, f=0.5
Fig.7 The compressive strength of alginate hydrogels
由图7可见,同一钙源制备的海藻酸钠水凝胶的抗压强度随f值、n值和c值的增大而增大,但当f值大于0.4、n值大于1.4 和c值超过2.0%时,抗压强度增大的趋势均明显减小.f值的增大使得体系中有更多的Ca2+与海藻酸钠分子结合,使水凝胶的凝胶化过程变得更加容易,而Ca2+含量的增大相当于交联点增多[20],使凝胶网络更加致密,从而提高凝胶力学性能.n值的增大使得更多的CaCO3释放出Ca2+,使得海藻酸钠分子链与Ca2+的螯合作用更加容易,同样使得凝胶网络填充更加紧密,导致水凝胶体系的强度增加.海藻酸钠质量分数的增大使得海藻酸钠大分子之间的间距减小,海藻酸钠分子链与Ca2+的螯合更加容易,同样使得凝胶的力学性能提高.当n、f和c分别增大到一定值后,由于Ca2+与海藻酸钠分子的凝胶化比较充分,故水凝胶力学性能增大的趋势明显减小.由图7(a)可知,在f值为0.8、n值为1.4、c值为2.0%时,用纳米碳酸钙和轻质碳酸钙分别制备的水凝胶的抗压强度分别为0.160 MPa(50.24 N)和0.145 MPa(45.53 N),优于以微米碳酸钙为钙源制备的水凝胶强度(0.125 MPa, 39.25 N)和文献[15]报道的水凝胶强度(24 N).
3 结 语
因微粒形貌尺寸和密度的差异,不同CaCO3微粒与GDL组成的Ca2+释放体系,其海藻酸钠水凝胶的凝胶化时间由短到长依次为轻质碳酸钙<纳米碳酸钙<重质碳酸钙<微米碳酸钙.在CaCO3与海藻酸钠中羧酸根的摩尔比f值为0.8、 GDL与CaCO3的摩尔比n值为1.4、海藻酸钠质量分数c值为2.0%时,轻质碳酸钙体系可形成较好力学性能的水凝胶,在37 ℃ 时其凝胶化时间为2.5 min,该凝胶可作为医用封闭剂的基体.其与生物组织黏附能力和体内吸收周期调控的研究,将见于后续的报道.
[1] MILNE A A, MURPHY W G, READING S J, et al. Fibrin sealant reduces suture line bleeding during carotid endarterectomy: A randomised trial[J]. European Journal of Vascular and Endovascular Surgery, 1995, 10(1):91-94.
[2] 吴金术,曾仑.创面封闭型医用胶在肝胆胰手术中的应用技术[M].北京:科学文献出版社,2005:4-7.
[3] 张飞,孟兴凯,雷艳秋,等.医用α- 氰基丙烯酸酯的研究进展[J].内蒙古医学院学报,2008,30(1):118-121.
[4] FABIAN T, FEDERICO J A, PONN R B. Fibrin glue in pulmonary resection: A prospective, randomized, blinded study[J]. The Annals of Thoracic Surgery, 2003,75(5):1587-1592.
[5] 王克钦,徐阵,李德臣,等.新型医用黏合剂CAE-4 型医用胶的研制[J].沈阳化工学院学报,1986(1):125-130.
[6] 王林.明胶-硅氧烷骨组织工程支架材料研究[D].厦门:厦门大学生物工程学院,2009.
[7] 石朝晖.明胶的功能化改良及在磷酸催化下的低分子蛋白降解实验[D].济南:山东大学化学工程学院,2010.
[8] 张峻.壳聚糖的药剂学应用[J].食品与药品,2005,7(8):29-32.
[9] KALYANI S, SMITHA B, SRIDHA S. Blend membranes of sodium alginate and hydroxyethylcellulose for pervaporation-based enrichment of t-butyl alcohol[J]. Carbohydrate Polymers, 2006, 64(3):425-432.
[10] YANG G, ZHANG L, PENG T. Effects of Ca2+bridge cross-linking on structure and pervaporation of cellulose/alginate blend membranes[J]. Journal of Membrane Science, 2000, 175(1):53-60.
[11] 范恒华,伍骥,张伯勋,等.血管黏接吻合密封胶(剂)的实验研究[J].医疗卫生装备,2009,30(10):1-4.
[12] 石锐.热塑性淀粉材料的改性及生物医用探索[D].北京:北京化工大学材料科学与工程学院,2008.
[13] 曹祥薇.明胶/多糖类胶体复配胶的凝胶特性及应用[D].武汉:湖北工业大学材料科学与工程学院,2011.
[14] 夏毅然,徐永祥,刘文冰,等.医用黏合剂的研究及应用进展[J]. 化工新型材料,2003,31(4):9-12.
[15] 赵名艳,李立华,周长忍,等.可注射海藻酸钙水凝胶的制备研究[J].功能材料,2010,41(8):1353-1356.
[16] 于子森,孔庆山,纪全,等.海藻酸钠溶液黏度特性的研究[J].科技信息,2007(11):20-21.
[17] 刘让同,李亮.海藻酸钠溶液流变性的浓度依赖性[J].科学技术与工程,2013,13(21):6317-6322.
[18] 郑洪河,张虎成,夏志清.海藻酸钠溶液的黏度性质与流变学特征[J].河南师范大学学报(自然科学版),1997,25(2):51-55.
[19] 乔晓辉,陈国南.轻质碳酸钙检测方法的探讨[J].广州化工,2011(3):128-129.
[20] LEOR S, TUVIA V. Intracoronary injection of in situ forming alginate hydrogel reverses left ventricular remodeling after myocardial infarction in swine[J]. Journal of the American College of Cardiology, 2009, 54(11):1014-1023.
Tuning Gelation Time of Sodium Alginate/CaCO3Base Hydrogel for Using as Medical Sealants
WUGuo-hua1a, 1c,ZHANGHeng2,JIXiao-huan1a, 1b,HUAYan-ping1a, 1b,SUNBin1a, 1b,WANGWei1c, 1d,XINGCheng2
(a. State Key Laboratory for Modification of Chemical Fibers and Polymer Materials; b. College of Materials Science and Engineering; c. College of Chemistry, Chemical Engineering and Biotechnology; d. Key Laboratory of Science & Technology of Eco-textile, Ministry of Education, 1. Donghua University, Shanghai 201620, China; 2. EndoClot Plus Suzhou Co.Ltd., Suzhou 215123, China)
Calcium carbonate (CaCO3) and gluconolactone (GDL) were composed together as calcium ion slow-release system. Four typical kinds of CaCO3(micron-CaCO3, nano-CaCO3, light CaCO3and ground CaCO3) were used as calcium source for making the gelation of sodium alginate controllable. The effects of different parameters (including the molar ratio of CaCO3and carboxyl group (f), the molar ratio of GDL and CaCO3(n), the mass fraction of sodium alginate solution (c)) on hydrogels’ gelation time and mechanical properties were studied. The results show that the gelation time of light CaCO3system is about 2.5 min under the condition of 37 ℃,fvalued 0.8,nvalued 1.4 andcvalued 2.0%, the compressive strength of the hydrogels is 0.145 MPa, they also have certain mechanical properties and can be used as the substrate of the medical sealants.
sodium alginate; calcium carbonate; gelation time; mechanical properties; medical sealants
1671-0444(2016)01-0067-06
2014-10-31
吴国华(1989—), 男,江西景德镇人,硕士研究生,研究方向为多糖功能材料的研制和应用开发.E-mail:wugh1005roy@163.com
张 恒(联系人),男,工程师,E-mail:zhangheng2009@gmail.com
R 318.08
A
