尿毒症腹膜透析患者血清高敏C反应蛋白、白蛋白、前白蛋白、转铁蛋白水平变化
2016-03-23马亚丽时军陈宝平陈芳河南大学淮河医院河南开封475000
马亚丽,时军,陈宝平,陈芳(河南大学淮河医院,河南开封 475000)
尿毒症腹膜透析患者血清高敏C反应蛋白、白蛋白、前白蛋白、转铁蛋白水平变化
马亚丽,时军,陈宝平,陈芳(河南大学淮河医院,河南开封 475000)
摘要:目的观察尿毒症腹膜透析患者血清高敏C反应蛋白(hs-CRP)、白蛋白、前白蛋白、转铁蛋白水平变化,并探讨其意义。方法 尿毒症腹膜透析患者41例(观察组),同期健康查体者37例(对照组),采用ELISA法检测两组血清hs-CRP,全自动生化分析仪检测血清白蛋白、前白蛋白、转铁蛋白,Pearson相关分析法分析观察组各指标的相关性。结果观察组血清hs-CRP、白蛋白、前白蛋白、转铁蛋白水平分别为(6.10±1.40)mg/L、(30.31±6.81)g/L、(0.27±0.12)g/L、(1.76±0.51)g/L,对照组分别为(2.22±0.71)mg/L、(41.2±4.6)g/L、(0.31±0.08)g/L、(2.82±0.36)g/L,两组比较,P均<0.05。观察组患者血清hs-CRP水平与血清白蛋白、前白蛋白、转铁蛋白水平呈负相关(r分别为-0.70、-0.55、-0.39,P均<0.05)。结论 尿毒症腹膜透析患者血清hs-CRP水平升高,血清白蛋白、前白蛋白、转铁蛋白水平降低。尿毒症腹膜透析患者存在明显的微炎症状态,可能与患者营养状况较差有关。
关键词:尿毒症;腹膜透析;高敏C反应蛋白;白蛋白;前白蛋白;转铁蛋白
近年来,随着糖尿病、高血压患病率的逐年增高,以及药物滥用导致肾功能不全患者的增多,腹膜透析在终末期肾病患者治疗中的应用越来越广泛[1,2]。腹膜透析患者往往存在营养不良[3,4],进而增加感染风险[5,6]。研究[2,7]显示,终末期肾病患者血清炎症因子水平升高,其通过抑制肝脏白蛋白mRNA的表达,减少白蛋白合成,加强白蛋白分解,导致低蛋白血症的发生。本研究观察了尿毒症腹膜透析患者血清高敏C反应蛋白(hs-CRP)、白蛋白、前白蛋白、转铁蛋白水平变化,并探讨患者血清微炎症状态与营养状况的关系,为提高腹膜透析患者营养水平、降低感染风险提供思路和依据。
1资料与方法
1.1临床资料尿毒症腹膜透析患者41例(观察组),男24例,女17例;年龄(43.3±8.1)岁。基础病变为糖尿病肾病10例,高血压肾病8例,慢性肾盂肾炎5例,间质肾病3例,慢性肾小球肾炎11例,其他4例。另选同期健康体检者37例(对照组),男21例,女16例;年龄(41.9±12.1)岁;均无肾病及与肾病相关的病史。
1.2血清hs-CRP、白蛋白、前白蛋白、转铁蛋白检测抽取受试者清晨空腹静脉血10 mL,以3 000 r/min离心10 min,离心后取上清液,并置入-80 ℃冰箱保存待测。采用ELISA法检测血清hs-CRP[8],全自动生化分析仪检测血清白蛋白、前白蛋白、转铁蛋白,所有操作均按试剂盒说明书进行。
2结果
两组血清hs-CRP、白蛋白、前白蛋白、转铁蛋白水平比较见表1。观察组患者血清hs-CRP水平与血清白蛋白、前白蛋白、转铁蛋白水平均呈负相关(r分别为-0.70、-0.55、-0.39,P均<0.05)。
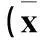
表1 两组血清hs-CRP、白蛋白、前白蛋白、转铁蛋白水平比较±s)
注:与对照组比较,*P<0.05。
3讨论
尿毒症不仅是机体针对肾功能进行性衰竭所产生的一系列复杂的细胞、生物化学反应,同时还是以细胞因子驱动为特征的全身慢性微炎症反应[9~11]。C反应蛋白是慢性炎症状态下细胞因子产生的标志,是慢性炎症状态敏感而特异的指标[12,13]。终末期肾病非透析患者、血液透析和腹膜透析患者均存在慢性炎症状态,微炎症状态的诱发因素包括非透析因素和透析本身因素[14~16]。
终末期肾病患者血清炎症因子升高,通过抑制肝脏白蛋白mRNA的表达[17],减少白蛋白合成,加强白蛋白分解,导致低蛋白血症的发生[18,19]。同时炎症因子可直接抑制胃肠系统的消化与吸收,影响患者食欲[20,21],导致亚临床型甲状腺机能减退和雄性激素的缺乏[22,23],而这些都能直接或间接促进蛋白能量的丢失,导致营养不良[24]、炎症复合综合征[25]。Cheng等[26]通过对连续性腹膜透析患者随访1 a,发现营养不良、炎症复合综合征与患者住院率有相关性。Eustace等[27]对参加美国第三届全国健康及营养检查调查的慢性肾病患者的相关资料进行分析,发现血清CRP水平与白蛋白水平呈负相关。本研究显示,观察组血清hs-CRP水平高于对照组,说明腹膜透析患者存在明显的微炎症状态,与既往报道[28]一致。本研究还发现,观察组患者血清hs-CRP水平与血清白蛋白、前白蛋白、转铁蛋白水平均呈负相关,说明患者微炎症反应越重,其营养状况越差。
参考文献:
[1] Witowski J, Kawka E, Rudolf A, et al. New developments in peritoneal fibroblast biology: implications for inflammation and fibrosis in peritoneal dialysis[J]. Biomed Res Int, 2015,2015:134708.
[2] Saxena AB. Recent advances in the management of peritoneal dialysis patients[J]. F1000prime reports, 2015,7:57.
[3] 谭艳,谢希.腹膜透析患者营养不良的原因分析及防治对策[J].海峡药学,2014,26(11):262-263.
[4] 彭耀尧.腹膜透析患者营养不良和蛋白质能量摄入不足的因素分析及临床研究[J].中国医药指南,2014,12(19):33-34.
[5] Qu ZS, Zhang QD, Li L. Impact of low-dose urokinase in peritoneal dialysis on serum oxidative stress, nitric oxide and endothelin in cerebral infarction complicated with uremia[J]. Int J Clin Exp Med, 2015,8(1):1333-1341.
[6] Honda K, Hamada C, Nakayama M, et al. Impact of uremia, diabetes, and peritoneal dialysis itself on the pathogenesis of peritoneal sclerosis: a quantitative study of peritoneal membrane morphology[J]. Clin J Am Soc Nephrol, 2008,3(3):720-728.
[7] 任克军,王青,胡顺金,等.微炎症状态对腹膜透析患者营养状况的影响[J].实用医学杂志,2015,31(3):427-429.
[8] 杨剑.C反应蛋白变化对尿毒症维持性血液透析患者贫血的影响[J].临床合理用药杂志,2014,7(12):108,110.
[9] Wang J, Liu S, Li H, et al. A review of rodent models of peritoneal dialysis and its complications[J]. Int Urol Nephrol, 2015,47(1):209-215.
[10] Meyer TW, Hostetter TH. Approaches to uremia[J]. J Am Soc Nephrol, 2014,25(10):2151-2158.
[11] Rhee EP, Thadhani R. New insights into uremia-induced alterations in metabolic pathways[J]. Curr Opin Nephrol Hypertens, 2011,20(6):593-598.
[12] Wanner C, Drechsler C, Krane V. C-reactive protein and uremia[J]. Semin Dial, 2009,22(4):438-441.
[13] 钟莉华,兰慧.尿毒症血液透析患者超敏C反应蛋白及铁参数联合检测的临床意义[J].国际检验医学杂志,2013,34(15):1973-1974.
[14] Campbell DJ, Johnson DW, Mudge DW, et al. Prevention of peritoneal dialysis-related infections[J]. Nephrol Dial Transplant, 2015,30(9):1461-172.
[15] 宋国巍,王磊.现有透析疗法对慢性肾衰竭尿毒症患者微炎症状态的影响[J].中国实验诊断学,2015,19(7):1199-1200.
[16] 李敏,张敏秋,程静,等.3种血液净化模式对尿毒症患者微炎症状态的影响[J].南昌大学学报(医学版),2015,55(4):48-50.
[17] Thornalley PJ, Rabbani N. Protein damage in diabetes and uremia-identifying hotspots of proteome damage where minimal modification is amplified to marked pathophysiological effect[J]. Free Radic Res, 2011,45(1):89-100.
[18] Friedman EA. Stressful ethical issues in uremia therapy[J]. Kidney Int Suppl, 2010,(117):S22-32.
[19] Glassock RJ. Uremia (end-stage renal disease): how cost-effective are preventive strategies[J]. J Ren Nutr, 2010,20(5 Suppl):131-134.
[20] 刘宁,黄雯.尿毒症胃肠动力和胃肠激素水平变化[J].医学综述,2007,13(11):853-855.
[21] 黄雯,张建忠,王雁,等.尿毒症患者胃肠运动功能障碍[J].基础医学与临床,2003,23(2):211-215.
[22] 张阳,杨自更,郭勇,等.尿毒症患者甲状腺激素检测的临床意义[J].放射免疫学杂志,2010,13(4):396-397.
[23] 王胜,林晓明,陈生晓.尿毒症患者甲状腺激素水平的研究[J].海南医学,2009(S3):191-192.
[24] 刘世华,任建伟.尿毒症患者血透充分性与营养不良的关系[J].航空航天医学杂志,2012,23(1):52-53.
[25] 郑法雷,刘燕萍.尿毒症性营养不良-炎症综合征与逆流行病学现象[J].中国血液净化,2005,4(6):291-294.
[26] Cheng TH, Lam DH, Ting SK, et al. Serial monitoring of nutritional status in Chinese peritoneal dialysis patients by subjective global assessment and comprehensive malnutrition inflammation score[J]. Nephrology(Carlton), 2009,14(2):143-147.
[27] Eustace JA, Astor B, Muntner PM, et al. Prevalence of acidosis and inflammation and their association with low serum albumin in chronic kidney disease[J]. Kidney Int, 2004,65(3):1031-1040.
[28] 关毅标,罗福漳,赵学峰.腹膜透析患者微炎症状态与患者营养状况的相关性研究[J].中国当代医药,2015,22(12):60-62.
(收稿日期:2015-09-10)
中图分类号:R459.5
文献标志码:B
文章编号:1002-266X(2016)03-0072-02
doi:10.3969/j.issn.1002-266X.2016.03.029
通信作者:陈芳(E-mail: gu5407yueshiwen8@yeah.net)
基金项目:河南省医学科技公关计划项目(2010003089)。
