荧光定量聚合酶链反应检测肺炎支原体方法的建立
2016-03-23郭东星胡文娟李静宜栗绍刚吴赵永田秀君辛德莉
郭东星,胡文娟,李 丹,李静宜,栗绍刚,吴赵永,田秀君,辛德莉
荧光定量聚合酶链反应检测肺炎支原体方法的建立
郭东星,胡文娟,李 丹,李静宜,栗绍刚,吴赵永,田秀君,辛德莉
[摘要]目的 建立检测肺炎支原体的荧光定量PCR法,并与市售试剂盒和传统巢式PCR法的检测性能进行比较。方法 设计针对肺炎支原体社区获得性肺炎呼吸窘迫综合征毒素基因的特异性引物,构建含相应目的片段的质粒作为标准品,采用SYBR Green染料法进行实时定量PCR,并绘制标准曲线。通过检测其他细菌和170例儿童临床咽拭子样本,比较新建荧光定量PCR法、市售试剂盒和传统巢式PCR法在临床应用中的差异。结果 新建荧光定量PCR法和巢式PCR法能够检出的肺炎支原体标准株DNA最低模板量为10拷贝,市售试剂盒检出最低模板量为102拷贝。在特异性实验中3种方法均可区分肺炎支原体和其他菌种。在检测的170例儿童临床咽试子样本中,新建荧光定量PCR法、市售试剂盒和传统巢式PCR法的阳性率分别为60.00%、50.00%和53.53%。新建荧光定量PCR法与市售试剂盒的结果具有高度相关性(r = 0.953),2种方法的总符合率为86%,Kappa值为0.729。新建荧光定量PCR法与传统巢式PCR法的结果总符合率为90%,Kappa值为0.797。结论 新建荧光定量PCR法与市售试剂盒相比灵敏性更高,特异性相同,成本低;与传统巢式PCR法相比操作简单,耗时短且污染少,具有良好的科研和临床应用前景。
[关键词]肺炎支原体;呼吸道感染;儿童;研究设计
[作者单位] 100050,首都医科大学附属北京友谊医院 北京热带医学研究所 热带病防治研究北京市重点实验室(郭东星、胡文娟、李丹、李静宜、栗绍刚、吴赵永、田秀君、辛德莉)
肺炎支原体是引起获得性呼吸道感染的重要病原体之一,占社区获得性肺炎 (community aquired pneunonia, CAP )病因的10% ~30%[1-2]。支原体肺炎暴发最常发生在相对封闭环境中,如学校、监狱和医院[3-4],对学龄期儿童和青少年危害尤其严重。肺炎支原体还可引起其他呼吸道疾病,如气管炎、支气管炎、咽炎和哮喘等[2]。另外,一些肺外表现,如皮肤病、造血系统、关节、中枢神经系统、肝脏、胰腺、肾脏等的损害及心血管综合征等也被认为是原发性肺炎支原体感染的后遗症[5-6]。
肺炎支原体感染潜伏期较长 (平均1 ~2周 ),致使根据临床症状出现之后才能进行临床诊断和相应治疗,因此从病原学方面及时准确地诊断肺炎支原体感染对临床治疗相关疾病具有重要意义。目前肺炎支原体感染的诊断方法主要有分离培养法、双份血清检测法和核酸检测法[7]。由于肺炎支原体生长缓慢,所需培养时间长 (一般需10 ~21 d )且阳性率低,不能快速诊断,无法在临床上推广使用[6];双份血清检测方法中,由于血清收集困难且耗时较长 (前后2份血清须间隔2 ~3周 ),无助于早期诊断;核酸扩增方法因快速、灵敏和特异性强而受到愈来愈多的关注。本研究建立了荧光定量PCR检测肺炎支原体核酸的方法,并将新建立的方法与市售试剂盒和传统的巢式PCR方法的检测性能进行了比较,以期能够找到一种快速、灵敏、准确且经济的适合广泛应用于临床检测肺炎支原体感染的方法。
1 对象与方法
1.1对象 研究对象为2014年就诊于民航总医院和北京儿童医院儿科门诊及住院的6月龄 ~14岁CAP患者,共170例,其中男87例,女83例,平均年龄 (5.0±2.9 )岁。采集患儿咽拭子标本,-80 ℃冻存备用。入组标准:具有发热、伴咳嗽或咽痛等呼吸道感染症状之一,病程为1 ~7 d的门诊和住院患者;白细胞总数 (5.0 ~12.0 )×109/L,中性粒细胞比例<70%;年龄6月龄 ~14岁;性别不限。排除标准:重症肺炎或出现多系统、多器官损害者;患严重肝脏、肾脏、心血管及造血系统疾病、免疫系统疾病及精神疾病的患儿。
1.2菌株 肺炎支原体标准株为本实验室保存FH菌株(ATCC 15531D) ;人型支原体(ATCC 15488)、阴沟肠杆菌(ATCC 700323)、金黄色葡萄球菌(ATCC 25922)、肺炎克雷伯临床分离株(ATCC 1705)和大肠埃希菌(ATCC 25922)均由首都医科大学附属北京友谊医院检验科惠赠。
1.3主要试剂仪器 通用型柱式基因组提取试剂盒、高纯度质粒提取试剂盒和微量琼脂糖凝胶DNA回收试剂盒均购自康为世纪生物科技有限公司;用于实时定量PCR的荧光染料Power SYBR Green PCR Master 2×Mix和ABI Prism@7500型荧光定量PCR仪均为美国Applied Biosystems公司产品;用于方法比较的市售肺炎支原体核酸检测试剂盒(荧光法) (以下简称市售试剂盒)购自上海复兴长征医学科学有限公司。
1.4实验方法
1.4.1原理 首先设计针对肺炎支原体社区获得性肺炎呼吸窘迫综合征 (community-acquired respiratory distress syndrome, CARDS)毒素基因的特异性引物,构建含相应目的片段的质粒作为标准品。然后采用SYBR Green染料法进行实时定量PCR,绘制标准曲线,结合反应荧光信号达到阈值时的PCR反应循环数 (cycle threshold, Ct )值,就可以确定待测样本含量;然后通过检测肺炎支原体标准株和其他细菌,比较新建立的检测CARDS基因的荧光实时定量PCR法 (以下简称新建荧光定量PCR法 )与市售试剂盒的灵敏性与特异性差异;通过检测170例儿童临床咽拭子样本,比较新建荧光定量PCR法、市售试剂盒和传统巢式PCR法在临床应用中的差异。
1.4.2引物设计 根据肺炎支原体CARDS毒素基因序列 (GenBank, accession No. DQ447750 )设计特异性引物SD-CARDS-F/SD-CARDS-R (表1 )。引物由美国Invitrogen公司合成,经HPLC方式纯化。
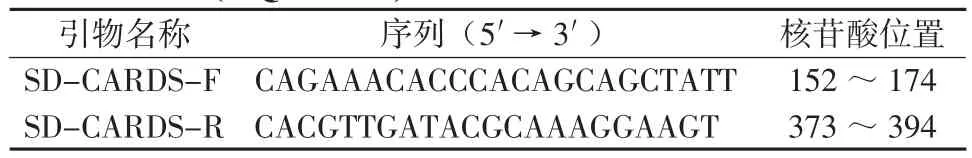
表1 检测样本所用引物序列及位置Table 1 Oligonucleotide sequences and their location on the CARDS (DQ447750)
1.4.3标准品构建 以FH标准株为模板,使用引物SD-CARDS-F/SD-CARDS-R扩增CARDS基因片段,扩增片段长度为243 bp。PCR反应体系:5×缓冲液10 μl,dNTP 混合液4 μl,10 μmol/L 的SD-CARDS-F/SD-CARDS-R引物各2 μl,FH DNA 5 μl,高保真酶0.25 μl,ddH2O 27 μl。反应条件:98 ℃变性2 min;98 ℃ 10 s,55 ℃ 10 s,72 ℃ 1 min,35 个循环;72 ℃延伸10 min。然后将PCR产物切胶回收并连入pMDl8-T载体中,进行转化、筛选阳性单克隆并进行测序鉴定。提取测序验证正确的克隆菌液的质粒,对质粒定量分析后进行10倍梯度稀释,以浓度为106、105、104、103、102、101copies/μl的质粒作为标准品。
1.4.4标准曲线绘制 将标准品作为模板进行荧光定量PCR反应。反应体系:2×SYBR Green缓冲液12.5 μl,10 μmol/L的SD-CARDS-F/SDCARDS-R引物各0.5 μl,DNA模板1.0 μl,ddH2O 10.5 μl,总体积25.0 μl。反应条件:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。采用ABI公司荧光定量PCR仪7500的SDS软件分析实验结果并绘制标准曲线。
1.5方法学验证
1.5.1灵敏性 采用试剂盒提取肺炎支原体标准株FH基因组DNA,测定浓度后进行梯度稀释,分别以107、106、105、104、103、102、101copies/μl作为验证灵敏性实验的待测样品。分别采用新建荧光定量PCR法、市售试剂盒和巢式PCR法对待测样品进行检测,比较3种方法的灵敏性。新建荧光定量PCR法检测待测样品的反应体系及反应条件与标准曲线绘制的反应体系及条件相同。根据市售试剂盒的产品说明书检测待测样品。参照文献报道的巢式PCR法合成相应引物,采用相同的反应条件及体系对待测样品进行检测[8],并根据测序结果判定阴性和阳性。
1.5.2特异性 采用通用型柱式基因组提取试剂盒提取大肠杆菌、阴沟肠杆菌、金黄色葡萄球菌、人型支原体、肺炎克雷白菌和肺炎支原体标准株FH的基因组DNA作为特异性实验的待测样本。分别采用新建荧光定量PCR法、市售试剂盒和巢式PCR法对待测样品进行检测,对巢式PCR产物进行测序分析,并比较3种方法的特异性。
1.5.3临床样本检测 采用通用型柱式基因组提取试剂盒提取收集的170份临床咽拭子样本DNA,分别采用3种方法对其进行检测并对结果进行比较。采用新建荧光定量PCR法检测临床样本的反应体系及反应条件与绘制标准曲线的反应体系及条件相同,根据样本扩增Ct值及熔解曲线熔解温度(melting temperature, Tm )值综合判定阴性和阳性,Ct值<38且 Tm值与标准品相同则判定为阳性。根据市售试剂盒说明书,临床样本Ct值<38即判定为阳性。巢式PCR法检测临床样本则须将PCR阳性产物进行测序后根据序列分析结果判定阴性和阳性。
1.6统计学处理 用SPSS 19.0软件进行统计分析。对新建荧光定量PCR法检测结果与市售试剂盒检测结果进行相关性分析;用新建荧光定量PCR结果分别与市售试剂盒和传统巢式PCR法检测结果建立配对设计2×2列联表,进行阳性符合率、阴性符合率、总符合率及Kappa一致性分析。P<0.05表示差异有统计学意义。
2 结 果
2.1标准曲线 用SD-CARDS-F/SD-CARDS-R引物扩增标准品,以标准品浓度的对数值为横坐标,相应的Ct值为纵坐标,得到相应标准曲线(图1)。标准曲线方程为:Y=-3.2556X+38.545,R2=0.999;模板量与Ct值具有良好的相关性,能够对模板进行定量。
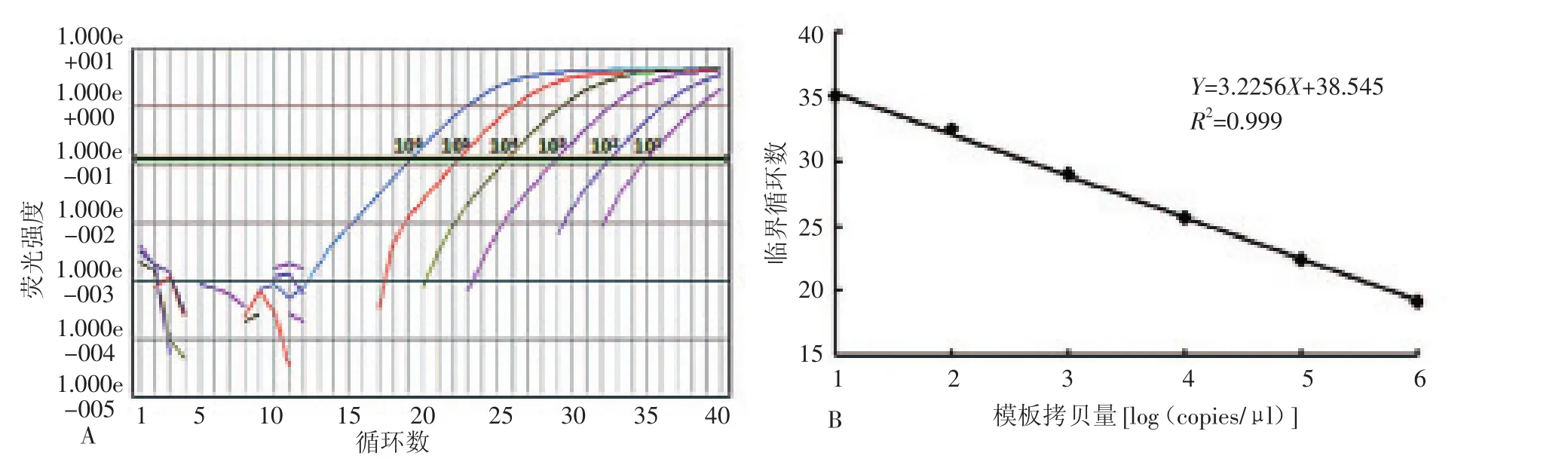
图1 新建荧光定量PCR标准品扩增曲线和标准曲线Figure 1 Amplification curves and standard curve of the real-time fluorescence quantitative PCR
2.2 方法学验证
2.2.1灵敏性 分别采用3种方法扩增梯度稀释后的标准株FH基因组DNA,并对其灵敏性进行比较。结果显示新建荧光定量PCR法和巢式PCR法在DNA模板量为10拷贝时仍能进行扩增,市售试剂盒的最低检出模板量为102拷贝 (表2 )。新建荧光定量PCR法的灵敏性与巢式PCR法相同,市售试剂盒灵敏性相对较低。
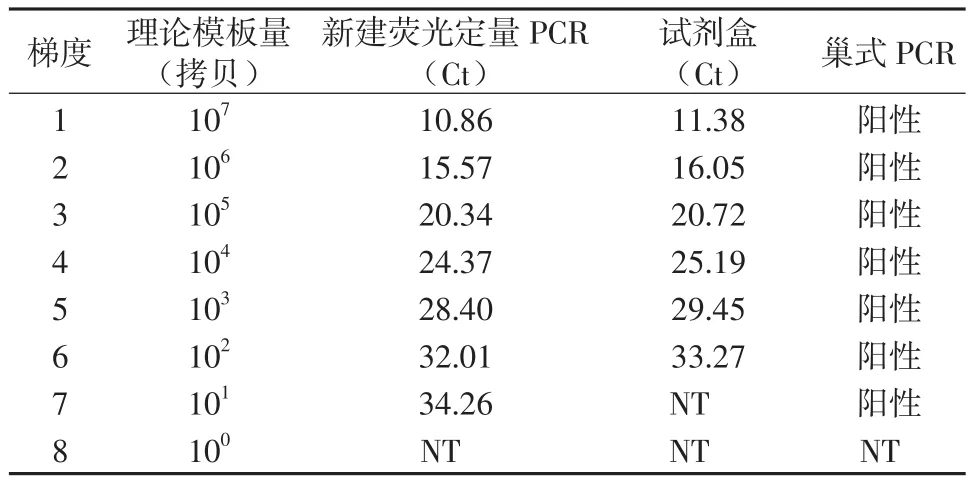
表2 3种检测方法灵敏性比较Table 2 Comparison of sensitivity among the three assay methods
2.2.2特异性 分别采用3种方法扩增大肠杆菌、阴沟肠杆菌、金黄色葡萄球菌、人型支原体、肺炎克雷白菌和肺炎支原体标准株FH的基因组DNA (每个反应重复3次 ),并对其特异性进行比较。结果显示除FH DNA外,新建荧光定量PCR法和市售试剂盒对上述其他菌种DNA均未出现扩增,巢式PCR法扩增金黄色葡萄球菌DNA出现较弱条带,但测序结果分析表明产物片段为金黄色葡萄球菌DNA序列而非肺炎支原体23S目的基因片段(表3)。说明3种方法均能区分肺炎支原体与上述其他所用菌种,均具有良好的特异性。
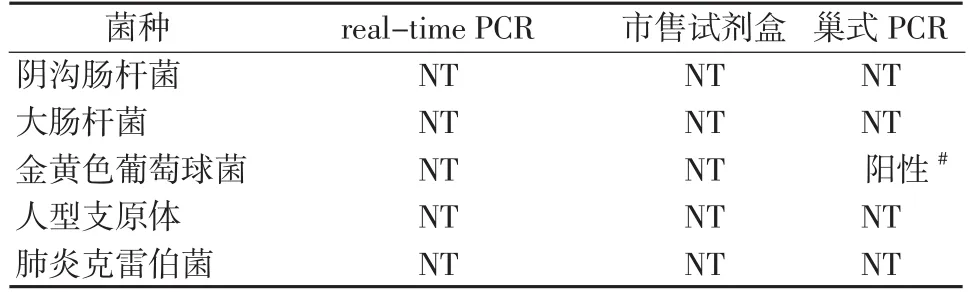
表3 3种检测方法的特异性比较Table 3 Comparison of specificity among the three assay methods
2.2.3临床样本检测 分别采用3种方法扩增170份临床咽试子样本DNA,并对相应的检测结果进行比较分析。新建荧光定量PCR法检测临床样本结果显示,170例标本中,102例Ct值<38且Tm值与标准品相同,结果判定为阳性 (图2 ),阳性检出率为60.00%。市售试剂盒检测临床样本结果显示,170例标本中,85例Ct值<38判定为阳性,阳性检出率为50.00%。巢式PCR法最终测序结果分析表明91例为阳性,阳性检出率为53.53%。 2.2.3.1 新建荧光定量PCR法与市售试剂盒检测阳性临床样本的Ct值相关性 新建荧光定量PCR法与市售试剂盒的检测结果具有高度相关性(n=82, r=0.953,P=0.001 )。见图3。 2.2.3.2 3种方法的一致性分析 见表4~5。一致性分析所用公式为:阳性符合率=2种方法均为阳性标本数/新建荧光定量PCR法阳性标本数;阴性符合率=2种方法均为阳性标本数/新建荧光定量PCR法阳性标本数;总符合率= (2种方法均为阳性标本数+2种方法均为阴性标本数 )/样本总数。
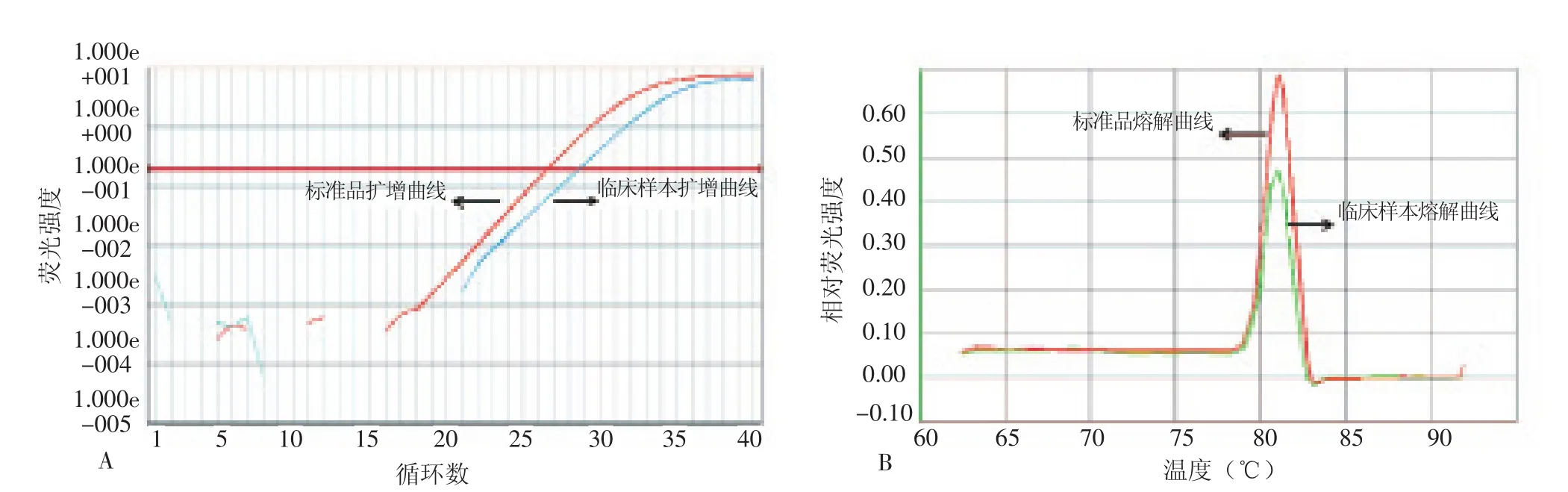
图2 标准品和阳性代表样本的扩增曲线和熔解曲线
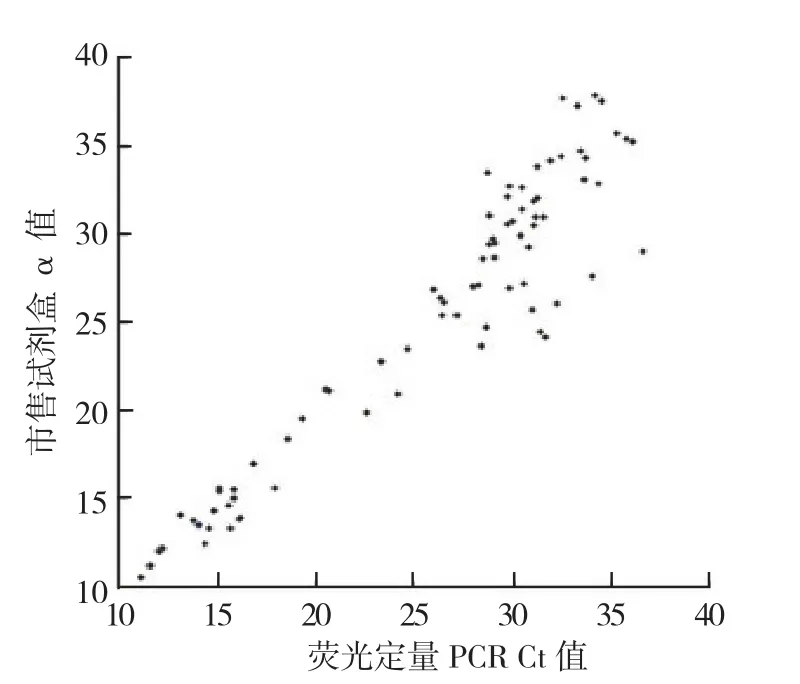
图3 新建荧光定量PCR与市售试剂盒检测结果Ct值相关性Figure 3 Comparison of the correlation of Ct value between real-time fluorescence quantitative PCR and the kit

表4 新建荧光定量PCR与传统巢式PCR检测结果(例)Table 4 Comparison of consistency between the realtime fluorescence quantitative PCR and nested PCR (cases)

表5 新建荧光定量PCR与市售试剂盒检测结果(例)Table 5 Comparison of consistency between the realtime fluorescence quantitative PCR and the kit (cases)
新建荧光定量PCR法与市售试剂盒的阳性符合率为80%,阴性符合率为96%,总符合率为86%,Kappa值为0.729;新建荧光定量PCR法与传统巢式PCR的阳性符合率为86%,阴性符合率为96%,总符合率为90%,Kappa值为0.797。说明本研究所建立的新建荧光定量PCR法与市售试剂盒、传统巢式PCR法的符合率及一致性均良好。
3 讨 论
肺炎支原体是引起呼吸道感染和肺外并发症的重要病原体之一,建立能够快速、准确且经济地适用于临床广泛应用的检测肺炎支原体感染的方法具有重要意义。实时定量PCR法与传统检测肺炎支原体方法相比因具有更高的灵敏性、特异性且耗时短而受到广泛关注[9]。CARDS因子能够使宿主细胞空泡化,并导致细胞死亡,参与了肺炎支原体所引发的疾病过程,是肺炎支原体的一个重要毒力因子[10-12]。CARDS的研究对阐明肺炎支原体感染的发病机制具有重要意义。本研究建立了针对检测肺炎支原体CARDS毒力基因片段的荧光实时定量PCR法,共设计了针对CARDS基因中不同片段的4对引物,通过比较其灵敏性,最终选择SD-CARDS-F/SD-CARDS-R作为本研究的引物,并与市售试剂盒和传统巢式PCR法比较,验证该方法的灵敏性和特异性。新建荧光定量PCR法和巢式PCR法能够检测出低至10 拷贝DNA,市售试剂盒的最低检出模板量为102拷贝,说明新建荧光定量PCR法能够达到巢式PCR法的灵敏性,较市售试剂盒高出一个数量级,对于检测低拷贝量的临床标本较目前市售试剂盒具有较大优势。
本研究采用3种方法扩增人型支原体、大肠杆菌、阴沟肠杆菌、金黄色葡萄球菌、肺炎克雷白杆菌和肺炎支原体标准株FH的基因组DNA,结果表明,3种方法均能区分FH与其他菌种DNA,与其他常见的支原体或细菌无交叉反应,均具有良好的特异性。但所选用的特异性实验菌种较为有限,在后续研究中,还应选择更多的菌种进行实验,对其特异性进行进一步的验证。
本研究分别采用3种方法扩增170份临床咽拭子样本DNA,并对相应结果进行比较分析。结果表明,新建荧光定量PCR法、市售试剂盒和巢式PCR法检测临床样本的阳性检出率分别为60.00%、50.00%和53.53%。相关性分析表明,新建荧光定量PCR法与市售试剂盒检测临床样本的结果具有高度相关性(r=0.953);一致性分析表明,新建荧光定量PCR与市售试剂盒和巢式PCR法的总符合率分别为86%和90%,Kappa值分别为0.729 和0.797,说明新建荧光定量PCR法与其他2种方法的符合率及一致性均良好。因临床样本在采集、运输和DNA提取操作过程中存在诸多不确定因素,本研究采用的3种方法仅能对临床样本中肺炎支原体菌体进行定性检测。在后续研究中,可以选择特定的看家基因作为内参,在反应体系中加入相应的检测引物,对临床样本进行相对定量研究。
目前市售试剂盒均采用探针法,探针合成成本较高,导致其售价较高,使其在实验室或临床的大样本量检测中的推广应用受到一定限制;而巢式PCR法须进行2轮PCR扩增反应,还需开盖操作和电泳鉴定,致使污染风险较高,且须进一步测序分析,操作繁琐、耗时较长,也不利于其在临床大样本量检测中的应用;而新建荧光定量PCR法只需1轮PCR操作,无须进行电泳及测序,提高了检测效率,且采用染料法进行扩增降低了实验成本,通过对其引物的深入优化克服了染料法相对探针法灵敏性较低的缺点,甚至使其灵敏性高于现市售试剂盒。因此,新建荧光定量PCR法是一种能够快速、灵敏、准确且经济地检测肺炎支原体的方法,具有较高的临床推广应用价值。
【参考文献】
[1] Nummi M, Mannonen L, Puolakkainen M. Development of a multiplex real-time PCR assay for detection of Mycoplasma pneumoniae, Chlamydia pneumoniae and mutations associated with macrolide resistance in Mycoplasma pneumoniae from respiratory clinical specimens[J]. Springerplus, 2015, 4:684-692.
[2] Shin JE, Cheon BR, Shim JW, et al. Increased risk of refractory Mycoplasma pneumoniae pneumonia in children with atopic sensitization and asthma[J]. Korean J Pediatr, 2014, 57(6):271-277.
[3] Walter ND, Grant GB, Bandy U, et al. Community outbreak of Mycoplasma pneumoniae infection: school-based cluster of neurologic disease associated with household transmission of respiratory illness[J]. J Infect Dis, 2008, 198(9):1365-1374.
[4] Klement E, Talkington DF, Wasserzug O, et al. Identification of risk factors for infection in an outbreak of Mycoplasma pneumoniae respiratory tract disease[J]. Clin Infect Dis, 2006, 43(10):1239-1245.
[5] Orrskog S, Medin E, Tsolova S, et al. Causal inference regarding infectious aetiology of chronic conditions: a systematic review[J]. PLoS One, 2013, 8(7):e68861.
[6] Kannan TR, Baseman JB. ADP-ribosylating and vacuolating cytotoxin of Mycoplasma pneumoniae represents unique virulence determinant among bacterial pathogens[J]. Proc Natl Acad Sci U S A, 2006, 103(17):6724-6729.
[7] 李丹,李静宜,董艳青,等. 利用环介导等温扩增技术检测儿童咽拭子标本中肺炎支原体[J].山东大学学报(医学版),2014,52(10):55-60.
[8] 李靖,崔菲菲,辛德莉.儿童呼吸道肺炎支原体感染耐药现状[J].实用儿科临床杂志,2009, 24 (22):1717-1719,1728.
[9] Dumke R, Jacobs E. Evaluation of five real-time PCR assays for detection of Mycoplasma pneumoniae[J]. J Clin Microbiol, 2014, 52(11):4078-4081.
[10] Techasaensiri C, Tagliabue C, Cagle M, et al. Variation in colonization, ADP-ribosylating and vacuolating cytotoxin, and pulmonary disease severity among Mycoplasma pneumoniae strains [J]. Am J Respir Crit Care Med, 2010, 182(6):797-804.
[11] Becker A, Kannan TR, Taylor AB, et al. Structure of CARDS toxin, a unique ADP-ribosylating and vacuolating cytotoxin from Mycoplasma pneumoniae[J]. Proc Natl Acad Sci U S A, 2015, 112(16):5165-5170.
[12] Bose S, Segovia JA, Somarajan SR, et al. ADP-ribosylation of NLRP3 by Mycoplasma pneumoniae CARDS toxin regulates inflammasome activity[J]. mBio, 2014, 5(6):e02186-14.
(2015-08-20 收稿 2015-10-15 修回)
(责任编委 赵 敏 本文编辑 张云辉)
·专题综述·
Development of real-time fluorescence quantitative PCR for the detection of Mycoplasma pneumoniae
GUO Dong-xing, HU Wen-juan, LI Dan, LI Jing-yi, LI Shao-gang, WU Zhao-yong, TIAN Xiu-jun, XIN De-li*
Beijing Key Laboratory for Research on Prevention and Treatment of Tropical Diseases, Beijing Tropical Medicine Research Institute,
Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China
*Corresponding author, E-mail: xindl48@126.com
[Abstract]Objective To develop a new real-time fluorescence quantitative PCR assay for the detection of Mycoplasma pneumoniae, and to compare its detection performance with the kit and traditional nested PCR method. Methods According to the sequence of community-acquired respiratory distress syndrome toxin gene in Mycoplasma pneumoniae, specific primers were designed and the standard plasmids were constructed. The standard curve was drawn in the real-time PCR using SYBR green as fluorescence reporter. And then the sensitivity and specificity of the newly-developed real-time PCR assay were compared with those of the kit and traditional nested PCR method by detecting other bacteria and 170 throat swab samples from child patients. Results In the sensitivity tests, the newly-developed real-time fluorescence PCR and nested PCR could detect 10 copies of FH DNA, while the kit could detect 100 copies. In the specificity tests, no amplification of other Mycoplasma or bacteria was observed using newly-developed real-time fluorescence PCR and the kit. In detecting the 170 throat swab samples from child patients, the positive rates of newly-developed real-time fluorescence PCR, the kit and nested PCR were 60.00%, 50.00% and 53.53%, respectively. The newly-developed realtime fluorescence PCR had good correlation with the kit (r=0.953), and the total consistency rate of these two methods was 86% with Kappa value of 0.729, while that of the newly-developed real-time fluorescence PCR and nested PCR was 90% with Kappa value of 0.797. Conclusions The newly-developed real-time fluorescence PCR assay is more sensitive and cheaper than the kit with the same specificity, and more rapid and laborsaving than the nested PCR in detecting Mycoplasma pneumoniae from the clinical samples. So the newly-developed real-time fluorescence PCR assay can be used widely in scientific research and clinical application.
[Key words]Mycoplasma pneumoniae; respiratory tract infections; child; research design
[通讯作者]辛德莉,E-mail: xindl48@126.com
[基金项目]北京市科技计划课题(Z131100004013029);首都医科大学基础-临床课题(14JL28)
DOI:10.3969/j.issn.1007-8134.2016.01.010
[文献标志码][中国图书资料分类号] R375.2;R517.6 A
[文章编号]1007-8134(2016)01-0052-05
