硅胶负载手性氨基醇聚合物的合成及其应用
2016-03-23聂作兵刘丰良刘锐利李翠钦中南大学化学化工学院湖南长沙410083
聂作兵, 刘丰良, 刘锐利, 李翠钦, 冯 思(中南大学 化学化工学院,湖南 长沙 410083)
硅胶负载手性氨基醇聚合物的合成及其应用
聂作兵, 刘丰良, 刘锐利, 李翠钦, 冯 思
(中南大学 化学化工学院,湖南 长沙 410083)
摘 要:以L-亮氨酸(L-Leu)为手性源,经酯化、格氏化、酰胺化等步骤制备手性单体(L-NALAA),以该单体为手性识别基团,在引发剂偶氮二异丁腈和交联剂乙二醇二甲基丙烯酸酯(EDMA)的作用下,与烯化功能硅胶发生自由基共聚反应,制备了新型键合硅胶手性固定相,其结构经FT-IR、TGA、EA表征。以4种对映异构体为模型药物对手性材料手性固定相的手性拆分性能进行研究,结果表明,手性材料手性固定相对奥美拉唑和兰索拉唑的拆分效果较好。
关键词:L-亮氨酸;自由基共聚反应;手性固定相;对映异构体;手性识别/拆分
手性是生命系统的基本特征,也是自然界的本质属性之一。在活的生物体内,一对对映体常常表现出不同的药效、毒理特性,有时两个对映体的药理作用是相加的,但更多的情况是一种对映体有活性(活性异构体), 而另一种则没有活性或活性很低(低活性异构体),甚至有较大的毒性。因此,手性识别/拆分变得越来越重要,并且引起了越来越多的人付诸巨大的努力,去研究新颖的手性拆分技术[1-7]。近年来,由于光学活性聚合物具有独特的分子识别、不对称催化特性、光学拆分外消旋体[8-12]的功能,引起人们广泛的关注。这类聚合物大部分都是如下两种方法来合成的。一是将光学活性基团引入到光学非活性的聚合物载体(聚苯乙烯、聚丙烯酰氯等)或不溶的基体上;二是光学活性单体与一些相应的交联剂的自由基共聚反应。因此,研究此类聚合物及其衍生物的手性拆分能力,具有重要的意义。

图1 化合物手性固定相(CSP)的合成路线
本文利用L-亮氨酸作手性源,经甲酯化、格氏反应、丙烯酰化得到新型手性单体,然后,将其与表面修饰带双键的硅胶进行自由基共聚反应,得到不溶于有机溶剂的手性拆分材料手性固定相,考察了手性材料手性固定相作为手性吸附剂对4种手性药物的手性拆分能力。合成路线如图1所示。
1 实验
1.1 仪器与试剂
修饰硅胶用HPLC硅胶(青岛海洋化工厂生产);偶氮二异丁腈(AIBN)用甲醇重结晶,四氢呋喃(THF)、甲苯用金属钠干燥;其余所有试剂均为分析纯,除特别说明外,均直接使用。
北京泰克仪器有限公司X-5精密显微熔点测定仪(温度计未校正);美国Nicolet 6700型傅立叶变换红外光谱仪(KBr压片);美国Mercury Plus-400型核磁共振仪(CDCl3为溶剂,TMS为内标);德国Elementar公司Vario ELIII型元素分析仪;上海精密科学仪器有限公司WZZ-3自动旋光仪;德国 Netzsch STA-409-PC/PG 同步热分析仪。
1.2 实验方法
1.2.1 (S)-2-氨基-4-甲基-1,1-二苯基戊烷-1-醇(2)的合成
参考文献[13]合成化合物2,波谱数据与文献[14]相符。
1.2.2化合物3的合成
100 mL单颈瓶中加入58 mL无水四氢呋喃,6.25 mL(44.9 mmol)三乙胺,10 g(37.2 mmol)二齿手性氨基醇,然后将反应体系置于恒温低温搅拌反应浴中,在0℃条件下,向反应溶液中缓慢滴加过量的丙烯酰氯(6 mL,73.8 mmol),30 min内滴完,然后将反应体系转移至室温下搅拌反应过夜。旋去溶剂,加入一定量的水与乙酸乙酯萃取,有机相用无水硫酸钠干燥过夜,旋去溶剂,室温真空干燥过夜,得到浅黄色固体N-丙烯酰-L-亮氨酸-氨基醇11.2 g,收率93.3%,Rf=0.76。m.p. 224~226℃;IR(KBr),v:3441、3282、3091、2949、2860、1655、1613、1565、1489、1450、1370 cm-1。
1.2.3自由基共聚反应
1.2.3.1 乙烯化硅胶的合成
乙烯化硅胶由3-氨丙基硅胶和丙烯酰氯为原料按文献[15]方法制备,3-氨丙基硅胶参考文献[15]合成。
1.2.3.2乙烯化硅胶接枝化合物3
250 mL三颈瓶中 2.0 g功能化硅胶悬浮于20 mL无水甲苯中。通入氮气,0.1 mL 交联剂乙二醇二甲基丙烯酸酯(EDMA)、0.7 g(2.170 mmol)单体3与34 mg(0.206 mmol)AIBN在氮气保护下加入上述悬浮液中,100 ℃反应12 h,冷却至室温,将反应液过滤,然后依次用50 mL丙酮(5×10 mL)、50 mL甲醇(5×10 mL)、50 mL二氯甲烷(5×10 mL)、50 mL EtOH(5×10 mL)洗涤,50℃真空干燥过夜,得到硅胶手性材料手性固定相 2.3 g,键合量15.9%。
1.2.4手性拆分实验
按照手性材料与外消旋体的摩尔比为2∶1进行投料,取25 mL一定质量浓度的外消旋体溶液于50 mL反应瓶中,加入相应的手性材料,室温缓慢搅拌3 h,准确移取上清液,用HPLC手性AD柱测其e.e.。
2 结果与讨论

图2 手性固定相的热重分析
2.1 手性固定相(CSP)的热重分析
图2为手性固定相的热重分析结果。用TGA对键合型硅胶手性材料手性固定相进行热失重分析,分析手性固定相的热失重曲线,来研究聚合物poly(L-NALAA) 在硅胶上的键合效率与键合型手性定相的热稳定性。测试条件在氮气环境下,流速60 mL/min,分析仪输出压力0.05 MPa,温度20~630℃,仪器的升温速率为10℃/min。通过对比(a)、(b)、(c)、(d)的失重参数(分别为1.58%、7.57%、12.09%、18.91%),计算出键合在硅胶表面的聚合物为6.82%。结果表明,烯丙基硅胶(c)成功键合上L-NALAA,作为键合型手性固定相对外消旋体进行手性分离性能的研究。
2.2 手性固定相(CSP)的元素分析

表1 氨丙基硅胶、烯丙基硅胶和接枝单体硅胶的元素分析结果
2.3 外消旋体的手性识别/拆分
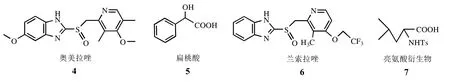
图3 实验用外消旋体结构

表3 光学手性材料手性固定相拆分上述外消旋体结果
a用HPLC手性AD柱测拆分对象溶液
b,d流动相:正己烷/异丙醇=90∶10(v/v),流速1.0 mL/min,柱温度25℃,检测波长302 nm
c流动相:正己烷/异丙醇/三氟乙酸=90∶10∶0.1(v/ v/v),流速1.0 mL/min,柱温度25℃,检测波长254 nm
e流动相:正己烷/异丙醇=90∶10(v/v),流速1.0 mL/min,柱温度25℃,检测波长254 nm
3 结论
本文以L-Leu为原料,经酯化、格氏化、酰胺化、自由基共聚反应等步骤制备了新型手性固定相,其结构经红外光谱、热重分析、元素分析表征。用手性吸附实验测试了手性固定相对外消旋模型药物的手性拆分能力,结果表明该手性材料手性固定相能够用于外消旋体奥美拉唑与兰索拉唑的拆分。
[1] Kubota T, Yamamoto C, Okamoto Y. Phenylcarbamate derivatives of cellulose and amylose immobilized onto silica gel as chiral stationary phases for high-performance liquid chromatography[J]. J Polym Sci Part A: Polym Chem, 2004(42): 4704-4710.
[2] Okamoto Y, Noguchi J, Yashima E. Enantioseparation on 3,5-dichloro-and 3,5-dimethylphenylcarbamates of polysaccharides as chiral stationary phases for high-performance liquid chromatography[J]. React Funct Polym, 1998(37): 183-188.
[3] Carrillo R, Martin V S, et al. Quantification of a CH-p interaction responsible for chiral discrimination and evaluation of its contribution to enantioselectivity[J]. Angew Chem Int Ed, 2009, 121(42): 7943-7948.
[4] Ballistreri F P, Pappalardo A, Tomaselli G A, et al. Heteroditopic chiral uranyl-salen receptor for molecular recognition of amino acid ammonium salts[J]. Eur J Org Chem, 2010(20): 3806-3810.
[5] Kubota T, Yamamoto C, Okamoto Y J. Preparation and chiral recognition ability of cellulose 3,5-dimethylphenylcarbamate immobilized on silica gel through radical polymerization[J]. Polym Sci Part A: Polym Chem, 2003(41): 3703-3712.
[6] Chao D, Liu H T, Liu X C, et al. Synthesis, characterization and properties of an electroactive polymer having oligoaniline and binaphthyl units[J]. React Funct Polym, 2010, 70(4): 251-256.
[7] West C, Bouet A, Gillaizeau I, et al . Chiral separation of phospine-containing α-amino acid derivatives using two complementary cellulosic stationary phases in supercritical fluid chromatography[J]. Chirality, 2010, 22(2): 242-251.
[8] Okamoto Y, Nakano T. Asymmetric polymerization[J]. Chem Rev, 1994, 94(2): 349-372.
[9] Aoki T, Shinohara K i, Kaneko T, et al . Enantioselective permeation of various racemates through an optically active poly{1-[dimethyl(10-pinanyl)silyl]-1-propyne} membrane[J]. Macromolecules, 1996, 29(12): 4192-4198.
[10] Xi X, Liu G, Lu W, et al. Optically active copolymers of N-(oxazolinyl)phenylmaleimides with methylmethacrylate: Synthesis and chiral recognition ability[J]. Polymer, 2009, 50(2): 404-409.
[11] Nakano T. Optically active synthetic polymers as chiral stationary phases in HPLC[J]. J Chromatogr A, 2001, 906(1-2): 205-225.
[12] Song C, Zhang C, Wang F, et al. Chiral polymeric microspheres grafted with optically active helical polymer chains: A new class of materials for chiral recognition and chirally controlled releaset[J]. Polym Chem, 2013(4): 645-652.
[13] 刘丰良, 李媛媛, 王文革, 等. L-亮氨酸衍生物手性氨基醇的合成及其对布洛芬和扁桃酸对映异构体的手性识别[J]. 有机化学, 2011, 31(5): 747-751.
[14] Kang Y F, Liu L, Wang R, et al. The use of bifunctional catalyst systems in the asymmetric addition of alkynylzinc to aldehydes[J]. Tetrahedron: Asymmetry, 2004, 15(19): 3155-3159.
[15] Kimata k, Tsuboi R, Hosoya K, et al. Chemically bonded chiral stationary phase prepared by the polymerization of cellulose p-vinylbenzoate[J]. Anal Methods Instrum, 1993(1): 23-29.
Synthesis and Application of Silica-Gel-Bound Chiral Amino Alcohol Polymer
NIE Zuo-bing, LIU Feng-liang, LIU Rui-li, LI Cui-qin, FENG Si
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
Abstract:A novel bonded type chiral stationary phase (CSP) was synthesized via free radical copolymerization of chiral monomer (L-NALAA), vinylized silica gel, and cross-linker ethylene glycol dimethacrylate (EDMA). L-NALAA was prepared by esterification, Grignard reaction and amidation reaction of using L-leucine as chiral source. The immobilization of the monomer onto the vinylized silica gel was performed through a radical polymerization reaction with AIBN as the initiator in the presence of toluene. The CSP was characterized by FT-IR, TGA, EA. The enantioselective properties of the CSP in the separation of four enantiomers were studied and the chiral resolution tests indicated that the prepared CSP could be applied to efficiently chiral separation of the racemic omeprazole and lansoprazole solution.
Key words:L-leucine; free radical copolymerization; chiral stationary phase (CSP); enantiomers; chiral recognition/resolution
作者简介:聂作兵(1988~),男,硕士研究生;主要从事有机合成和手性拆分研究。
基金项目:国家自然科学基金青年科学基金资助项目(No. 21302231)。
收稿日期:2015-12-01
文章编号:1009-220X(2016)01-0034-05
DOI:10.16560/j.cnki.gzhx.20160118
中图分类号:O621. 3
文献标识码:A
