香樟凋落叶分解对辣椒及土壤氮营养的限制作用
2016-03-23马光良王光剑李呈翔胡庭兴
陈 洪,马光良,王光剑,李呈翔,蒋 雪,王 锐,胡庭兴*
(1 四川农业大学 林学院,四川温江 611130;2 泸州市林业科学研究所,四川泸州 646000)
香樟凋落叶分解对辣椒及土壤氮营养的限制作用
陈洪1,2,马光良2,王光剑2,李呈翔2,蒋雪1,王锐2,胡庭兴1*
(1 四川农业大学 林学院,四川温江 611130;2 泸州市林业科学研究所,四川泸州 646000)
摘要:香樟(Cinnamomum camphora)凋落叶分解能够明显干扰受体植物的生长、生殖、光合生理和活性氧代谢。该研究继续采用盆栽试验,探讨了不同量[0(对照)、25、50和100 g]的香樟凋落叶添加到土壤(10 kg/盆)中对受体植物辣椒(Capsicum annuum)及其土壤氮营养状况的影响,外源氮(尿素)输入对凋落叶分解的交互作用,以及凋落叶分解效应的产生是否因为其较高的C/N比而导致微生物争氮。结果显示:(1)各剂量(25~100 g/盆)凋落叶处理下,辣椒幼苗硝态氮、可溶性蛋白和全氮含量均在至少2个月内大幅显著降低。(2)土壤硝态氮与辣椒硝态氮、全氮间均具有极显著的协同下降趋势;土壤微生物生物量氮则在总体上高于对照,而土壤全氮和铵态氮的响应较小。(3)施氮不仅使辣椒各氮组分和土壤硝态氮含量整体提升,还使凋落叶分解在这些指标上的抑制作用显著减弱。(4)香樟凋落叶的初始C/N为125.61±4.89,其在土壤中分解48~137 d后的C/N始终远高于Hodge假说指出的可导致微生物争氮的临界值,但经过分解120 d和135 d的凋落叶添加到土壤中并不抑制辣椒的生长。研究认为,香樟凋落叶分解初期可能释放了不利于土壤硝化过程的物质,造成土壤硝态氮匮乏,以致受体植物的氮素吸收和积累减少,而凋落叶较高的C/N比及土壤微生物争氮并非主导因素。
关键词:香樟;凋落叶分解;氮营养;碳氮比;化感作用
香樟(Cinnamomumcamphora)是中国亚热带地区重要的材用和特种经济树种,不仅能提供优质木材,还广泛应用于香料提取、医药合成、驱虫剂制备和城乡绿化等领域[1-3]。除作为人工林定向培育外,香樟在南方行道、校园、公园、农田乃至村落四旁均十分常见。然而,在香樟的发展、经营过程中,人们逐渐怀疑其具有较强的化感作用,即能够通过释放特定化学物质(化感物质)而影响邻近生物的生长繁衍。王琛等[4]观察到香樟林下的草坪草在播种一段时间后大量消亡可能与其落叶释放有毒物质有关;Liu等[5]和郭金耀等[2]分别发现香樟叶片提取物能抑制农作物和杂草的种子萌发和苗生长;Okamoto等[6]研究认为香樟叶片中含有化感物质樟脑,因此添加到土壤中后抑制水稻(Oryzasativa)的生长。如果香樟凋落叶具有明显的化感作用,那么探明其作用机理以及如何采取措施予以避免和消除,对于香樟树的发展和经营管理具有重要意义。
残体分解是植物实现化感作用的四大途径之一[7-8],有学者甚至认为大多数化感物质都要通过残体分解才逐步释放[9]。而凋落叶作为香樟的主要残体,含有丰富的第二大化感物质类别-萜类(如樟脑、1,8-桉叶油醇、β-丁子香烯)[10],其中不乏对农作物、杂草和微生物生长产生抑制效应的物质[6,8,11-12]。由于香樟凋落叶量大而集中(四川地区多在4~5月),其淋溶、腐解或随人们的耕作活动进入土壤中分解释放化感物质,很可能是其影响邻近灌草、花卉和作物生长和产出的重要形式。以往的化感作用研究大多采用单一成分、挥发油或浸提液处理受体,高度浓缩的化感物质所表现出的效应可能与其在自然状态下的情况差异较大,而缺少了土壤介质的研究结果也较难指导实践生产[13-14]。本课题组采用了更加接近自然状况的盆栽试验来模拟香樟凋落叶分解释放化感物质的过程,发现受体植物辣椒(Capsicumannuum)体内活性氧增多,光合作用减弱,营养生长和生殖生长受到强烈制约[10,15]。但是,其中化感作用的重要性也遭受到两方面的质疑:一是添加到土壤中的凋落叶可能影响土壤通气透水性或对受体植物根系伸展产生阻隔,二是凋落叶可能具有较高的C/N比,会造成土壤微生物与植物争氮,植物因可利用的氮素缺乏而生长受限。前者在以往的研究中已通过直接和间接的方法给予了排除[10,15-17],后者尚未得到解答,但暗示香樟凋落叶分解条件下受体植物和土壤的氮营养状况值得深入研究。
为解答质疑,也为进一步了解香樟凋落叶分解对受体植物生长产生负面影响的原因和机制,本研究继续通过盆栽试验,探讨香樟凋落叶分解对受体植物和土壤氮营养状况的影响,外源氮输入与凋落叶分解间的交互作用,以及期间凋落叶C/N比及其生物测试结果的变化,以期为香樟与其伴生植物复合系统的科学经营管理提供更全面的理论参考。
1材料和方法
1.1试验材料
供体材料为香樟凋落叶,采自四川农业大学校园30年生香樟林。选择新近凋落叶(从颜色和质地判断),风干,剪成长宽约1~2 cm的碎片,以利于与土壤混合均匀;受体材料为‘香辣王’辣椒,种子由成都市种都种业公司提供。播种前选择饱满、均一的种粒,测得千粒重为(6.666±0.266) g;栽植盆为聚乙烯塑料盆,口径29 cm,底径25 cm,高度26 cm;土壤为当地农田沙壤土,其理化性质为:pH 7.85,有机质25.05 g/kg,全氮1.16 g/kg,全磷1.46 g/kg,全钾25.55 g/kg,硝态氮41.93 mg/kg,铵态氮8.74 mg/kg,速效磷190.46 mg/kg,速效钾47.86 mg/kg。过1 cm筛以去除较大的石砾和草根,之后充分混匀,平铺晾置备用。试验在四川农业大学教学科研园区的塑料大棚中进行,四周通风透气,除遮挡雨水外,与外界环境几乎没有差别。
1.2试验设计
1.2.1香樟凋落叶的生物测试及施氮的缓解试验根据前期研究采用的试验设计[10,15],先进行香樟凋落叶处理,即设置每盆25 g(0.5倍基本量)、50 g(基本量)和100 g(2倍基本量)3个凋落叶添加水平,分别记作L25、L50和L100,以不添加凋落叶为对照(CK)。2014年5月,将称量好的香樟凋落叶碎片与土壤(10 kg)混合均匀,然后装入盆中,浇透水,点播辣椒种子于土表(30粒/盆),统一覆土0.7 kg,再少量浇水润湿表土。每处理重复42次。适时间苗,及时去除杂草。在凋落叶处理对受体植株的影响表现得较明显且植株具备一定木质化程度的时候,从各处理中随机抽取21盆进行施氮处理(氮源为尿素,含N率46.7%)。为避免烧苗和浪费,于凋落叶分解的37、40、45、53、66和89 d分别实施,除第一次用量为每盆0.1 g外,其余5次的用量均为每盆0.2 g,CK、L25、L50和L100基础上的施氮处理依次记作NCK、NL25、NL50和NL100。由于工作量较大,从受体植物生长受限表现得较为明显时开始,不定时地交替进行植物和土壤采样(前者以间苗的形式进行,随机采取过密的植株;后者用土钻钻取,系破坏性取样,之后不再用于试验)及各自氮营养指标的测定。其中,植物氮指标测定始于第26 d,土壤氮指标测定始于第41 d,保证上述两组试验同时进行两者之一的测定(26 d时尚未开始施氮除外),以便统计分析凋落叶效应、施氮效应及两者的交互效应。
1.2.2香樟凋落叶分解中的C/N监测及二次生物测试分别于凋落叶分解的48、85、101和137 d,从已经取走土样的各处理盆中筛出凋落叶,分别小心地用软毛刷和镊子尽可能地去除泥土,风干,置纱网中抖落余留的少数泥沙,连同原始样品(分解0 d)一起进行C/N比的测定。结合Hodge等[18]提出的分解基质C/N比决定土壤微生物是否争氮的假说和分解过不同时间(47、120和135 d)的凋落叶再次添加到土壤中进行的生物测试(已于2013年开展,使用的是筛自L50和L100处理盆的混合凋落叶,筛取方法及生物测试方法同上;为与凋落叶原始样品的处理进行区分,分解过的凋落叶25、50和100 g/盆处理依次记作FL25、FL50和 FL100),判断香樟凋落叶是否因C/N较高,引起土壤微生物争氮而成为限制受体植物生长的主要因素。
1.3测定项目与方法
1.3.1辣椒氮营养指标辣椒地上部分全氮含量采用半微量凯氏法(LY/T1228-1999)测定,选取各处理辣椒同一部位新鲜叶片,样品制备时将辣椒地上部分剪成小段,置105 ℃烘箱中杀青30 min,之后65 ℃条件下烘干至恒重,高速粉研机打成粉末;叶片硝态氮含量采用硝基水杨酸比色法[19]测定;叶片可溶性蛋白含量采用考马斯亮蓝G250法[20]测定,除注意选取各处理辣椒同一部位新鲜叶片外,还要严格控制每一样品与考马斯亮蓝G250溶液反应的时间。
1.3.2土壤氮组分含量土壤全氮含量采用半微量凯氏法测定(LY/T 1228-1999);土壤硝态氮含量采用2 mol/L KCl浸提-紫外吸收法测定[21];铵态氮含量采用苯酚-次氯酸钠显色法测定[21];微生物生物量氮以氯仿熏蒸-0.5 mol/L K2SO4浸提法提取[22],茚三酮比色法测定[23]。
1.3.3香樟凋落叶C/N比全碳和全氮含量分别采用外加热重铬酸钾氧化法(LY/T1237-1999)和半微量凯氏法(LY/T1228-1999)测定。
C/N比=全碳/全氮
1.4统计分析
采用SPSS 16.0统计分析软件(SPSS Inc.,USA)对数据进行Pearson相关分析、单因素方差分析(One-way ANOVA)、多因子方差分析(GLM-Univariate)和重复测量方差分析(RM-ANOVA),最小显著差数法(LSD法)进行多重比较(显著水平α=0.05),SigmaPlot 10.0(Systat Software Inc.,USA)作图,Excel 2007制表。
2结果与分析
2.1香樟凋落叶分解及其分解过程中施氮对辣椒体内氮营养状况的影响
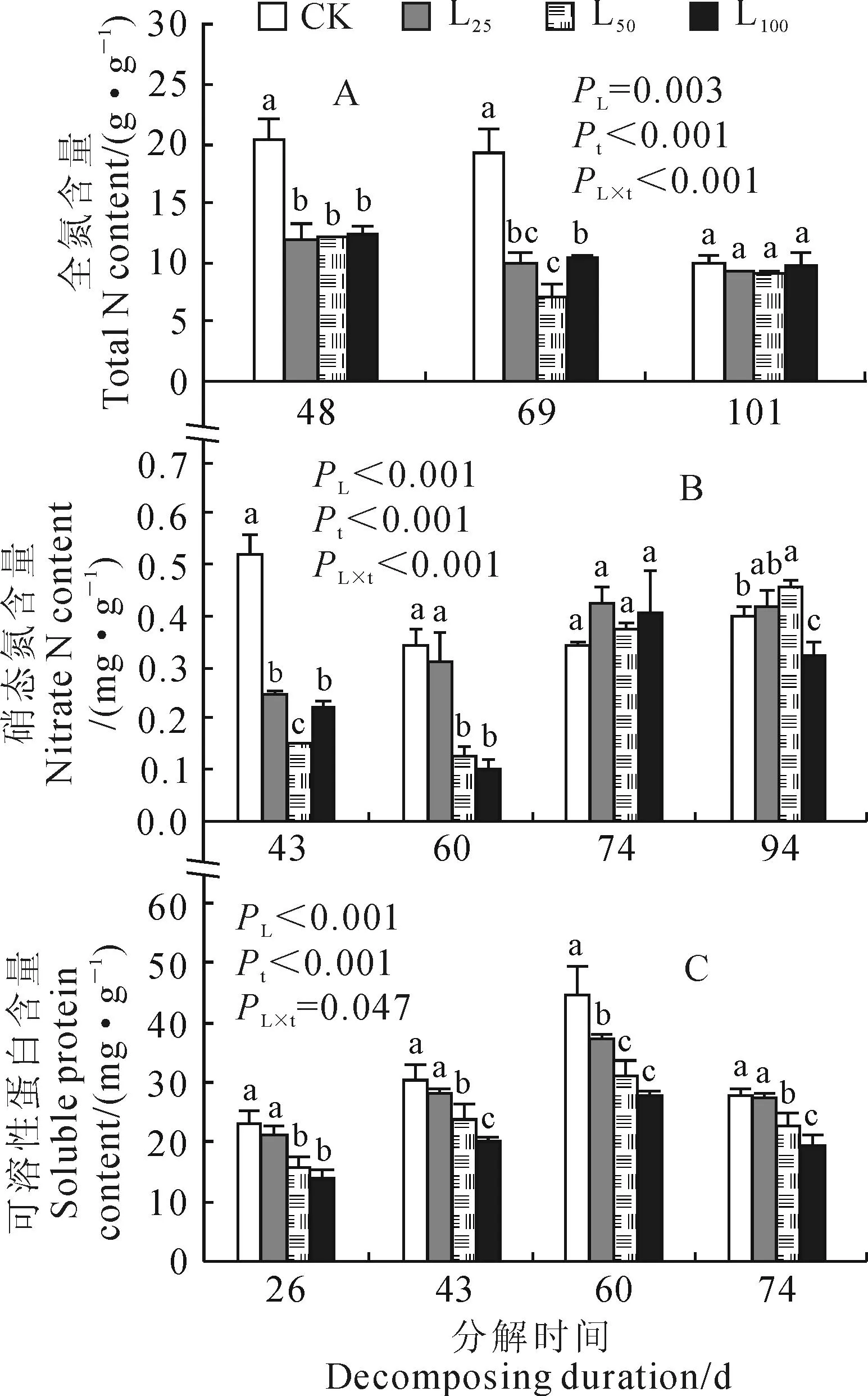
2.1.1香樟凋落叶分解的影响辣椒体内的氮营养状况受到香樟凋落叶处理的显著影响。
(1)全氮含量图1,A显示,凋落叶分解48 d时,3个水平凋落叶处理均使其全氮含量比对照(CK)显著降低40%左右(P<0.05);分解69 d时这种抑制作用更加强烈,L25、L50和L100处理分别使辣椒植株的全氮含量比对照(CK)显著降低48.2%、63.0%和45.6%;到分解101 d时,各处理彼此间差异不显著(P>0.05)。重复测量方差分析(RM-ANOVA)表明,凋落叶分解在辣椒全氮含量上的影响效应显著(PL=0.003)。
(2)硝态氮含量图1,B显示,凋落叶分解对辣椒叶片硝态氮含量的限制在43 d时就已有充分体现,此时L25和L100处理的叶片硝态氮含量不足CK的1/2,而L50处理不足CK的1/3;随着分解时间的延长(分解60~94 d),L25处理的硝态氮含量与CK差异不显著,而L50和L100处理在分解60 d时仍然约占CK的1/3,之后才与CK间差异缩小,于分解74 d时各凋落叶处理与CK间已无显著差异。同时,RM-ANOVA显示,辣椒叶片硝态氮含量总体上表现为CK>L25>L50≈L100。作为能被直接吸收利用的主要氮素形态之一,植物硝态氮含量的下降可能源于土壤中速效氮素的供应减少,也可能与其根系吸收能力减弱有关。
(3)可溶性蛋白含量在凋落叶分解26~74 d期间,辣椒叶片可溶性蛋白含量几乎均随土壤中凋落叶添加量的增加而逐渐下降(图1,C)。其中,低剂量处理(L25)的可溶性蛋白含量仅在分解60 d时与CK差异显著,而中、高剂量处理(L50和L100)均始终显著低于CK。RM-ANOVA表明,辣椒叶片可溶性蛋白含量受到凋落叶添加剂量、分解时间及两者互作的显著影响,且总体上表现为CK>L25>L50>L100。可见,香樟凋落叶处理的辣椒植株氮含量下降不仅体现在能直接吸收的无机态氮上,也体现在由这些无机态氮转化、合成的有机态氮上。
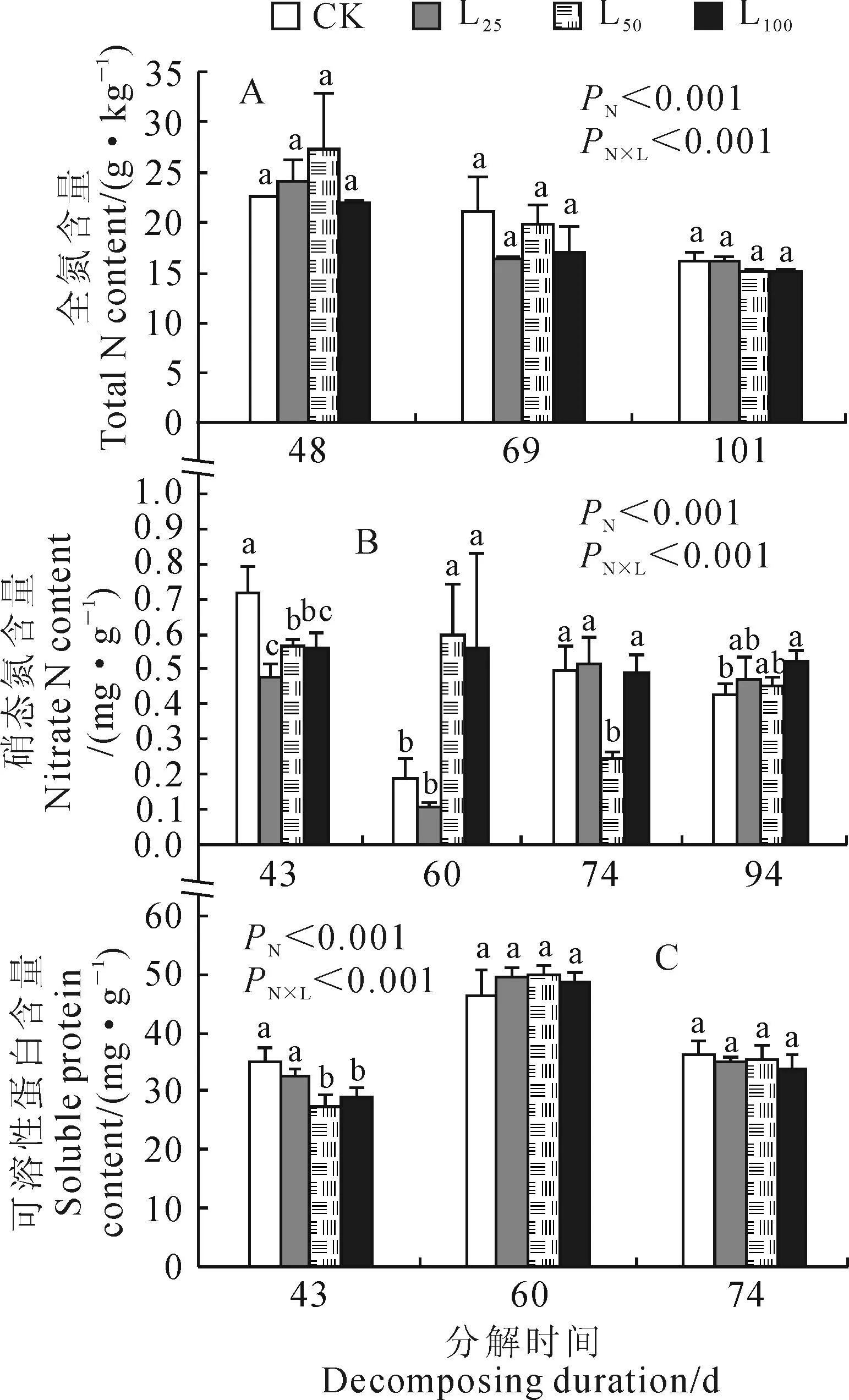
2.1.2香樟凋落叶分解过程中施氮的影响由图2可以看出,施氮不仅整体提高了各凋落叶处理和对照辣椒的全氮、硝态氮和可溶性蛋白含量(PN<0.001),而且使凋落叶处理在这3项指标上的抑制效应大幅度减弱甚至消失,施氮与凋落叶间的互作效应均达到显著水平(PN×L<0.001)。施氮开始后仅11 d(凋落叶分解48 d),各处理辣椒彼此间的全氮含量已无显著差异;施氮开始后仅6 d(凋落叶分解43 d),L25、L50和L100处理对辣椒硝态氮含量的抑制效应就由52.6%、70.5%和57.5%分别降至33.6%、20.9%和21.7%;而施氮后凋落叶对辣椒可溶性蛋白含量显著的抑制效应仅出现在分解43 d时,之后各处理彼此间差异不明显(图2,图1)。
2.2香樟凋落叶分解及其分解过程中施氮对土壤氮营养状况的影响
2.2.1香樟凋落叶分解的影响(1)全氮含量土壤全氮含量在凋落叶分解48 d时虽显著降低,但幅度并不大,L25、L50和L100处理相对于CK降低15%~20%;而随着分解时间的延长(64 d和85 d),土壤全氮含量在各处理间差异不显著(图3,A)。凋落叶处理下土壤全氮含量的变化似乎不能很好地解释受体植物氮营养严重不足的现象。
(2)硝态氮含量香樟凋落叶分解初期(41~64 d)极大程度地降低了土壤中的硝态氮含量,L25、L50和L100处理在此期间分别较CK降低了82.5%~50.0%、90.1%~49.7%和87.9%~49.5%,均达到显著水平(P<0.05);当分解至85~116 d时,各处理彼此间的差异明显减小。RM-ANOVA显示,总体上各凋落叶处理的土壤中硝态氮含量均显著低于CK(图3,B)。土壤硝态氮含量的剧烈下降很可能是受体植物硝态氮及其它氮营养指标大幅降低的主要原因。
(3)铵态氮含量由图3,C可见,随着土壤中香樟凋落叶剂量的增大,土壤中铵态氮含量先呈微弱的下降趋势(41 d),不久之后便呈微弱的上升趋势(48~116 d),但就单次测定的结果来看,各水平凋落叶处理与CK间几乎没有显著差异,总体上凋落叶分解在土壤铵态氮含量上的效应也并不显著(PL=0.094)。这表明土壤铵态氮含量的变化可能不是受体植物体内氮匮乏的主要原因。
L25、L50和L100分别表示每盆添加香樟凋落叶原样25、50、100 g;
PN、PN×L对应的数值分别表示经三因子方差分析所得的
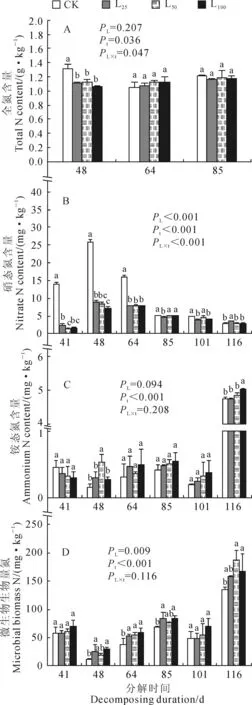
图3 香樟凋落叶分解过程中土壤氮组分的变化
(4)微生物生物量氮含量在整个测定时期内,随着凋落叶剂量的增大,土壤微生物生物量氮均表现出上升趋势。在分解的41和101 d,各处理间未见显著差异,但总体上凋落叶处理的效应显著(PL=0.009),且多重比较发现L100≈L50≈L25>CK(RM-ANOVA)(图3,D)。
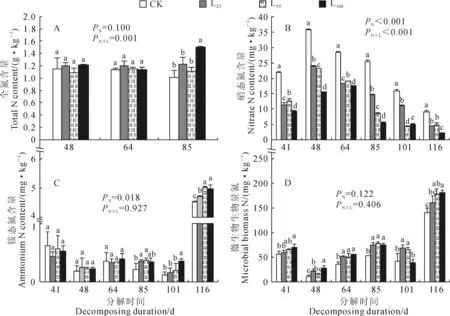
图4 香樟凋落叶分解过程中施氮对土壤氮营养状况的影响
2.2.2香樟凋落叶分解过程中施氮的影响由图4可以看出,施氮开始后11 d(凋落叶分解48 d),土壤全氮含量在凋落叶处理下降低的情形即得到缓解,施氮与凋落叶间的交互效应显著(PN×L=0.001)。更为明显的是,施氮不仅使各测定时间下各处理土壤的硝态氮含量整体显著提高(PN<0.001),而且使L25、L50和L100处理在凋落叶分解41~64 d期间对土壤硝态氮含量的平均抑制率由65.9%、69.1%和69.9%分别降至38.8%、36.8%和50.6%。相比之下,施氮后仅在短时间内整体提高了各处理的土壤铵态氮含量(施氮后4 d,凋落叶分解41 d),随后则是整体降低土壤铵态氮含量(凋落叶分解48~116 d),但总体上对凋落叶分解的效应影响不大(PN×L=0.927);土壤微生物生物量氮及其对凋落叶分解的响应均未受到施氮的明显影响(PN=0.122,PN×L=0.406)(图4,图3)。
2.3香樟凋落叶分解过程中受体植物与土壤氮指标间的相关性分析
在香樟凋落叶效应表现得最明显的时段(约40~70 d),对受体植物辣椒和土壤的各氮营养指标间进行相关性分析,结果(表1)发现,辣椒全氮、硝态氮含量与土壤硝态氮含量间分别存在极显著的正相关关系(P<0.01,相关系数r分别为0.876和0.869),但与土壤全氮、铵态氮和微生物生物量氮间的相关性均未达显著水平;同时,辣椒的可溶性蛋白含量与各项土壤氮指标间均不存在显著的线性关系。这一结果证实,香樟凋落叶分解条件下土壤硝态氮含量的降低是受体植物体内氮含量降低的直接原因。
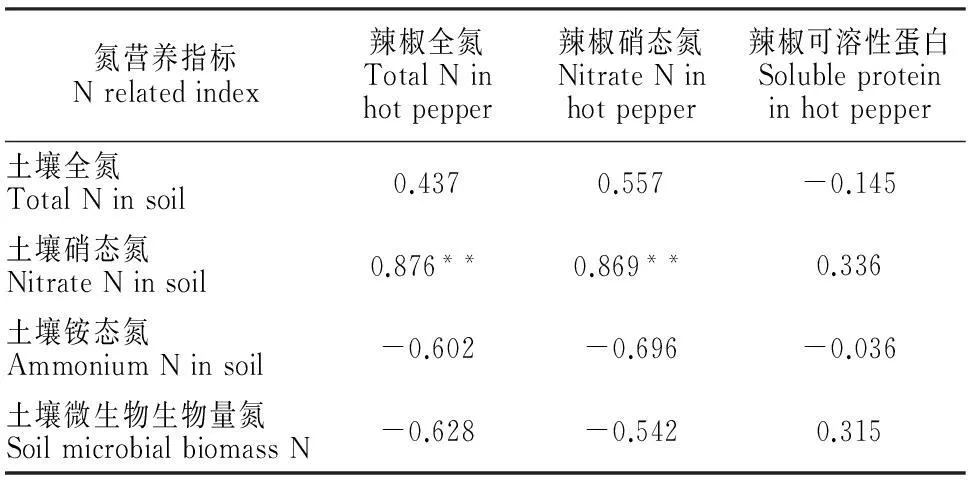
表1 辣椒和土壤氮营养指标间的相关性分析
注:表中数值为Pearson相关系数,样本数为8;**符号表示相关性达到0.01显著水平(临界值ρ0.05=0.707,ρ0.01=0.834)。
Notes:Values in the table show Pearson correlation coefficients (rvalue,n=8),and the symbol ** indicate significant correlation at 0.01 probability level (ρ0.05=0.707 and ρ0.01=0.834).
2.4香樟凋落叶分解后C/N比及其效应的变化
香樟凋落叶原样具有很高的C/N比,高达125.61±4.89。L25、L50和L100处理下凋落叶分解过程中,它们的C/N呈现大体相同的变化规律,即分解48、85和101 d三个时间点彼此间没有显著差异(P>0.05),但均相比于未分解时(0 d)显著减小(P<0.05);它们分解137 d时又均有所回升,其中L50和L100的凋落叶C/N回升至与未分解时没有显著差异(P>0.05)。L25、L50和L100处理下凋落叶C/N在分解48~137 d期间分别为45.45~78.05、63.22~109.64以及70.36~106.17(图5)。这与试验期内香樟凋落叶对受体植物生长表现出的先强后弱的效应规律并不一致,一定程度上说明香樟凋落叶C/N的高低并不是其效应强弱的决定因素,至少不是唯一的决定因素。
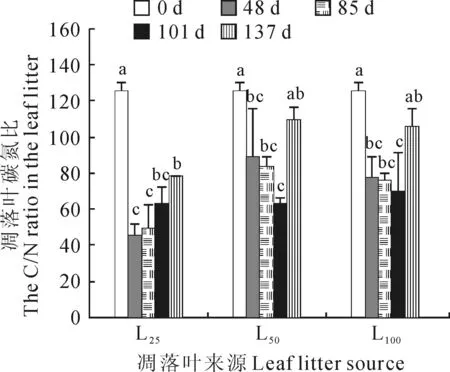
不同字母表示与来自L25、L50和L100处理的
同时,利用分解过的香樟凋落叶所做的生物测试结果(表2)显示,已分解47 d的凋落叶以50和100 g/盆的剂量(L50和L100)处理辣椒,仍然对其叶面积、株高、生物量积累表现出强烈的抑制作用;而分解过120 d和135 d的凋落叶添加到土壤中,在各剂量下均不抑制受体植物的生长,甚至还在100 g/盆处理下对株高和地上生物量表现出显著的促进作用。结合图5的结果,进一步表明香樟凋落叶具有的高C/N不太可能是影响受体植物生长状况的决定因素。
3讨论
许多化感作用研究专注于“供体-受体”这一直接的作用关系,而事实上自然环境中大多数化感物质都要进入土壤,它们通过土壤生化特性而间接地影响受体植物生长足以成为一个重要的方面,这一点已经得到越来越多的关注和认同[13,24-25]。氮元素参与各类重要生物分子如核酸、核苷酸、蛋白质、氨基酸、辅酶、叶绿素等的合成,又被称为生命元素[26]。然而本研究中,受体植物辣椒体内的全氮、硝态氮和可溶性蛋白含量均在香樟凋落叶处理后明显降低,结合前期研究中其各项形态指标和生物量的大幅度减小[10,15],可以确证辣椒的氮素积累及代谢受到了凋落叶分解的不利影响。有研究显示,化感作用能够显著地影响土壤的氮素状况。如Kumar等[24]发现,荞麦(Fagopyrumesculentum)的化感物质导致土壤氮素有效性降低,是绿藜(Amaranthuspowellii)萌发后形态生长受限的主要原因;Mao等[27]在黄芪(Astragalusmongholicus)残体粗提液施入土壤30 d,观察到土壤硝化速率的显著减小。本试验得到了类似的结果,即土壤硝态氮水平在香樟凋落叶分解的至少2个月内剧烈下降,并与辣椒全氮、硝态氮含量的下降间存在极显著的协同关系。植物能够直接利用的土壤氮形态主要是铵态氮和硝态氮,而香樟凋落叶分解并未造成Cheng等[28]报道的亚热带森林凋落物分解过程中土壤铵态氮含量降低的现象,表明土壤硝态氮匮乏是辣椒体内氮营养不足的重要原因。尽管这种影响可能不超过3个月,但足以对生命周期较短的草本植物生长造成重要影响。
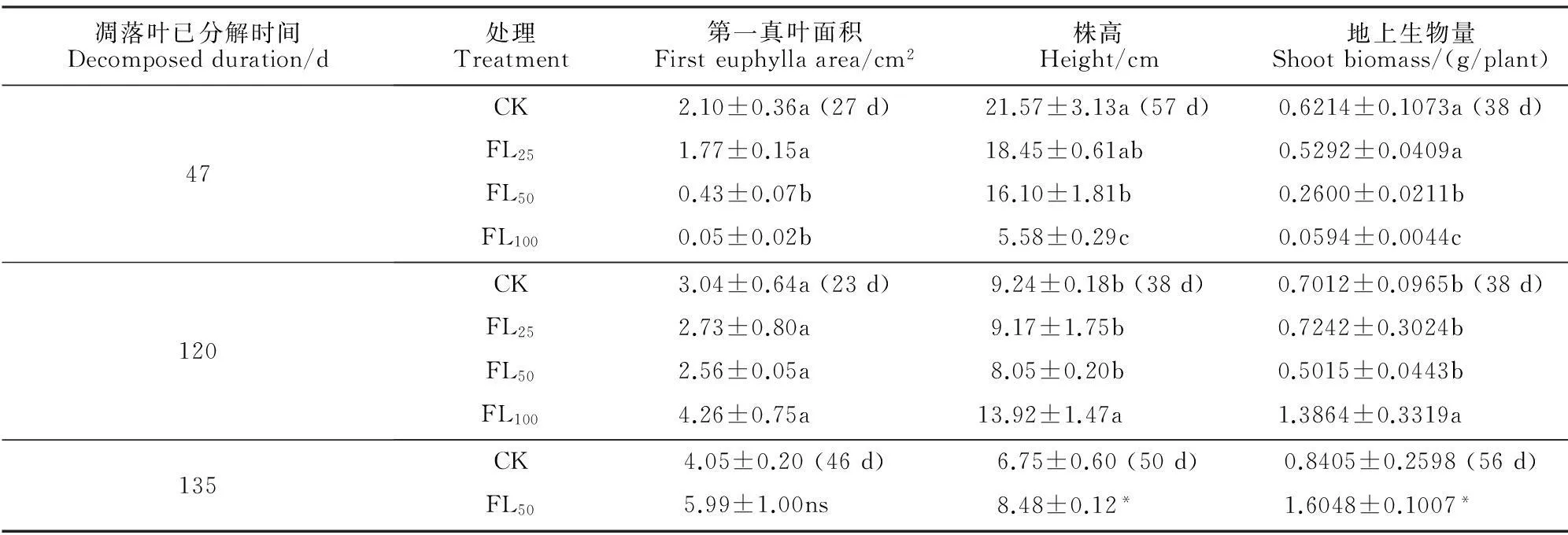
表2 经过不同时间分解的香樟凋落叶添加对辣椒生长的影响
注:括号中的数值表示相应的分解凋落叶处理时间,即对照和各分解凋落叶处理进行相应指标测定的时间;*表示相应处理效应达到0.05显著水平。
Notes:The value in the parenthesis shows the exposure time to corresponding decomposed leaf litter,when the corresponding index was determined for the control and decomposed leaf litter treatments.The symbol * indicates significant difference between the corresponding treatment and the control at 0.05 probability level.
胡桃属(Juglans)植物的特征性化感物质胡桃醌可降低小麦(Triticumaestivum)和玉米(Zeamays)根系的摄氧能力、水分吸收能力和质膜H+-ATP酶活性[29];相似地,阿魏酸处理的黄瓜(Cucumissativus)幼苗根系H+-ATP酶活性降低,质膜受到过氧化伤害,最终根细胞死亡[30]。香樟凋落叶处理后辣椒根系所受的影响,可能不似上述较高浓度化感物质集中处理那样强烈,施氮的迅速缓解作用一定程度上说明了这一点。尿素是一种十分速效的氮肥,能够在土壤中迅速地完成从铵态氮到硝态氮的转化[31-32],因此本试验发现尿素的施用能够快速地补充土壤硝态氮,而在观察时间点没有发现土壤铵态氮含量的整体增多。由于施氮开始于香樟凋落叶效应最强烈的时期,如果辣椒根系受损甚至死亡,即使土壤硝态氮含量得以提升,辣椒体内的氮营养和生长状况也不可能随之快速改善,这暗示香樟凋落叶处理下辣椒根系的吸收功能障碍可能并不是其氮营养匮乏的主要原因,也就再次证实土壤硝态氮的供应减少才是关键。
然而,香樟凋落叶分解初期土壤中硝态氮急剧减少的原因又是什么?根据Hodge等[18]的理论,当分解基质C/N<12.5时,细菌和真菌同时释放氮;当12.5
土壤微生物和土壤酶在养分循环过程中扮演着重要角色。陈慧等[35]发现地黄(Rehmanniaglutinosa)连作导致土壤中主要微生物类群、多种专性细菌和土壤酶发生变化,其中反硝化细菌数量增加;Mao等[27]曾研究发现,黄芪残体浸提液的添加可导致土壤反硝化酶活性显著升高,与土壤硝化速率降低的趋势正好相互印证;化感水稻生长过的土壤及其根系浸提液培养的土壤中放线菌、真菌、细菌和氨化细菌数量均显著低于非化感水稻[36]。香樟凋落叶分解释放的某些化学物质(化感物质),如前期研究中分析推断的樟脑(Camphor)、1,8-桉叶油醇(1,8-Cineole)、香桧烯(Sabinene)等萜类[10],是否通过改变土壤微生物群落结构和土壤酶活性而影响到土壤的硝化过程,成为值得进一步深入研究的内容。
综上所述,香樟凋落叶能在分解初期的至少2个月内造成土壤硝态氮含量的大幅降低,致使受体植物辣椒吸收、积累的硝态氮减少乃至可溶性蛋白、全氮的不足,进而显著制约其生长发育。香樟凋落叶较高的C/N以及土壤微生物对氮素的争夺可能并非主导因素,其分解释放的化学物质干扰土壤生化环境而影响土壤的硝化过程可能才是根本原因。
参考文献:
[1]孙红英,曹光球,辛全伟,等.香樟8个无性系叶绿素荧光特征比较[J].福建林学院学报,2010,30(4):309-313.
SUN H Y,CAO G Q,XIN Q W,etal.Comparisons of chlorophyll fluorescence characteristics among 8Cinnamomumcamphoraclones[J].JournalofFujianCollegeofForestry,2010,30(4):309-313.
[2]郭金耀,杨晓玲.香樟叶提取液的除草与抑菌活性[J].作物杂志,2012,(1):58-61.
GUO J Y,YANG X L.Herbicide and antibacterial activity of the extracts from leaves ofCinnamomumcamphora[J].Crops,2012,(1):58-61.
[3]ZHANG D Q,GUO L L,ZHANG H Y,etal.Analysis of biomedical components of pyrolyzate ofCinnamomumcamphoraroot wood[J].KeyEngineeringMaterials,2011,480-481:225-230.
[4]王琛,廖琰明,吴坚,等.香樟林下几种冷季型草坪草的适应性及其影响因子分析[J].上海交通大学学报(农业科学版),2010,28(1):1-8.
WANG CH,LIAO Y M,WU J,etal.Turfgrass evaluation and analysis of factors inhibiting turfgrass growth under camphor trees[J].JournalofShanghaiJiaotongUniversity(Agr.Sci.),2010,28(1):1-8.
[5]LIU C H,MISHRA A K,TAN R X,etal.Repellent and insecticidal activities of essential oils fromArtemisiaprincepsandCinnamomumcamphoraand their effect on seed germination of wheat and broad bean[J].BioresourceTechnology,2006,97(15):1 969-1 973.
[6]OKAMOTO Y,YAMAJI K,KOBAYASHI K.Allelopathic activity of camphor released from camphor tree (Cinnamomumcamphora)[J].AllelopathyJournal,2011,27:123-132.
[7]孔垂华,胡飞.植物化感(相生相克)作用及其应用[M].北京:中国农业出版社,2001.
[8]CHOU C H.Introduction to allelopathy[M] //REIGOSA M J,PEDROL N,GONZÉLEZ L.Allelopathy:A Physiological Process with Ecological Implications.Dordrecht:Springer,2006:1-10.
[9]田楠,刘增文,时腾飞.12种林(果)粮间作树种枯落叶分解对玉米的化感效应[J].农业环境科学学报,2013,32(5):1 000-1 008.
TIAN N,LIU Z W,SHI T F.Allelopathic effects of 12 trees leaf litter decomposition on maize in interplanting of trees (fruits) and crops[J].JournalofAgro-EnvironmentScience,2013,32(5):1 000-1 008.
[10]陈洪,胡庭兴,王茜,等.香樟凋落叶分解物对辣椒生长发育的影响[J].西北植物学报,2014,34(12):2 525-2 534.
CHEN H,HU T X,WANG Q,etal.Effect of decomposing leaf litter ofCinnamomumcamphoraon growth and development ofCapsicumannuum[J].ActaBot.Boreal.-Occident.Sin.,2014,34(12):2 525-2 534.
[11]ANDRIANJAFINANDRASANA S N,ANDRIANOELISOA H S,JEANSON M L,etal.Allelopathic effects of volatile compounds of essential oil fromRavensaraaromaticaSonnerat chemotypes[J].AllelopathyJournal,2013,31(2):333-343.
[12]WANG R L,PENG S L,ZENG R S,etal.Cloning,expression and wounding induction of β-caryophyllene synthase gene fromMikaniamicranthaH.B.K.and allelopathic potential of β-caryophyllene[J].AllelopathyJournal,2009,24(1):35-44.
[13]王朋,王莹,孔垂华.植物挥发性单萜经土壤载体的化感作用-以三裂叶豚草(AmbrosiatrifidaL.)为例[J].生态学报,2008,28(1):62-68.
WANG P,WANG Y,KONG C H.Allelopathy of plant volatile monoterpenes mediated by soil:A case study ofAmbrosiatrifidaL.[J].ActaEcologicaSinica,2008,28(1):62-68.
[14]FOY C L.How to make bioassays for allelopathy more relevant to field conditions with particular reference to cropland weeds[M]//INDERJIT D,DAKSHINI K M M,FOY C L.Principles and Practices in Plant Ecology:Allelochemical Interactions.New York:CRC Press,1999:25-34.
[15]陈洪,胡庭兴,王茜,等.香樟凋落叶分解对辣椒生长的抑制作用及施氮的缓解效应[J].应用生态学报,2015,26(2):457-465.
CHEN H,HU T X,WANG Q,etal.Inhibition of decomposing leaf litter ofCinnamomumcamphoraon growth ofCapsicumannuumand the alleviation effect of nitrogen application[J].ChineseJournalofAppliedEcology,2015,26(2):457-465.
[16]吴秀华,胡庭兴,杨万勤,等.巨桉凋落叶分解对菊苣生长及光合特性的影响[J].应用生态学报,2012,23(1):1-8.
WU X H,HU T X,YANG W Q,etal.Effects ofEucalyptusgrandisleaf litter decomposition on the growth and photosynthetic characteristics ofCichoriumintybus[J].ChineseJournalofAppliedEcology,2012,23(1):1-8.
[17]LI Y,HU T,DUAN X,etal.Effects of decomposing leaf litter ofEucalyptusgrandison the growth and photosynthetic characteristics ofLoliumperenne[J].JournalofAgriculturalScience,2013,5(3):123-131.
[18]HODGE A,ROBINSON D,FITTER A.Are microorganisms more effective than plants at competing for nitrogen?[J].TrendsinPlantScience,2000,5(7):304-308.
[19]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[20]熊庆娥.植物生理学实验教程[M].成都:四川科学技术出版社,2003.
[21]鲍士旦.土壤农化分析(第3版)[M].北京:中国农业出版社,2000.
[22]WU J,JOERGENSEN R G,POMMERENING B,etal.Measurement of soil microbial biomass C by fumigation-extraction-an automated procedure[J].SoilBiologyandBiochemistry,1990,22:1 167-1 169.
[23]李振高,骆永明,滕 应.土壤与环境微生物研究法[M].北京:科学出版社,2008.
[24]KUMAR V,BRAINARD D C,BELLINDER R R.Suppression of powell amaranth (Amaranthuspowellii) by buckwheat residues:role of allelopathy[J].WeedScience,2009,57:66-73.
[25]CIPOLLINI D,RIGSBY C M,BARTO E K.Microbes as targets and mediators of allelopathy in plants[J].JournalofChemicalEcology,2012,38:714-727.
[26]潘瑞炽.植物生理学(第5版)[M].北京:高等教育出版社,2004.
[27]MAO J,YANG L,SHI Y,etal.Crude extract ofAstragalusmongholicusroot inhibits crop seed germination and soil nitrifying activity[J].SoilBiologyandBiochemistry,2006,38:201-208.
[28]CHENG Y,WANG J,ZHANG J B,etal.The mechanism behind reduced NH4+and NO3-accumulation due to litter decomposition in the acidic soil of subtropical forest[J].PlantandSoil,2014,378:295-308.
[29]HEJL A M,KOSTER K L.Juglone disrupts root plasma membrane H+-ATPase activity and impairs water uptake,root respiration,and growth in soybean (Glycinemax) and corn (Zeamays)[J].JournalofChemicalEcology,2004,30(2):453-471.
[30]DING J,SUN Y,XIAO C L,etal.Physiological basis of different allelopathic reactions of cucumber and figleaf gourd plants to cinnamic acid[J].JournalofExperimentalBotany,2007,58(13):3 765-3 773.
[31]张绍林,朱兆良,徐银华.黄泛区潮土-冬小麦系统中尿素的转化和化肥氮去向[J].核农学报,1989,3(1):9-15.
ZHANG S L,ZHU Z L,XU Y H.The transformation of urea and the fate of fertilizer nitrogen in fluvo-aquic soil-winter wheat system in flooded plain of Huanghe River[J].ActaAgriculturaeNucleataeSinica,1989,3(1):9-15.
[32]陈振华,陈利军,武志杰.脲酶-硝化抑制剂对减缓尿素转化产物氧化及淋溶的作用[J].应用生态学报,2005,16(2):238-242.
CHEN Z H,CHEN L J,WU Z J.Effects of urease and nitrification inhibitors on alleviating the oxidation and leaching of soil urea's hydrolyzed product ammonium[J].ChineseJournalofAppliedEcology,2005,16(2):238-242.
[33]SONG X Z,ZHANG H L,CHANG S X,etal.Elevated UV-B radiation increased the decomposition ofCinnamomumcamphoraandCyclobalanopsisglaucaleaf litter in subtropical China[J].JournalofSoilsandSediments,2012,12:307-311.
[34]BONANOMI G,INCERTI G,BARILE E,etal.Phytotoxicity,not nitrogen immobilization,explains plant litter inhibitory effects:evidence from solid-state13C-NMR spectroscopy[J].NewPhytologist,2011,191(4):1 018-1 030.
[35]陈慧,郝慧荣,熊君,等.地黄连作对根际微生物区系及土壤酶活性的影响[J].应用生态学报,2007,18(12):2 755-2 759.
CHEN H,HAO H R,XIONG J,etal.Effects of successive croppingRehmanniaglutinosaon rhizosphere soil microbial flora and enzyme activities[J].ChineseJournalofAppliedEcology,2007,18(12):2 755-2 759.
[36]KONG C H,WANG P,ZHAO H,etal.Impact of allelochemical exuded from allelopathic rice on soil microbial community[J].SoilBiologyandBiochemistry,2008,40:1 862-1 869.
(编辑:裴阿卫)
Limitation of AllelopathicCinnamomumcamphoraLeaf Litter on Nitrogen Nutrition inCapsicumannuumand Soil
CHEN Hong1,2,MA Guangliang2,WANG Guangjian2,LI Chengxiang2,JIANG Xue1,WANG Rui2,HU Tingxing1*
(1 College of Forestry,Sichuan Agricultural University,Chengdu 611130,China;2 Luzhou Forest Scientific Research Institute,Luzhou,Sichuan 646000,China)
Abstract:Modifications of morphological and developmental growth,photosynthetic characteristics and reactive oxygen species metabolism in the receiver plant as affected by decomposing camphor tree (Cinnamomum camphora) leaf litter have been preliminarily revealed in the previous work.As a continuation,another pot experiment (25,50 and 100 g leaf litter was severally mixed with 10 kg soil and loaded into the pot,the control was free of leaf litter) was conducted to investigate the effects of decomposing camphor tree leaf litter on nitrogen status in the receiver plant hot pepper (Capsicum annuum) and soil,the modification of exogenous N (urea) input on these effects,and whether these effects could be explained by soil microbial N immobilization,which was hypothetically attributed to a high C/N ratio in the leaf litter.The results showed that:(1)nitrate N,soluble protein and total N in hot pepper seedlings were all decreased sharply and significantly after exposure to different doses of the leaf litter (25-100 g per pot),in at least two months.(2)The decrease of soil nitrate N was significantly consistent with that of plant nitrate N and total N with the increasing leaf litter dose,while soil microbial biomass N was generally higher treated by the leaf litter compared to the control,and much slighter alterations were found in soil ammonium N and total N.(3)N application not only elevated N nutrition level in hot pepper and nitrate N in soil exposed to each leaf litter treatment,but also decreased the inhibitory effect of camphor tree leaf litter on these indices.(4)The initial C/N ratio in the leaf litter is high (125.61±4.89),and this ratio maintained at values much higher after 48 day to 137 day decomposition than the hypothesized critical value range,located in or/and surpass which soil microbial N immobilization would occur.However,no limited growth in hot pepper was observed after application of the leaf litter that has decomposed for 120 and 135 days,though possessing high C/N ratio.It is concluded that some chemicals released during the decomposition of camphor tree leaf litter interfere with the nitrification process and decreased nitrate N in soil,resulting in reduction of N absorption and accumulation in the receiver plant.While,N immobilization caused by soil microbes,despite the high C/N ratio in the leaf litter,plays a secondary role in the effect of decomposing leaf litter stated previously.
Key words:Cinnamomum camphora;leaf litter decomposition;nitrogen nutrition;C/N ratio;allelopathic effect
中图分类号:Q945.79;Q948.118
文献标志码:A
作者简介:陈洪(1988-),男,博士,主要从事森林生态学相关研究。E-mail:hongchen4117@163.com*通信作者:胡庭兴,教授,博士生导师,主要从事林木栽培生理与森林生态学相关研究。E-mail:hutx001@aliyun.com
基金项目:国家“十二五”科技支撑计划项目(2011BAC09B05);中央财政林业科技推广示范项目([2011]TK省06号);四川省“十二五”农作物育种攻关项目(2011NZ0098-10)
收稿日期:2015-11-14;修改稿收到日期:2016-01-04
文章编号:1000-4025(2016)01-0106-10
doi:10.7606/j.issn.1000-4025.2016.01.0106
