病毒诱导基因沉默鉴定穿心莲内酯生物合成关键酶ApCPS功能
2016-03-23谌琴琴李聪聪付羽萍
谌琴琴,刘 琴,李聪聪,付羽萍,王 强*
(1 四川农业大学 生态农业研究所,成都 611130;2 四川农业大学 动物医学院,成都 611130)
病毒诱导基因沉默鉴定穿心莲内酯生物合成关键酶ApCPS功能
谌琴琴1,刘琴1,李聪聪1,付羽萍2,王强1*
(1 四川农业大学 生态农业研究所,成都 611130;2 四川农业大学 动物医学院,成都 611130)
摘要:该研究采用病毒诱导基因沉默技术(VIGS),以生长到第8片真叶期的穿心莲植株为实验材料,沉默参与穿心莲内酯生物合成的ent-柯巴基焦磷酸合酶基因(ApCPS),用半定量和荧光定量PCR检测病毒诱导沉默后ApCPS及其上游基因的表达,用HPLC法检测ApCPS沉默后穿心莲内酯的积累变化,同时检测茉莉酸甲酯(MeJA)处理后ApCPS及上游基因的表达,以全面分析穿心莲内酯代谢以及ApCPS在穿心莲内酯生物合成中的作用机制,验证其在植物体内的功能。结果显示:(1)ApCPS基因被成功沉默,基因表达显著下调,进而引起上游牻牛儿基牻牛儿基焦磷酸合成酶基因(GGPS)的表达下调,而3-羟-3-甲基戊二酰辅酶A还原酶基因(HMGR)和1-脱氧木酮糖-5-磷酸合成酶基因(DXS)的表达未受影响。(2)ApCPS基因沉默15 d后穿心莲内酯积累量显著下降,表明ApCPS是穿心莲内酯生物合成关键酶基因,且能够负反馈影响上游基因表达。(3)茉莉酸甲酯(MeJA)显著诱导ApCPS及上游基因HMGR、DXS和GGPS的表达,表明穿心莲内酯生物合成基因受到MeJA的广泛调控。该研究首次使用VIGS证明ApCPS参与到穿心莲内酯生物合成,为利用该技术鉴定穿心莲内酯生物合成途径中其他基因功能奠定了基础。
关键词:VIGS;ent-柯巴基焦磷酸合酶;穿心莲内酯;生物合成;基因表达
中药穿心莲是爵床科穿心莲属植物穿心莲[Andrographispaniculata(Burm.f.) Nees]的干燥地上部分,又名一见喜、印度草、榄核莲,味苦,是清热解毒、抗菌消炎之要药[1]。现代药理研究表明穿心莲具有抗肿瘤[2-3]、抗病毒[4]、免疫调节及肝保护作用[5]等,主要药效成分是穿心莲内酯和脱水穿心莲内酯。 但穿心莲内酯类化合物的生物合成途径还未被解析,限制了其在合成生物学领域的研究。
穿心莲内酯是由1个五元内酯环和1个半日花烷型双环骨架组成的二萜内酯[6],具有萜类化合物共同前体焦磷酸异戊烯酯(IPP)和焦磷酸γ,γ-二甲基烯丙酯(DMAPP)。IPP和DMAPP是由细胞质中的甲羟戊酸途径(MVA)或质体中的2C-甲基-4-磷酸-4D-赤藓糖醇途径(MEP)生成的[7]。MVA途径主要为生成倍半萜、三萜等提供前体,MEP途径为单萜、二萜和四萜等提供前体。二萜是以3个IPP和1个DMAPP头尾相连形成的牻牛儿基牻牛儿醇焦磷酸酯(geranylgeranyl pyrophosphate,GGPP)为直接前体[8],由二萜合酶催化成环,并经后续的氧化修饰形成[9]。穿心莲中的一个二萜合酶-ent-柯巴基焦磷酸合酶(ent-copalyl diphosphate synthase,简称ApCPS)的基因序列已被报道[10]。本实验室用原核表达和微生物代谢工程技术鉴定了ApCPS的生化功能,即催化GGPP生成ent-焦磷酸古巴酯(ent-CPP),该反应为穿心莲内酯生物合成重要步骤,可能是穿心莲内酯生物合成的一个关键酶[11],但该途径在赤霉素生物合成中也存在,因此ApCPS的体内功能仍需进一步验证。
病毒诱导基因沉默技术(virus-induced gene silencing,VIGS)是一个有效的反向遗传学工具,被广泛应用于植物基因体内功能鉴定,如番茄[12]、烟草[13]等植物。在中草药中,Singh[14]利用VIGS成功沉默了南非醉茄中的SQS基因,减少了植物体内醉茄内酯的积累;Li[15]利用VIGS在天仙子中鉴定了一个参与莨菪烷生物合成的细胞色素P450的功能。作者前期以穿心莲中的八氢番茄红素脱氢酶基因(ApPDS)为报告基因,用烟草脆裂病毒(tobacco rattle virus,TRV)为载体在穿心莲体内建立了病毒诱导基因沉默体系[16]。本研究利用TRV-VIGS在穿心莲叶片中沉默ApCPS,并使用HPLC法测定沉默后叶片中穿心莲内酯的含量,同时通过qRT-PCR技术检测穿心莲内酯生物合成上游基因和ApCPS的表达水平,研究了ApCPS在穿心莲内酯生物合成中的作用机制,并验证了其在植物体内的功能。
1材料和方法
1.1材料
穿心莲种子收集于广西贵港,种植在人工气候室,生长条件为14 h光照(28 ℃)和10 h黑暗(25 ℃)。经四川农业大学王强教授完成鉴定。
1.2方法
1.2.1VIGS载体构建根据NCBI上已报道ApCPS基因序列(GenBank登录号 KP982892)及pTRV2(ABRC)的多克隆位点,使用软件Oligo 7和Primer 3设计1对克隆引物ApCPS-TRV-F(BamHⅠ)和pCPS-TRV-R(XhoⅠ)(表1),以含有全长ApCPS的pGEM-T载体为模板,进行PCR扩增,胶回收纯化得到一段473 bp的核心保守片段rCPS。使用BamHⅠ和XhoⅠ对回收产物及pTRV2进行双酶切,回收的酶切产物用T4-DNA(TaKaRa)连接酶连接,连接产物转化TOP10感受态细胞(TIANGEN),通过菌落PCR及质粒酶切鉴定获得重组表达载体pTRV2-rCPS。
1.2.2农杆菌浸染分别将pTRV1(ABRC)和pTRV2-rCPS用冻融法转化农杆菌菌株GV3101(本实验室保存),48 h后挑取单菌落接入5 mL LB培养基(含50 mg/L卡那霉素,50 mg/L利福平,50 mg/L庆大霉素)28 ℃过夜培养活化,次日将活化过的菌液加入到50 mL含有10 mmol/L 2-吗啉乙磺酸(MES)和20 μmol/L乙酰丁香酮(AS)的带抗生素的LB液体培养基中,28 ℃过夜培养,离心收集农杆菌菌体。用侵染缓冲液(10 mmol/L MgCl2,10 mmol/L MES,200 μmol/L AS)悬浮菌体,调整OD600为1.0,室温下放置3 h后侵染。穿心莲内酯在生长阶段的叶片中积累最快[17],所以选择8叶期植株进行侵染。侵染时将含有pTRV1和pTRV2-rCPS的农杆菌1∶1混合,用无针头的注射器在叶片背面注射,使菌液充满整个叶片,每颗苗注射2~4片叶子。将注射后的植株放在22 ℃的恒温培养箱中连续光照12 h,后正常培养。
1.2.3基因表达检测取浸染农杆菌15 d后的叶片提取总RNA,以Oligo(dT)为引物,用M-MLV反转录酶(TaKaRa)合成cDNA。使用半定量和荧光定量PCR检测ApCPS基因沉默效果。ApCPS基因及内参Actin基因(GenBank登录号JX444056)的半定量及荧光定量检测引物见表1。半定量PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸1 min;30个循环;72 ℃延伸7 min;4 ℃保存。PCR产物用1%的琼脂糖凝胶电泳检测。荧光定量PCR使用SsoFast Eva Green Supermix试剂在CFX96荧光定量PCR仪(Bio-Rad)上进行检测。反应条件为:95 ℃预变性3 min;95 ℃变性15 s;55 ℃退火15 s;72 ℃延伸20 s;40个循环。每个样品均设3个重复,采用仪器自带软件Bio-Rad CFX manager按2-ΔCt法处理数据,使用Excel 2010作图。
用100 μmol/L MeJA处理8叶期穿心莲植株,在0、6、12、24和48 h取样,提取RNA并合成cDNA用于检测穿心莲内酯生物合成上游基因GGPS(GenBank登录号AJ973133)、HMGR(GenBank登录号AY254389)和DXS(GenBank登录号AY254390)的表达,引物见表1。
1.2.4HPLC法测定含量(1)对照品穿心莲内酯,脱水穿心莲内酯 (批号分别为110797-200307和110854-201007),购自中国食品药品检定研究院。精密称取穿心莲内酯和脱水穿心莲内酯对照品,加甲醇制成5 g/L贮备液。
(2)色谱条件高效液相色谱仪(Agilent-1100),色谱柱Agilent C18(4.6 mm×250 mm,5 μm);流动相甲醇(A)-水(B),梯度洗脱(0~12 min,30 ~60% A;12~20 min,60% A;20~23 min,60%~30% A;23~25 min,30% A);柱温25 ℃;穿心莲内酯和脱水穿心莲内酯检测波长分别为225和254 nm;流速0.8 mL/min[18];进样量10 μL。穿心莲内酯和脱水穿心莲内酯的保留时间分别是9.4和16.5 min,与其他组分分离良好。
(3)标准曲线的制作取对照品贮备液稀释成5个不同浓度的对照品溶液,分别进样10 μL,记录峰面积,以峰面积对标品含量进行回归分析,即得对照品的标准曲线。回归方程为:穿心莲内酯,Y=1 983X+1 500.1(R2=0.999 1);脱水穿心莲内酯,Y=1 623.4X+68.967(R2=0.999 7)。
(4)供试品溶液的制备称取穿心莲叶片鲜重0.5 g,研匀,加入10 mL甲醇,浸渍1 h,超声处理(功率220 W,频率33 kHz)30 min,4 000 r/min离心10 min,取上清;沉淀用10 mL甲醇再提取1次,合并后用旋转蒸发仪浓缩后用甲醇溶解定容至1 mL,HPLC测定含量前用0.45 μm的滤膜过滤,各处理4个生物学重复,每个样品取自4棵植株,3个重复。相对积累量的计算方法:
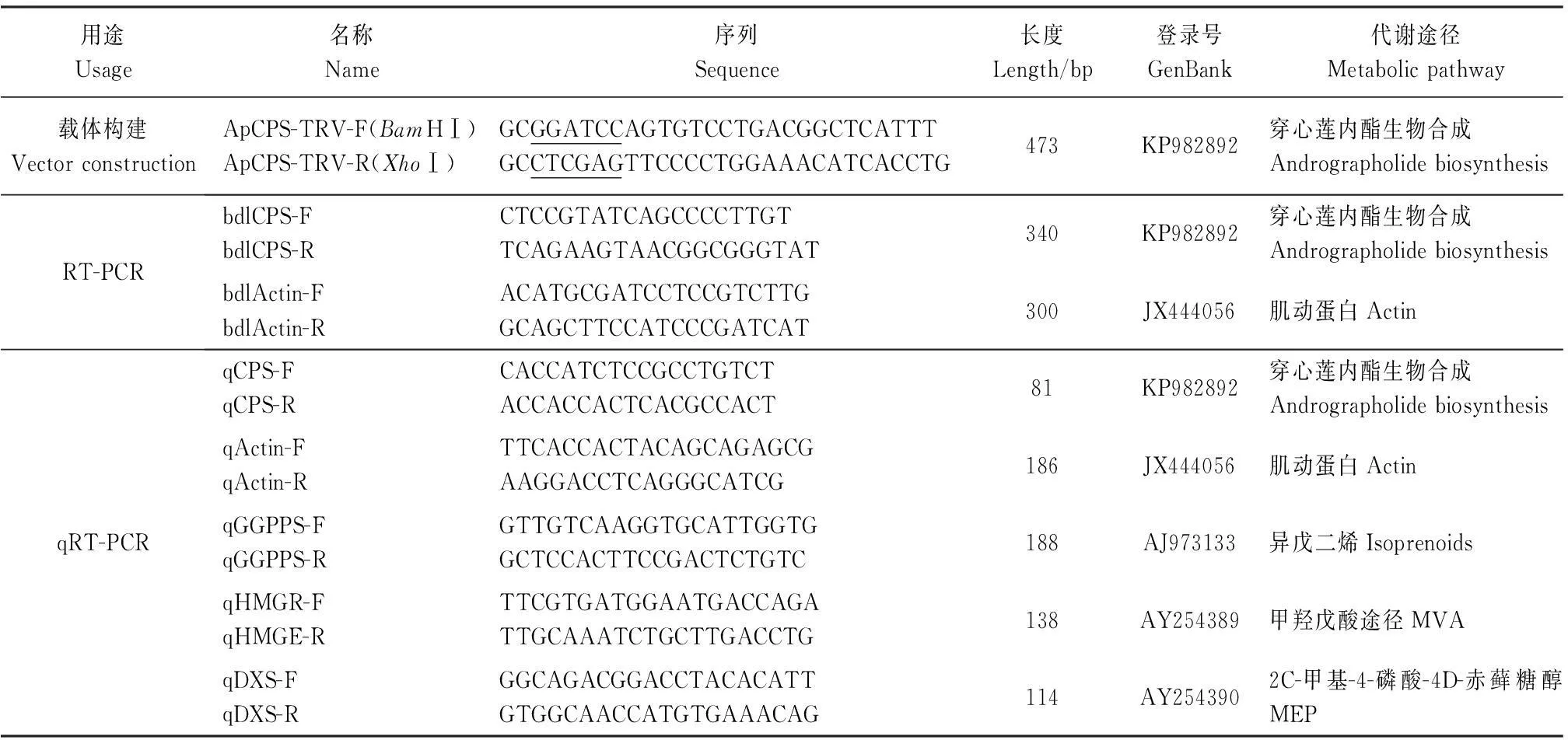
表1 片段扩增及检测引物
注:下划线为酶切位点序列。
Note:The underline for enzyme locus sequence.
穿心莲内酯相对积累量=(浸染15 d后内酯含量-8叶期内酯含量)/8叶期内酯含量×100%
2结果与分析
2.1RT-PCR及qRT-PCR检测ApCPS基因表达
采用叶片注射法浸染穿心莲8叶期植株(图1,A)。15 d后观察,侵染pTRV2-rCPS与空载体pTRV2的植株没有明显的表型差异(图1,B)。取浸染后生长15 d的叶片进行基因表达的检测,RT-PCR检测发现ApCPS基因表达有明显的下调(图1,C)。进一步使用qRT-PCR定量检测发现ApCPS基因表达下调了49.8%(图1,D),证明ApCPS基因被pTRV2-rCPS病毒载体成功沉默,效果明显。
2.2沉默ApCPS后穿心莲内酯的积累变化
收集穿心莲8叶期及农杆菌浸染15 d后的叶片,HPLC法测定体内穿心莲内酯及脱水穿心莲内酯含量。结果显示相对于8叶期,生长15 d后的TRV空白对照和ApCPS沉默植株中穿心莲内酯含量均显著增加(图2,A),相对于8叶期的积累量分别增加了106.43%和52.91%,但ApCPS沉默植株中穿心莲内酯积累量显著低于空白对照(图2,B)。沉默ApCPS基因导致穿心莲内酯的积累量显著下降,符合其生化功能分析[11],证明ApCPS催化
穿心莲内酯生物合成关键步骤。脱水穿心莲内酯在整个生长期含量较低,差异变化不明显。
2.3穿心莲内酯生物合成上游基因的表达检测
穿心莲内酯含量可以被茉莉酸甲酯(MeJA)诱导增加[19],ApCPS基因表达也能够被MeJA诱导[11]。为了分析穿心莲内酯生物合成上游基因是否与ApCPS具有相同表达模式,对穿心莲MVA途径中的HMGR、MEP途径中的DXS以及生成ApCPS催化底物GGPP的GGPS基因进行了qRT-PCR分析。结果(图3,A)显示,MeJA处理穿心莲后,ApCPS在12 h被诱导表达量达到最大,HMGR、DXS、GGPS在6 h分别被诱导上调了9.08、3.31和5.80倍,除了HMGR在12 h持续被诱导表达外,DXS和GGPS在12 h已恢复到正常表达水平。病毒诱导ApCPS基因沉默后,HMGR和DXS的表达没有受到影响,但GGPS的表达下调了64.36 %(图3,B),暗示穿心莲内酯生物合成中有负反馈调节机制的存在。

A.叶片注射法浸染8叶期的穿心莲;B.沉默ApCPS基因15 d后的

A.8叶期及浸染生长15 d后穿心莲内酯含量;B.穿心莲内酯的相对积累量。图中的TRV表示浸染pTRV2的空白对照植株,
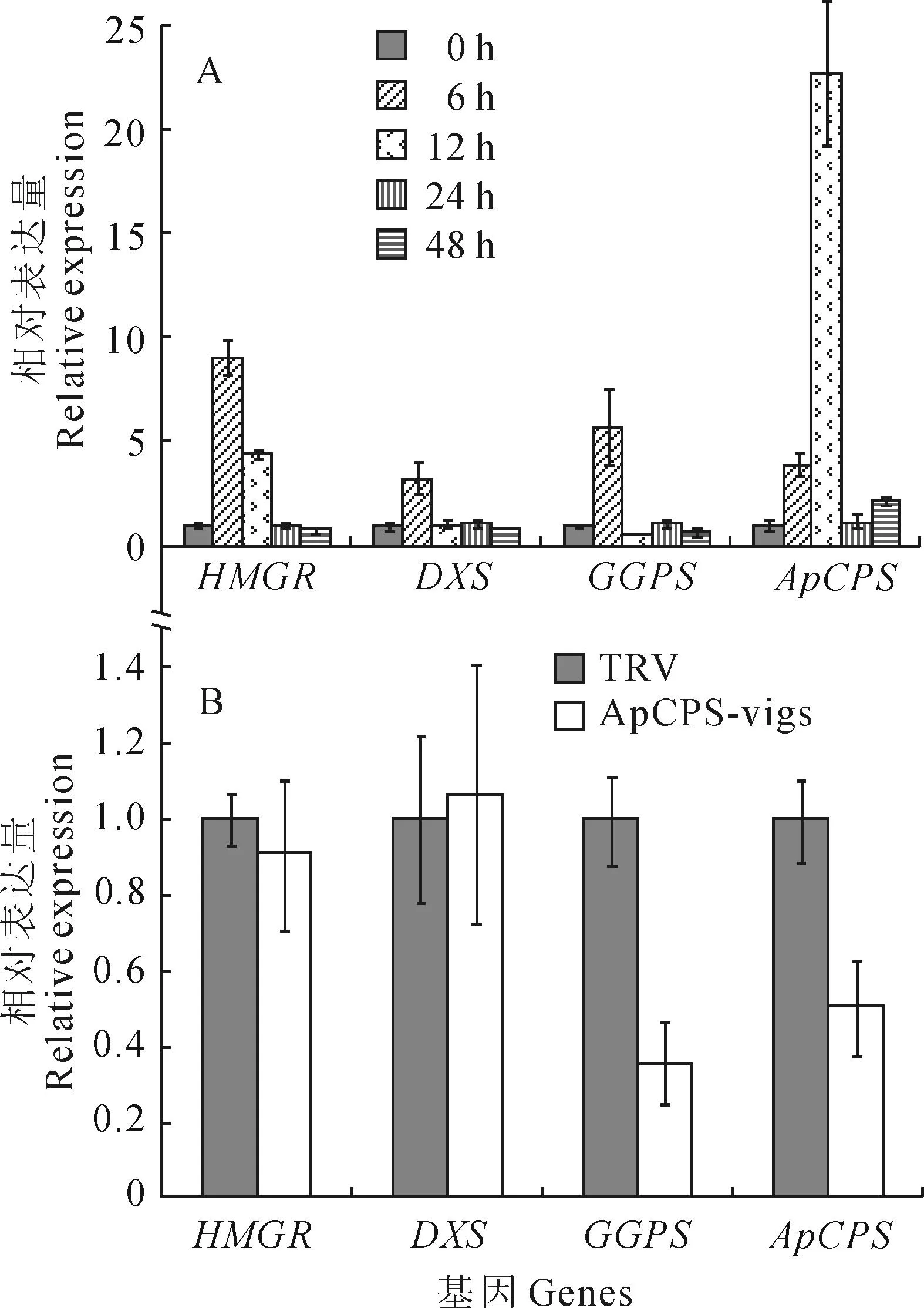
图3 ApCPS上游基因在MeJA诱导(A)和
3讨论
本研究使用VIGS法成功沉默了穿心莲叶片中ApCPS的基因表达,通过HPLC法检测到穿心莲内酯积累量明显下降,证明ApCPS在植物体内参与穿心莲内酯生物合成,符合以往的生化研究[11]。同时ApCPS基因沉默后,穿心莲植株并未有表型变化,显示赤霉素代谢未受到影响。
在ApCPS被MeJA诱导上调后,上游的HMGR、DXS和GGPS也被诱导上调,并且诱导时间早于ApCPS,表明MeJA能够广泛调控穿心莲萜类代谢相关基因表达,和以往研究中MeJA诱导穿心莲悬浮细胞穿心莲内酯积累的结果一致[19]。MeJA处理能引起植物的抗病反应[20],本研究中MeJA诱导穿心莲MVA途径的HMGR上调水平明显大于MEP途径的DXS,推测MVA途径增加的法尼基焦磷酸用来参与甾醇生物合成,改变细胞膜结构去抵抗MeJA模拟的病原菌浸染。ApCPS被沉默后,GGPS的基因表达显著降低,可能是ApCPS催化底物GGPP的积累负反馈调节上游基因GGPS的表达,但早期的HMGR、DXS并没有受到影响,暗示穿心莲内酯生物合成调控主要集中在GGPS和ApCPS这两个基因。然而ApCPS沉默后其下游基因的表达情况,以及与其它萜类代谢流之间的相互作用仍不清楚,需要进一步的研究。
大多数的药用植物的遗传转化技术发展都比较滞后,使用VIGS技术鉴定重要药用成分的生物合成基因功能是一个可靠便捷的方法。然而VIGS技术由于病毒载体的局限性,能用于此方法的植物仍有限,即使对于现在常用的表达稳定、沉默效果好、对植物毒副作用小的TRV病毒载体适用范围也是较低的,所以获得适用范围广的病毒载体是急需解决的问题[21]。另外作者在实验中尝试过不同的农杆菌浸染方法,最后用针尖刺伤叶片后再用无针头注射器注射农杆菌的沉默效果最好,并且注射8叶期之前的幼苗存活率较低,表明针对不同植物应当筛选最佳的侵染时期和方法。
参考文献:
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:268.
[2]韩光,杜钢军,许启泰.穿心莲二萜内酯类化合物的合成及抗肿瘤构效关系研究[J].中国药学杂志,2008,43(10):790-794.
HAN G,DU G J,XU Q T.Studies on synthesis and antitumor structure-activity relationship of diterpene lactones ofAndrographispanniculataNees[J].ChinesePharmaceuticalsJournal,2008,43(10):790-794.
[3]张丹丹,陈娟娟,方建国,等.穿心莲抗人巨细胞病毒的体外实验研究[J].医药导报,2010,29(6):703-707.
ZHANG D D,CHEN J J,FANG J G,etal.Anti-cytomegalovirus effect of andrographis paniculatainvitro[J].HeraldofMedicine,2010,29(6):703-707.
[4]平静,王思源,谢宁,等.穿心莲内酯磺化物体外抗腺病毒药效学研究[J].中国实验方剂学杂志,2012,18(21):175-178.
PING J,WANG S Y,XIE N,etal.A study of anti-adenovirus effect of andrographolide sulfonatedinvitro[J].ChineseJournalofExperimentalTraditionalMedicalFomulae,2012,18(21):175-178.
[5]江冬青,罗晓红,谢智颖,等.穿心莲临床药理研究概况[J].国际中医中药杂志,2013,35(11):1 030-1 032.
JIANG D Q,LUO X H,XIE ZH Y,etal.Overview of clinical pharmacology ofAndrographispaniculata[J].InternationalJournalofTraditionalChineseMedicine,2013,35(11):1 030-1 032.
[6]郗砚彬,巢志茂,魏少荫,等.穿心莲中半日花烷型二萜内酯化学成分和药理活性研究进展[J].国际中医中药杂志,2007,29(2):100-103.
XI Y B,CHAO Z M,WEI S Y,etal.Research progress labdane ditepene lactone and pharmacological activityinAndrographispaniculata(Burm.f.) Nees[J].InternationalJournalofTraditionalChineseMedicine,2007,29(2):100-103.
[7]VRANOVA E,COMAN D,GRUISSEM W.Network analysis of the MVA and MEP pathways for iso-prenoid synthesis[J].AnnualReviewofPlantBiology,2013,64:665-700.
[8]CHEN F,THOLL D,BOHLMANN J,etal.The family of terpene synthases in plants:a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom[J].ThePlantJournal,2011,66(1):212-229.
[9]THOLL D.Terpene synthases and the regulation,diversity and biological roles of terpene metabolism[J].CurrentOpinioninPlantBiology,2006,9(3):297-304.
[10]姚攀,陈慧芝,李竹君,等.穿心莲ent-柯巴基焦磷酸合酶基因的克隆与生物信息学分析[J].生物技术通报,2012,10:156-162.
YAO P,CHEN H Z,LI Z J,etal.Cloning and bioinformatic analysis of a cDNA encoding a putative ent-copalyl diphosphate synthase fromAndrographispaniculata(Burm.f.) Nees[J].BiotechnologyBulletin,2012,10:156-162.
[11]SHEN Q Q,LI L X,JIANG Y,etal.Functional characterization ofent-copalyl diphosphate synthase fromAndrographispaniculatawith putative involvement in andrographolides biosynthesis[J].BiotechnologyLetters,2015,DOI:10.1007/s10529-015-1961-7(online).
[12]FANTINI E,FALCONE G,FRUSCIANTE S,etal.Dissection of tomato lycopene biosynthesis through virus-induced gene silencing[J].PlantPhysiology,2013,163(2):986-998.
[13]朱峰,张萍,林宏辉,等.本生烟NbSABP2和NbSAMT基因的克隆及VIGS表达载体构建[J].四川大学学报,2012,49(2):453-458.
ZHU F,ZHANG P,LIN H H,etal.Construction of VIGS expression vector carryingNbSABP2 andNbSAMTgenes cloned fromNicotianabenthamiana[J].JournalofSichuanUniversity,2012,49(2):453-458.
[14]SINGH A K,DWIVEDI V,RAI A,etal.Virus-induced gene silencing ofWithaniasomniferasqualene synthase negatively regulates sterol and defence-related genes resulting in reduced with anolides and biotic stress tolerance[J].PlantBiotechnologyJournal,2015,13(3):1-13.
[15]LI R,REED D W,LIU E,etal.Functional genomic analysis of alkaloid biosynthesis inHyoscyamusnigerreveals a cytochrome P450involved in littorine rearrangement[J].ChemistryBiology,2006,13(5):513-520.
[16]谌琴琴,李丽霞,战鹏林,等.穿心莲八氢番茄红素脱氢酶ApPDS的基因克隆及功能鉴定[J].中国中药杂志,2015,40(19):3 760-3 765.
SHEN Q Q,LI L X,ZHAN P L,etal.Cloning and functional characterization of phytoene desaturase inAndrographispaniculata(Burm.f.)[J].ChinaJournalofChineseMateriaMedica,2015,40(19):3 760-3 765.
[17]PHOLPHANA N,RANGKADILOK N,SAEHUN J,etal.Changes in the contents of four active diterpenoids at different growth stages inAndrographispaniculata(Burm.f.) Nees (Chuanxinlian)[J].ChineseMedicine,2013,8(1):2-12.
[18]郭山山,卫莹芳,闫婕,等.全国不同产地及不同部位穿心莲中总内酯的含量测定[J].时珍国医国药,2010,21(11):2 797-2 799.
GUO S S,WEI Y F,YAN J,etal.Determination of total lactones in different areas and parts of andrographis[J].LishizhenMedicineandMateriaMedicaResearch,2010,21(11):2 797-2 799.
[19]SHARMA S N,JHA Z,SINHA R K,etal.Jasmonate-induced biosynthesis of andrographolide inAndrographispaniculata[J].PhysiologiaPlantarum,2015,153(2):221-229.
[20]MARTINEZ I M,CHRISPEELS M J.Genomic analysis of the unfolded protein response inArabidopsisshows its connection to important cellular processes[J].ThePlantCell,2003,15(2):561-576.
[21]KUMAR J,GUNAPATI S,KUMAR J,etal.Virus-induced gene silencing using a modified betasatellite:a potential candidate for functional genomics of crops[J].ArchivesofVirology,2014,159(8):2 109-2 113.
(编辑:宋亚珍)
Functional Characterization of ApCPS Involved in Andrographolides Biosynthesis by Virus-induced Gene Silencing
SHEN Qinqin1,LIU Qin1,LI Congcong1,FU Yuping2,WANG Qiang1*
(1 Institute of Ecological Agriculture,Sichuan Agricultural University,Chengdu 611130,China;2 College of Veterinary Medicine,Sichuan Agricultural University,Chengdu 611130,China)
Abstract:The ent-copalyl diphosphate synthase gene (ApCPS) with putative invovlment in andrographolides biosynthesis was silenced successfully in the 8-leaf stage of Andrographis paniculata through TRV virus-induced gene silencing (VIGS),which was verified by semiquatitative RT-PCR and quatitative RT-PCR.(1)Gene silencing of ApCPS resulted in decreased accumulation of andrographolides significantly with HPLC analysis.(2)In order to comprehensively investigate gene expression of andrographolides biosynthesis,the uptream genes,HMGR,DXS and GGPS were chosen to be analyzed by qRT-PCR.In VIGS plants,GGPS showed decreased trascript accumulation,which might be resulted from negetive feedback of GGPP accumulated after ApCPS gene silencing.No significant change was observed for HMGR and DXS upon ApCPS gene silencing.(3)HMGR,DXS and GGPS exhibited inducible gene expression with MeJA treatment,as well as ApCPS,indicating pleiotropic regultion of MeJA on andrographolides biosynthesis.It is the first report to characterize ApCPS involved in andrographolides biosynthesis in vivo through VIGS,which lays the foundation for further investigation of other andrographolides biosynthetic genes.
Key words:VIGS;ent-copalyl diphosphate synthase;andrographolides;biosynthesis pathway;gene expression
中图分类号:Q786;Q789
文献标志码:A
作者简介:谌琴琴(1990-),女,在读硕士研究生,主要从事穿心莲内酯生物代谢调控研究。E-mail:shenqin2000@sina.cn*通信作者:王强,博士,教授,博士生导师,主要从事作物次生代谢调控与分子育种研究。E-mail:qwang@sicau.edu.cn
基金项目:四川省杰出青年基金(2014JQ0038)
收稿日期:2015-09-19;修改稿收到日期:2015-11-11
文章编号:1000-4025(2016)01-0017-06
doi:10.7606/j.issn.1000-4025.2016.01.0017
