肉桂醛对增强辣椒疫霉病抗性的作用机制研究
2016-03-23李丽娜石志琦杨立飞
李丽娜,石志琦,高 弢,陈 健,杨立飞*
(1 南京农业大学 园艺学院,南京 210095;2 江苏省农业科学院食品质量安全与检测研究所,南京 210014)
肉桂醛对增强辣椒疫霉病抗性的作用机制研究
李丽娜1,石志琦2,高弢2,陈健2,杨立飞1*
(1 南京农业大学 园艺学院,南京 210095;2 江苏省农业科学院食品质量安全与检测研究所,南京 210014)
摘要:该实验以辣椒疫霉菌(Phytophthora capsici)致病性菌株NJ01和‘苏椒5号’辣椒幼苗为研究对象,通过肉桂醛对辣椒疫霉菌的体外抑菌作用、室内侵染效果以及对辣椒幼苗防卫反应的调控作用,揭示肉桂醛对增强辣椒疫霉病抗性的作用机制。结果表明:(1)肉桂醛对实验所用致病性菌株NJ01的抑制中浓度(EC50)值为0.81 mmol/L;肉桂醛处理可导致NJ01菌丝严重皱缩、畸形、断裂;PI染色显示NJ01菌丝出现明显的细胞死亡现象。(2)单独NJ01菌株接种的辣椒植株表现出明显病症(茎基部变黑褐色、干枯萎缩,植株倒伏,叶片脱落,生物量下降);而肉桂醛处理2 h后接种NJ01菌株的辣椒植株长势良好,无明显病症,鲜重和叶绿素含量显著上升至对照水平。(3)与单独接种NJ01菌株处理相比,肉桂醛处理2 h后接种NJ01菌株的辣椒植株体内抗氧化酶(CAT、SOD、POD)活性显著上升,抗氧化物质(GSH和ASA)含量显著增加。研究认为,肉桂醛可能通过抑制辣椒疫霉菌的生长及其对辣椒植株的侵染能力,同时调控辣椒植株防卫反应,进而提高辣椒对疫病抗性。
关键词:肉桂醛;辣椒疫病;辣椒疫霉;抗氧化酶;抗氧化物质
辣椒是中国栽培面积最大的蔬菜作物之一[1],而由辣椒疫霉菌(Phytophthoracapsici)引起的辣椒疫霉病严重危害辣椒生产。辣椒疫霉菌为鞭毛菌亚门卵菌纲疫霉属真菌[2],是一种典型的土传病菌,致病力强,寄主范围广泛,能侵染茄科、葫芦科及十字花科蔬菜作物[3]。该病主要为害叶片、果实和茎,特别是茎基部最易发生,全生育期均可发病。幼苗期发病,多从茎基部开始染病,病部出现水渍状软腐,病斑暗褐色,病部以上倒伏[4]。高温、高湿有利于发病,当空气相对湿度高于85%时,就可发病流行,从而引起大片辣椒植株枯死,严重时可高达80%以上,造成重大损失[5]。目前生产上针对辣椒疫病主要采用化学防治,但辣椒疫霉菌对常用化学杀菌剂(如甲霜灵和丁吡吗啉)的抗药性日益凸显[6-7]。另外,化学杀菌剂的大量使用亦对环境和食品安全造成严重威胁。
肉桂醛(cinnamicaldehyde,CA)属于醛类有机化合物,是肉桂提取物肉桂油的主要成分,具有广泛的生物学活性,在香料、制药、日用化学品及食品加工等方面都有广泛应用。研究发现肉桂醛不仅具有安全、易降解和生态友好等特点,还具有很好的抑菌杀菌效果,可有效抑制细菌、真菌的生长[8-11]。目前肉桂醛在防治农作物病害中的应用研究还相对较少。作者前期的研究发现,采用肉桂醛田间灌根对辣椒疫病具有很好的防治效果,防效远大于甲霜灵[12];体外研究表明肉桂醛能够显著抑制辣椒疫霉菌孢子萌发和菌丝生长[11]。为了进一步探讨肉桂醛防治辣椒疫病的作用机制,本试验考察了肉桂醛对辣椒疫霉菌的抑制作用,以及肉桂醛处理后辣椒疫霉菌对辣椒幼苗侵染能力的变化,为肉桂醛这一新型生物农药的田间使用技术提供理论依据。
1材料和方法
1.1材料与试剂
供试辣椒品种为‘苏椒5号’,种子购自南京绿领种业。供试辣椒疫霉侵染性菌株NJ01由南京农业大学植物保护学院惠赠,保存于利马豆培养基。供试药剂肉桂醛购于Aladdin公司,纯度大于95%;用二甲基亚砜(DMSO)溶解并配制成母液,因其易氧化、易挥发,通常现配现用。培养基为V8培养基、利马豆培养基。
1.2体外检测肉桂醛的抑菌作用
1.2.1肉桂醛对辣椒疫霉菌丝径向生长的抑制作用抑菌试验参照刘丽等[11]采用固体平板培养法,将肉桂醛用二甲基亚砜(DMSO)配制成母液,使用时再加入到利马豆培养基中,使其终浓度分别为0、0.2、0.4、0.8、1.2、1.6 mmol/L。用打孔器(d=5 mm)从新活化的V8固体培养基上的辣椒疫霉菌菌落边缘截取菌饼,接种于含肉桂醛的利马豆培养基中央,28 ℃恒温培养箱中培养3 d。此时对照平板菌落直径大于6 cm,采用十字交叉法测定辣椒疫霉菌在不同浓度肉桂醛平板上的菌落直径,用DPS数据处理软件计算肉桂醛对辣椒疫霉菌菌丝径向生长的抑制中浓度(EC50)及最小抑制浓度(MIC)。每个处理重复3次。
1.2.2菌丝形态显微观察用打孔器(d=5 mm)从新活化的V8固体培养基上的辣椒疫霉菌菌落边缘截取菌饼,V8液体培养基摇培(28 ℃,170 r/min)24 h后,将肉桂醛加入V8液体培养基中,使肉桂醛的处理浓度为1.6 mmol/L,继续摇培24 h。收集菌丝,用蒸馏水漂洗2~3次,以不加肉桂醛处理组为对照,并于显微镜下观察对照组与1.6 mmol/L肉桂醛处理组的菌丝形态。
1.2.3菌丝细胞死亡PI染色PI只能够进入死亡细胞并结合核酸发出红色荧光,因此PI染色是鉴定细胞死亡的经典方法之一[13]。采用1.2.2方法进行菌丝培养,收集菌丝,用蒸馏水漂洗2~3次。在菌丝中加入2 μmol/L的PI荧光探针装载20 min后,用蒸馏水漂洗3次,置于荧光显微镜(ECLIPSE,TE2000-S,Nikon)下观察并拍照(激发波长535 nm,发射波长615 nm)。
1.3室内检测肉桂醛抑制侵染效果
1.3.1材料处理辣椒幼苗在光照培养箱(25 ℃,光周期12 h/12 h)中生长约5周,选取长势一致、5~6叶龄的健康植株供试,共设置4种处理方式。(1)对照(CK,以清水做空白对照);(2)单独辣椒疫霉菌接种(P,将疫霉菌株NJ01孢子悬浮液(1×105/mL)直接接种于辣椒植株的茎基部附近土壤中);(3)肉桂醛处理后接种辣椒疫霉菌(CA+P,配制肉桂醛浓度为1 mmol/L的NJ01孢子悬浮液,室温放置2 h后再接种到植株);(4)肉桂醛单独处理(CA,将肉桂醛母液配制成1 mmol/L,每株辣椒幼苗在茎基部用移液枪注射50 μL)。每个处理5株,3次重复。处理3 d后,观察辣椒植株形态,并测定各组处理辣椒植株的各项生理生化指标。
1.3.2生物量测定每组处理随机取5棵辣椒幼苗,从茎基部剪去,将植株用去离子水洗净吸干表面水分后直接称量植株地上部分鲜重,记录数据。然后将其放入110 ℃烘箱中杀青30 min,55 ℃烘6 h,取出称取干重。每个处理重复3次。
1.3.3叶片叶绿素含量测定参照刘绚霞等[14]的方法,称取处理后叶片样品0.2 g至研钵中,加入5 mL 95%乙醇(添加少量碳酸钙及石英砂)研磨成匀浆,加入10 mL 95%乙醇稀释,滤纸过滤,并用容量瓶定容至25 mL,分别在波长663 nm、645 nm下测定吸光度A663、A645。按以下公式计算叶绿素含量:
叶绿素a含量(mg/g)=(12.7A663-2.69A645)×V/(1 000×W)
叶绿素b含量(mg/g)=(22.7A645-4.68A663)×V/(1 000×W)
总叶绿素(a+b)含量(mg/g)=(20.2A645+8.02A663)×V/(1 000×W)
1.4辣椒幼苗防卫反应指标检测
1.4.1抗氧化酶活性测定称取0.5 g叶片鲜样,加入1.5 mL预冷的提取缓冲液(磷酸缓冲液,50 mmol/L,pH 7.0)充分研磨,10 000 r/min、4 ℃离心20 min,取上清液进行酶活性测定。过氧化氢酶(CAT)活性采取钼酸铵法[15],CAT分解H2O2的反应可通过加入钼酸铵而迅速中止,剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物,测定其在405 nm处吸光值。1个CAT活力单位定义为,在测定条件下,每分钟分解1 μmol过氧化氢所需的酶量。超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光还原比色法测定[16]。3 mL反应体系包括:磷酸缓冲液 (50 mmol/L、pH 7.8),13 mmol/L蛋氨酸,2 μmol/L核黄素,75 μmol/L NBT,0.1 mmol/L EDTA,30 μL酶液。日光灯下反应30 min后,测定560 nm处吸光值,1个SOD活力单位定义为能够抑制50% NBT光还原反应的酶量。过氧化物酶(POD)活性采用愈创木酚还原法[17]测定。0.5 μL酶液与3 μL愈创木酚反应液混合,37 ℃温育30 min,于470 nm波长下测定吸光度A470值。1个SOD活力单位定义为37 ℃条件下,每毫克组织蛋白每分钟催化产物生成1 μg底物的酶量。
1.4.2蛋白质含量测定采用考马斯亮蓝G-250染色测定蛋白质含量[18],以牛血清白蛋白作为标准蛋白。
1.4.3谷胱甘肽和抗坏血酸含量测定称取0.1 g叶片鲜样,加入含1 mL预冷的5%(W/V)偏磷酸冰浴研磨,10 000 r/min离心20 min,取上清液测定抗坏血酸(ASA)和谷胱甘肽(GSH)含量。GSH含量的测定采用可见分光光度法,基于Ellman试剂[19](二硫代二硝基苯甲酸)与巯基化合物反应产生黄色产物,在420 nm处有最大吸收峰。测定并制作0~50 μg的GSH标准曲线来计算样品中的GSH含量[20]。ASA含量测定采用化学比色法[21],利用Fe3+与还原型抗坏血酸迅速作用生成Fe2+,后者再与啡罗啉显色反应,在420 nm处有最大吸收峰。测定并制作0~100 μg的ASA标准曲线来计算样品中的ASA含量。
1.5数据统计分析
试验结果采用3次重复的平均值±标准差表示,用SPSS 2.0进行单因素方差分析(ANOVA),然后检测不同处理之间差异显著性(P<0.05)。
2结果与分析
2.1肉桂醛处理对辣椒疫霉菌体外生长的影响
通过辣椒疫霉致病性菌株NJ01测定疫霉菌对肉桂醛的敏感性。结果表明,肉桂醛对NJ01菌斑直径的抑制中浓度(EC50)为0.81 mmol/L,最小抑制浓度(MIC)为1.8 mmol/L,说明辣椒疫霉菌对肉桂醛较为敏感(图1,A)。同时,显微观察结果显示:经1.6 mmol/L肉桂醛处理的辣椒疫霉菌丝比对照菌丝明显变形、皱缩,色泽加深,甚至扭曲断裂,而对照菌丝生长健壮,菌丝形态较为完整(图1,B)。此外,经PI染色后,对照菌丝发出轻微荧光,肉桂醛处理后的菌丝则呈现高强度的红色荧光(图1,C)。这说明肉桂醛处理后的菌丝表现出明显的细胞死亡现象。
2.2肉桂醛处理对辣椒疫霉菌侵染力和幼苗生长的影响
肉桂醛不但对辣椒疫霉菌表现出较强的体外抑菌作用,而且能够影响辣椒疫霉菌的侵染和致病性。图2结果显示:辣椒茎基部接种疫霉菌孢子悬浮液3 d后,辣椒幼苗呈现出典型病症,即茎基部明显变暗绿色至黑褐色,并且变细、干枯、皱缩;植株倒伏,叶片变黄,脱落严重;而CA+P处理的辣椒幼苗则没有表现出明显病症,幼苗植株长势良好;单独CA(1 mmol/L)处理对辣椒幼苗的生长无显著影响。另外,生物量测定结果显示,单独疫霉菌接种的辣椒幼苗鲜重较对照显著下降,而CA+P处理的辣椒幼苗鲜重则可恢复到对照水平,同时单独CA处理的幼苗鲜重与对照无显著差异;各个处理的幼苗干重相互之间无显著差异(表1)。可见,适宜浓度肉桂醛能明显抑制辣椒疫霉菌对幼苗的侵染和致病性,使接种幼苗恢复正常生长。
2.3肉桂醛处理对接种辣椒植株叶片叶绿素含量的影响
由于单独接种疫霉菌后辣椒幼苗叶片出现失绿现象,所以进一步测定了不同处理方式下幼苗叶片叶绿素含量变化。结果显示:辣椒幼苗叶绿素a的含量在单独疫霉菌接种处理下较对照显著下降15.5%,而在CA+P处理下则可恢复到对照水平,在单独CA处理下比对照显著提高19.0%;各处理间的叶绿素b含量无显著差异,而总叶绿素含量变化趋势与叶绿素a一致(表2)。因此,感染疫霉病辣椒幼苗叶片叶绿素含量(尤其是叶绿素a)显著降低,而适宜浓度肉桂醛能显著提高正常幼苗叶片叶绿素含量,并能使感病幼苗叶绿素含量恢复正常。

A.径向生长;B.菌丝形态;C.PI染色

图2 肉桂醛处理对辣椒疫霉菌致病性的影响
2.4肉桂醛处理对接种辣椒植株抗氧化酶活性的影响
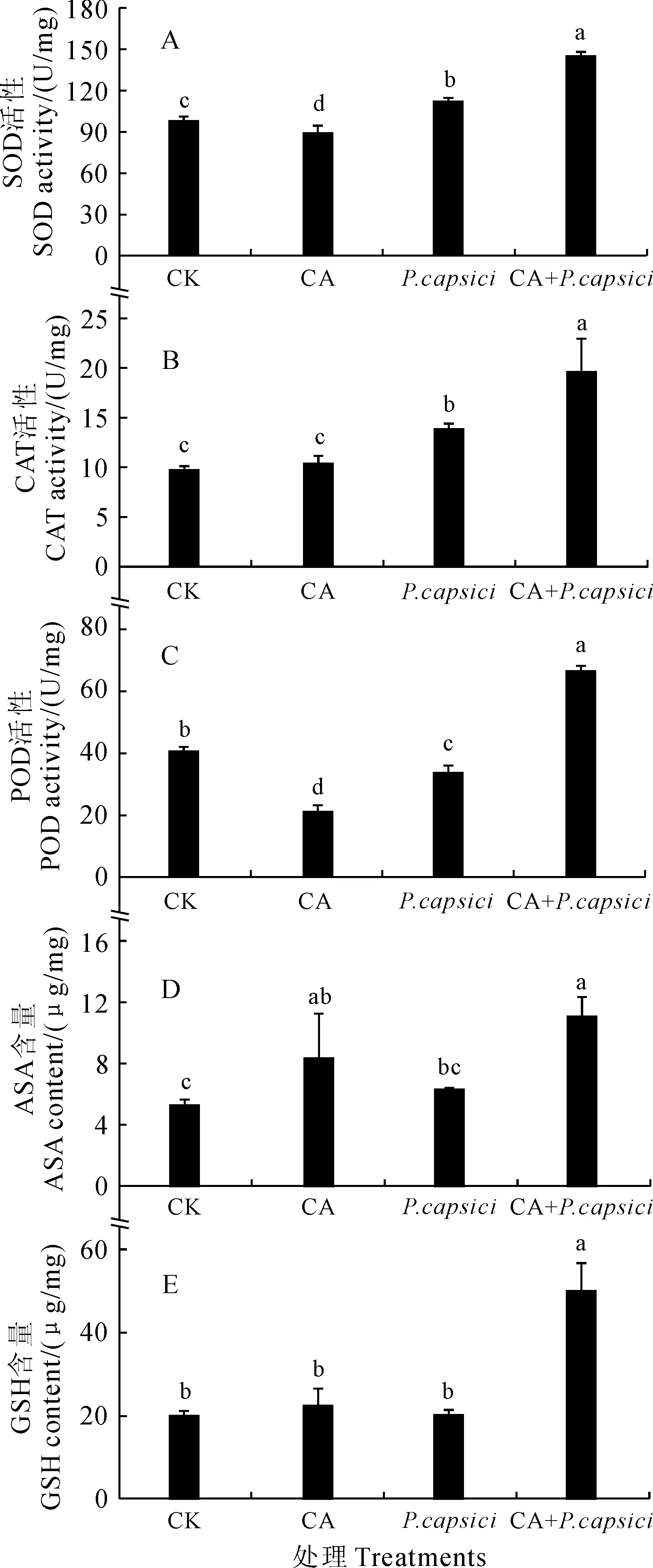
抗氧化酶(SOD、CAT、POD)是植物抵御外界环境胁迫的重要防御酶,而植物中的抗氧化物质(如ASA和GSH)组成了重要的非酶抗氧化体系。图3结果显示:与对照相比,单独接种疫霉菌的辣椒幼苗体内SOD和CAT活性均显著上升15%和44%,而其相应的POD活性显著下降20%;而CA+P共同处理的辣椒幼苗体内SOD、CAT、POD活性均显著大幅度提高,分别比单独接种疫霉菌处理显著提高了32%、41%和98%;而单独肉桂醛处理(CA)SOD、POD活性均显著降低,其CAT活性则无显著变化。同时,与对照相比,单独疫霉菌接种处理的辣椒幼苗体内ASA和GSH含量无显著变化;而CA+P共同处理的辣椒幼苗体内ASA和GSH含量均大幅显著提高,分别比单独疫霉菌接种处理提高了74%和151%;而单独肉桂醛处理(CA)的ASA含量显著提高,而其GSH含量无显著变化。可见,适宜浓度的肉桂醛处理能诱导大幅提高感染辣椒疫霉病植株体内抗氧化酶活性和抗氧化物质含量,从而有效增强其抵御疫霉病的能力。

表1 CA处理的辣椒疫霉菌接种后辣椒幼苗生物量变化
注:同列不同小写字母表示处理间在0.05水平差异显著;下同。
Note:Different normal letters in the same column indicate significant differences among treatments at 0.05 level;The same as below.
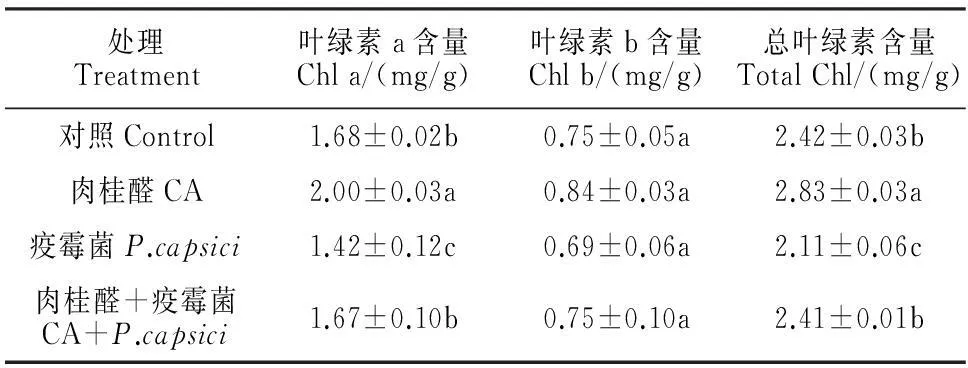
表2 CA处理的辣椒疫霉菌接种后辣椒幼苗叶绿素含量变化
不同小写字母表示处理间在0.05水平差异显著
3讨论
目前,辣椒疫病的防治面临巨大挑战。我们的前期研究发现植物源天然化合物肉桂醛在田间能够高效防治辣椒疫病[12]。在本研究中,我们进一步研究了肉桂醛对辣椒疫霉菌的抑菌效应。已有研究认为,肉桂醛能够直接作用于真菌细胞壁与细胞膜[22]。在本研究中,我们发现肉桂醛处理后的辣椒疫霉菌表现出严重的菌丝畸形与破裂,这可能与肉桂醛破坏菌丝细胞壁有关。
我们的前期研究还发现肉桂醛能够在体外显著抑制辣椒疫霉菌孢子萌发[11]。本研究结果表明,肉桂醛处理后的辣椒疫霉菌孢子对辣椒植株的侵染力显著下降。未经肉桂醛处理的孢子在侵染后3 d之内辣椒幼苗表现出明显病症,即茎基部发病萎缩,造成植株倒伏,水分运输能力下降,这与植株鲜重的测定结果相吻合。由于水分和养分向地上部的运输受阻,叶片亦表现出胁迫症状(萎焉、失绿),而叶绿素含量的显著下降亦证实了此现象。经肉桂醛处理仅2 h后的孢子接种辣椒幼苗,植株长势良好,鲜重和叶绿素含量显著恢复到对照水平,而抗氧化酶和抗氧化物质含量甚至显著高于对照水平。这表明肉桂醛在抑制孢子萌发和进一步侵染的同时,亦可能诱导提升植株的抗胁迫能力。另外,单独肉桂醛处理对上述这些抗性生理指标无显著影响,这说明在肉桂醛-病原菌-植物三者互作的过程中,肉桂醛可以杀死部分病原菌,同时肉桂醛可能通过诱导植物抗性来抵御剩余少量菌的侵染。
病原物侵染通常会引起寄主植物的氧化损伤反应。在植物防卫反应中,SOD能够将过量产生的超氧阴离子还原为过氧化氢,是植物抵御外界胁迫的第一道防卫屏障。然后过氧化氢可以被CAT和POD进一步还原为水分子。GSH和ASA等抗氧化物质在清除过量活性氧方面亦发挥关键作用[23]。有研究显示,肉桂醛在提高哺乳动物细胞抗氧化胁迫过程中,能够显著提高POD和CAT的活力以及GSH含量,但不能提升SOD活力[24]。在本研究中,肉桂醛处理辣椒幼苗的SOD活力亦得到了提升,这说明肉桂醛在提升动植物防卫能力方面存在部分差异,即在动物中可能更侧重于过氧化氢的清除,而在植物中则更为积极,可能有助于同时清除超氧阴离子和过氧化氢。另外,我们最近的研究结果表明,肉桂醛能够调控辣椒植株体内硫化氢信号促进根系形态建成[25]。辣椒疫病属于土传病害,极易造成根系发育不良。而硫化氢作为一种新型信号分子在调控蔬菜植物防卫反应方面发挥重要作用[26]。结合本研究结果,可以推测肉桂醛在防治辣椒疫病的过程中,除了其抑菌作用外,还可能与其调控植物生长和防卫反应密切相关,这还需要进一步的研究来明确其作用机理。
参考文献:
[1]戴雄泽,刘志敏.初论我国辣椒产业的现状及发展趋势[J].辣椒杂志,2005,(4):2-6.
DAI X Z,LIU Z M.On current situation and its development trends of the pepper industry in China[J].JournalofChinaCapsicum,2005,(4):2-6.
[2]许志刚.普通植物病理学[M].北京:中国农业出版社,2000.
[3]任光地.辣椒疫病病原研究[J].甘肃农业科技,1990,(10):33-35.
REN G D.Research on pathogeny of pepper phytophthora blight[J].GansuAgriculturalScienceandTechnology,1990,(10):33-35.
[4]易图永,谢丙炎,田林,等.辣椒疫病防治研究进展[J].中国蔬菜,2002,(5):52-55.
YI T Y,XIE B Y,TIAN L,etal.Research progress of pepper phytophthora blight controlling[J].ChinaVegetables,2002,(5):52-55.
[5]沈崇尧,王有琪,田林,等.甘肃省辣椒疫病病原菌鉴定及生物学特性研究[J].云南农业大学学报,1990,5(2):72-77.
SHEN C Y,WANG Y Q,etal.Gansu pepper blight pathogen identification and biological characteristics research[J].JournalofYunnanAgriculturalUniversity,1990,5(2):72-77.
[6]GEVENS A J,DONAHOO R S,LAMOUR K H,etal.Characterization ofPhytophthoracapsicifromMichigansurfaceirrigation water[J].Phytopathology,2007,97:421-428.
[7]PANG Z,SHAO J,CHEN L,etal.Resistance to the novel fungicide pyrimorph inPhytophthoracapsic:Risk assessment and detection of point mutations in CesA3 that confer resistance[J].PlosOne,2013,8:e56513.
[8]CHENG S S,LIU J Y,CHANG E H,etal.Antifungal activity of cinnamaldehyde and eugenol congeners against wood-rot fungi[J].BioresourceTechnology,2008,99(11):5 145-5 149.
[9]王新伟,杜会云,宋玉函,等.牛至油、香芹酚、柠檬醛和肉桂醛抗真菌研究[J].食品科学,2011,36(2):193-196.
WANG X W,DU Q Y,SONG Y H,etal.Antimicrobial activity of oregano ossential oil,carvacrol,citral and cinnamaldehyde[J].FoodScienceandTechnology,2011,36(2):193-196.
[10]戴向荣,蒋立科,罗曼,等.肉桂醛抑制黄曲霉机理初探[J].食品科学,2008,29(1):36-40.
DAI X R,JIANG L K,LUO M.Preliminary study of cinnamaldehyde inhibition onAspergillusflavous[J].FoodScience,2008,29(1):36-40.
[11]刘丽,胡梁斌,王德德,等.肉桂醛对辣椒疫霉的抑制作用[J].江苏农业学报,2014,30(2):282-288.
LIU L,HU L B,WANG D D,etal.Inhibition ofPhytophthoracapsiciby cinnamaldehyde[J].JiangsuJournalofAgriculturalSciences,2014,30(2):282-288.
[12]薛延丰,陈健,张猛,等.肉桂醛对辣椒生物量和品质影响及辣椒疫霉防控效果初探[J].西南农业学报,2014,27(2):781-787.
XUE Y F,CHEN J,ZHANG M,etal.Preliminary study of cinnamaldehyde on biomass and quality in pepper and controlling effect of phytophthora blight[J].SouthwestChinaJournalofAgriculturalSciences,2014,27(2):781-787.
[13]FIRSTENCEL H,BUTT T M,CARRUTHERS R I.A fluorescence microscopy method for determining the viability of entomophthoralean fungal spores[J].JournalofInvertebratePathology,1990,55:258-264.
[14]刘绚霞,董振生,刘创社,等.油菜叶绿素提取方法的研究[J].中国农学通报,2004,4:62-63.
LIU X X,DONG Z S,LIU C S,etal.Study on extracting methods of chlorophyll in rape[J].ChineseAgriculturalScienceBulletin,2004,20(4):62-63.
[15]彭建,王丹英,徐春梅,等.钼酸铵法测定水稻过氧化氢酶活性[J].中国农学通报,2009,25(16):61-64.
PENG J,WANG D Y,XU C M,etal.Ammonium molybdate method for detecting the activities of rice catalase[J].ChineseAgriculturalScienceBulletin,2009,25(16):61-64.
[16]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:211-213.
[17]XUE Y F,LIU L,LIU Z P,etal.Protective role of CA against NaCl toxicity in Jerusalem artichoke by up-regulation of antioxidant enzymes[J].Pedosphere,2008,18(6):766-774.
[18]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].AnalyticalBiochemistry,1976,72:248-254.
[19]ELLMAN G L.Tissue sulfhydryl groups[J].ArchBiochem.Biophys.,1959,82(1):70-77.
[20]曾韶西,王以柔.低温胁迫对黄瓜子叶抗环血酸过氧化物酶活性和谷胱甘肽含量的影响[J].植物生理学报,1990,16(1):37-42.
ZENG S X,WANG Y R.The impact on ASA-POD activity and GSH content of cucumber cotyledon by cold stress[J].PlantPhysiologyJournal,1990,16(1):37-42.
[21]CHEN J,SHIYAB S,HAN F X,etal.Bioaccumulation and physiological effects of mercury in Pterisvittata and Nephrolepisexaltata[J].Ecotoxicology,2009,18:110-121.
[22]BANG K H,LEE D W,PARK H M,etal.Inhibition of fungal cell wall synthesizing enzymes by trans-cinnamaldehyde[J].Bioscience,Biotechnology,andBiochemistry,2000,64:1 061-1 063.
[23]GILL S S,TUTEJA N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].PlantPhysiologyandBiochemistry,2010,48:909-930.
[24]CHOU S T,CHANG W L,CHANG C T,etal.Cinnamomum cassia essential oil inhibits α-MSH-Induced melanin production and oxidative stress in murine B16 melanoma cells[J].InternationalJournalofMolecularSciences,2013,14:19 186-19 201.
[25]XUE Y F,ZHANG M,QI Z Q,etal.Cinnamaldehyde promotes root branching by regulating endogenous hydrogen sulfide[J].JournaloftheScienceofFoodandAgriculture,2015,(wileyonlinelibrary.com) DOI 10.1002/jsfa.7164.
[26]FOTOPOULOS V,CHRISTOU A,etal.Hydrogen sulphide:a versatile tool for the regulation of growth and defence responses in horticultural crops[J].JournalofHorticulturalScience&Biotechnology,2015,90(3):227-234.
(编辑:裴阿卫)
Mechanism Research on Cinnamaldehyde Enhances Pepper Resistance to Phytophthora Blight Disease
LI Lina1,SHI Zhiqi2,GAO Tao2,CHEN Jian2,YANG Lifei1*
(1 College of Horticulture,Nanjing Agricultural University,Nanjing 210095,China;2 Institute of Food Quality and Safety,Jiangsu Academy of Agriculture Science,Nanjing 210014,China)
Abstract:In order to understand the mechanism that cinnamaldehyde (CA) can enhance pepper resistance to phytophthora blight disease,we investigated the antifungal effect of CA on Phytophthora capsici in vitro and the controlling effect on disease development as well as the regulation of defensive response in pepper seedlings by CA.Basically,we obtained the following results:(1)the EC50for CA against isolate NJ01 used in this study was 0.81 mmol/L;CA treatment resulted in the abnormally broken mycelia of NJ01 and cell death indicated by PI staining.(2)Pepper seedlings inoculated with NJ01 alone showed obvious disease symptoms,such as black brown atrophic sub-stem,plant lodging,leaf abscission,and decreased biomass.However,pepper seedlings inoculated with CA-treated NJ01 with increased fresh weight and chlorophyll content grew well without any obvious disease symptoms.(3)Compared to the NJ01 inoculation alone,inoculation with CA-treated NJ01 resulted in the significant increases in the activities of anti-oxidative enzymes (e.g.CAT,POD,and SOD) and the contents of antioxidants (e.g.GSH and ASA).In conclusion,it can be speculated that pepper enhanced resistance to pepper phytophthora blight disease by CA may attribute to the antifungal effect of CA and CA-modulated plant defense in pepper seedlings.
Key words:cinnamaldehyde;pepper phytophthora blight disease;Phytophthora capsici;anti-oxidative enzyme;antioxidant
中图分类号:Q945.79
文献标志码:A
作者简介:李丽娜(1990-),女,在读硕士研究生,主要从事蔬菜生理与生物技术研究。E-mail:llnhphp1314@163.com*通信作者:杨立飞,副教授,硕士生导师,主要从事蔬菜栽培生理与生物技术研究。E-mail:lfy@njau.edu.cn
基金项目:江苏省农业科技自主创新资金项目[CX(12)1004]
收稿日期:2015-09-26;修改稿收到日期:2015-12-19
文章编号:1000-4025(2016)01-0100-06
doi:10.7606/j.issn.1000-4025.2016.01.0100
