水飞蓟宾脂质体制备方法研究
2016-03-23胡翠萍郭咸希
何 文,胡翠萍,郭咸希
(1.武汉大学人民医院,湖北 武汉 430060; 2.武汉大学药学院,湖北 武汉 430071)
水飞蓟宾脂质体制备方法研究
何 文1,胡翠萍2,郭咸希1
(1.武汉大学人民医院,湖北 武汉 430060; 2.武汉大学药学院,湖北 武汉 430071)
目的 建立水飞蓟宾脂质体的最佳制备方法。方法 分别采用薄膜分散法、复乳法、逆向蒸发法制备水飞蓟宾脂质体;采用光学显微镜观察脂质体的形态;采用滤膜法分离水飞蓟宾脂质体中游离的药物,高效液相色谱法测定脂质体的药物含量,计算包封率,并以包封率和粒径分布为主要考察指标筛选最佳制备方法。结果 3种方法制备的脂质体形态圆整,基本无区别;采用薄膜分散法、复乳法、逆向蒸发法制备的脂质体在高速剪切前包封率分别为(88.67±16)%,(68.88±1.5)%和(59.96±1.2)%,高速剪切后包封率分别为(72.32±7.6)%,(31.68±3.1)%和(37.66±1.4)%,剪切后平均粒径分别为(134.8±2.5)nm,(138.5±2.5)nm和(165.0±1.1)nm,多分散性指数分别为0.235,0.182和0.233。结论 薄膜分散法制备水飞蓟宾脂质体包封率较高,减小粒径后对包封率的影响也较小,为后续制备肝靶向制剂奠定了试验基础。
水飞蓟宾;脂质体;包封率;多分散性指数
水飞蓟宾(SLB)是从菊科药用植物水飞蓟种子的种皮中提取所得的黄酮类化合物,有明显的保护和稳定肝细胞、改善肝功能的作用[1]。其药理作用包括抗肝纤维化、抗脂质过氧化、抗炎作用、免疫调节、抗肿瘤和调节血脂等[2],已被广泛应用于治疗各种肝功能紊乱疾病,如肝硬化、肝炎和由酒精或毒素造成的脂肪肝等[3-4]。SLB是脂溶性物质,口服生物利用度低[5]。研究表明,将其制成脂质体、环糊精包合物、水溶性葡甲胺盐、卵磷脂复合物、固体分散体等,可改善生物利用度[6]。制备SLB脂质体的方法很多,如薄膜超声分散法[7]、乙醇注入法[8]、前体脂质体法[9]、逆向蒸发法[5]等。本试验中拟采用不同方法制备SLB脂质体,以其粒度分布和包封率为指标来选择最佳制备方法,为后续研究新型肝靶向制剂奠定基础。
1 仪器与试药
SPD-20A型/LC-20AT型高效液相色谱仪(日本岛津公司);FLUKO FA25型高速分散机(上海凡劲仪器设备有限公司);Zetasizer 3000HS型激光粒度分析仪(英国Malvern公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司);W2-100S型旋转蒸发器(上海申生科技有限公司);KQ3200DE型数控超声波清洗器(昆山市超声仪器有限公司);冷冻台式离心机型(武汉赤城生物技术有限公司),C-SHG Hg 50W型荧光倒置显微镜(日本Nikon公司)。SLB原料药(西安飞达生物技术有限公司,批号为FD20140117,纯度 98%);SLB对照品(中国食品药品检定研究院,批号为110856-201305,纯度≥98%);卵磷脂(国药集团化学试剂有限公司,批号为Lot.NO20130724);胆固醇(国药集团化学试剂有限公司,批号为20120627);氯化钠注射液(武汉滨湖双鹤药业有限责任公司,批号为131113801);甲醇为色谱纯,氯仿、乙醇等试剂为分析纯。
2 方法与结果
2.1 SLB含量测定
2.1.1 色谱条件[10]与系统适用性试验
色谱柱:Agilent TC-C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水-冰醋酸 (54∶46∶0.5);流速:0.8 mL/min;检测波长:288 nm;柱温:40℃;进样体积:20 μL。在此色谱条件下,脂质体辅料对测定无干扰,结果见图1。
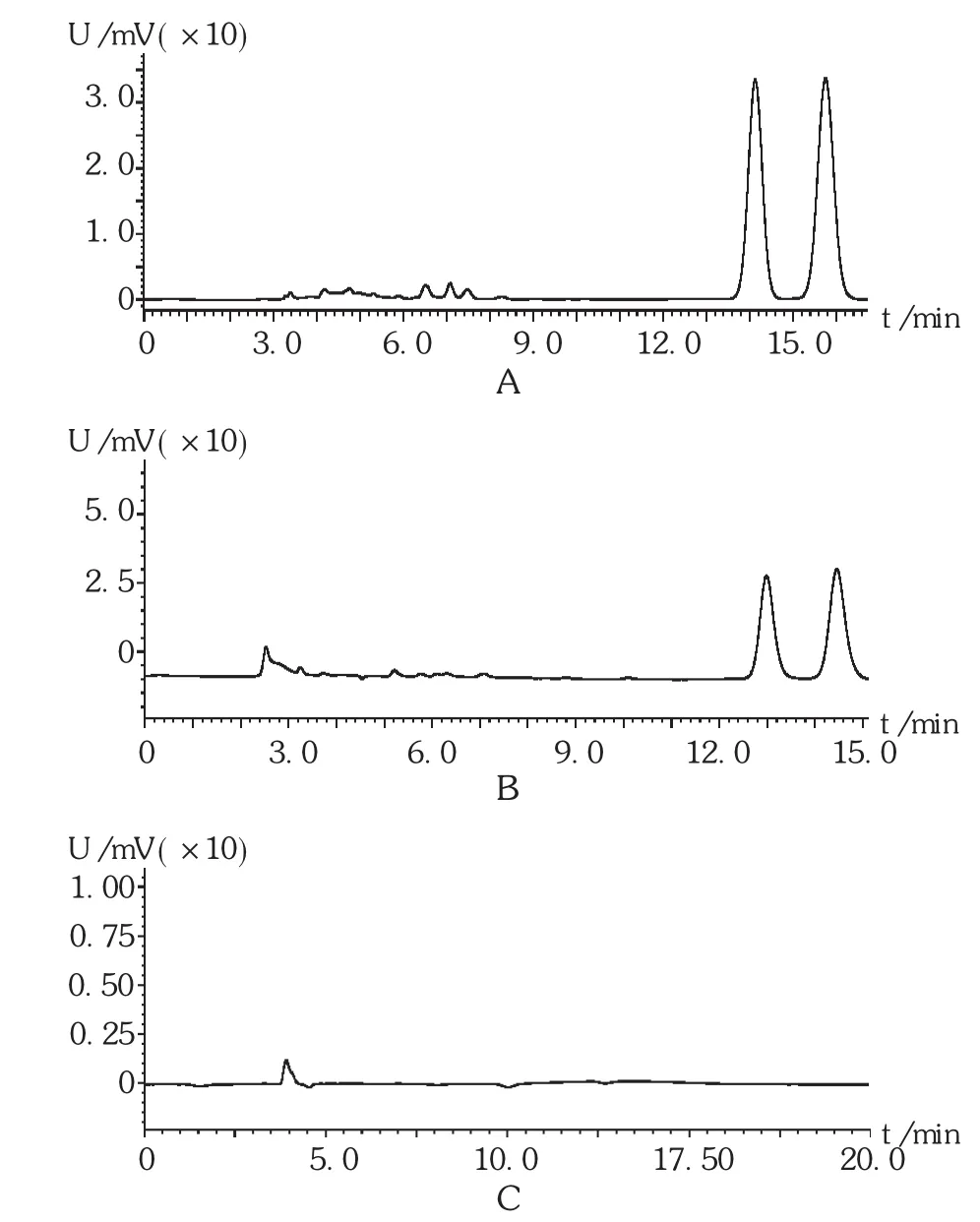
图1 高效液相色谱图
2.1.2 标准曲线绘制
精密称取于真空干燥箱60℃干燥至恒重的SLB对照品10 mg,置50 mL容量瓶中,加适量甲醇溶解,并用蒸馏水定容,摇匀,配制成 200 μg/mL的贮备液。分别精密量取贮备液 0.10,0.25,0.50,1.00,2.00,4.00 mL,置10 mL容量瓶中,用甲醇与水的混合溶剂定容,摇匀,稀释得质量浓度为 2,5,10,20,40,80 μg/mL的对照品溶液。用0.45 μm微孔滤膜过滤后,分别进样20 μL,记录峰面积,以峰面积 A对质量浓度 C(μg/mL)进行线性回归,得标准曲线方程A=69 379 C+21 315,r=0.999 9(n=6)。SLB质量浓度线性范围是2~80 μg/mL。
2.1.3 精密度试验
精密吸取不同量的SLB贮备液,置10 mL容量瓶中,用甲醇与水的混合溶剂定容并配制成5,20,80 μg/mL的溶液,于1 d和5 d内重复进样5次。结果日内精密度的 RSD分别为1.22%,0.97%和0.96%,日间精密度的 RSD分别为1.63%,1.18%和0.80%(n=5),表明方法精密度良好。
2.1.4 回收率试验
依法制备空白纳米脂质体。分别吸取空白纳米脂质体溶液2 mL,置10 mL容量瓶中,精密加入不同量的SLB贮备液,再用适量甲醇破乳,并加蒸馏水定容摇匀,以3 000 r/min离心15 min,取上清液,经0.45 μm微孔滤膜过滤后进样分析,根据峰面积和标准曲线计算药物浓度,与加入药物浓度比较,计算平均回收率。结果见表1。
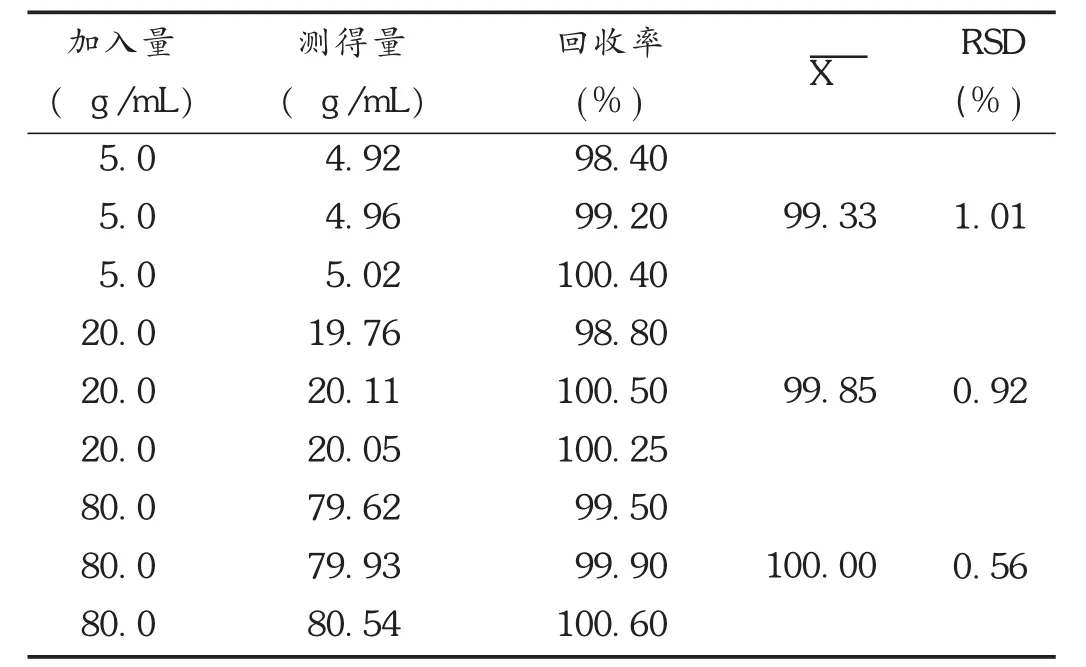
表1 SLB回收率试验结果(n=3)
2.2 SLB脂质体制备方法
2.2.1 薄膜分散法
称取卵磷脂20 mg,胆固醇2 mg,水飞蓟宾1 mg,置500 mL茄形瓶中,加入15 mL氯仿与乙醇的混合溶剂充分溶解。于50℃水浴减压蒸馏除去有机溶剂,形成均匀透明的薄膜,继续抽真空除去残余溶剂。加入10 mL生理盐水水合介质洗膜,于50℃恒温水浴水化1 h,得到乳状半透明脂质体溶液,并高速剪切分散10 min,密封置冰箱4℃保存。
2.2.2 复乳法
称取卵磷脂20 mg,胆固醇2 mg,水飞蓟宾1 mg,置500 mL梨形瓶中,加入一定体积有机溶剂(体积比为2∶1的三氯甲烷/乙醇混合溶剂)溶解,再加入少量生理盐水,将梨形瓶置100 W超声波仪上超声乳化5 min,形成的W/O型乳液呈乳白色。将梨形瓶置旋转蒸发仪上,于50℃水浴进行减压蒸馏,除去少量有机溶剂,再加入10 mL生理盐水,此时形成W/O/W型复乳。温度保持不变,压力不变,继续蒸馏除尽有机溶剂,形成的脂质体为乳白色悬浮液,并高速剪切分散10 min,置4℃冰箱保存。
2.2.3 逆向蒸发法
称取卵磷脂20 mg,胆固醇2 mg,水飞蓟宾1 mg,置500 mL梨形瓶中,加入一定体积有机溶剂(体积比为2∶1的三氯甲烷/乙醇混合溶剂)溶解,再加10 mL生理盐水水超声5 min,将梨形瓶置旋转蒸发仪上,减压蒸馏,直至形成反胶束凝胶,维持真空,继续减压蒸馏至其塌陷形成脂质体为乳白色悬浮液,并高速剪切分散10 min,置4℃冰箱保存。
2.3 形态观察
分别取未剪切的一定体积的不同方法制备的SLB脂质体,用蒸馏水稀释到合适浓度,取适量置载玻片上,于光学显微镜下10×10倍观察形态并照相。结果见图2。可见,3种方法制备成的脂质体在光学显微镜下均呈双层膜,形态圆整,粒径分布均匀。

图2 SLB脂质体的形态观察
2.4 粒度分析
分别取一定体积的不同方法制备的SLB脂质体,置10 mL容量瓶中,加蒸馏水稀释定容并且混匀,再分别取适量放入样品池中,用粒度分析仪进行测定。结果见表2和图3。

表2 不同方法制备的SLB脂质体的粒径分布
2.5 包封率测定

图3 SLB脂质体的粒径分布
采用透析法测定包封率[11]。取SLB脂质体混悬液1 mL,置透析袋内,两端用透析夹夹紧后,置100 mL的0.5%吐温80透析液中,室温下磁力搅拌,透析8 h后,完全转移透析袋内的溶液于10 mL容量瓶中,甲醇定容,过0.45 μm微孔滤膜,上液相色谱仪测定药物质量浓度为 C1。另取未透析的脂质体1 mL,置10 mL容量瓶中,甲醇定容,破乳至澄清透明,过0.45 μm微孔滤膜,测定药物质量浓度为 C2。包封率=C1/C2×100%。将以上3种方法所制得的脂质体依法测定并计算包封率,结果见表 3。用 SPSS软件进行 t检验,薄膜分散法制备的脂质体包封率在剪切前后差异无显著性(P>0.05),表明薄膜分散法剪切前后的包封率无明显改变;而复乳法和逆向蒸发法制备的脂质体包封率在剪切前后差异有显著性(P<0.05),即高速剪切对此两种方法制备的脂质体包封率影响较大。结果表明,应用薄膜分散法制备的脂质体包封率较高,调整粒径后对包封率的影响也较小。因此,选择薄膜分散法制备 SLB脂质体。
表3 包封率测定结果(±s,%,n=3)

表3 包封率测定结果(±s,%,n=3)
时间高速剪切前高速剪切后薄膜分散法88.67±1.6 72.32±7.6复乳法68.88±1.5 31.68±3.1逆向蒸发法59.96±1.2 37.66±1.4
2.6 磷脂氧化指数测定
取制备好的脂质体适量,加无水乙醇定容至10 mL,分别测定在波长233 nm和215 nm的吸光度,按照公式计算氧化指数,氧化指数=A233nm/A215nm。A233nm和 A215nm分别为溶液在波长233 nm和215 nm的吸光度。结果见表 4,表明 3批脂质体的氧化指数均小于 0.2,符合2010年版《中国药典(二部)》的要求。

表4 SLB脂质体氧化指数测定结果(n=3)
3 讨论
样品含量的计算:SLB以一对非对映异构体的形式存在,两者具有类似的药理作用[8],在高效液相色谱分析中表现为双峰,2010年版《中国药典(二部)》规定其含量测定以两峰面积之和定量。
流动相比例的确定:参照药典和有关文献[10],最终将流动相调整为甲醇-水-冰醋酸(54∶46∶0.5)。调整过程中发现,加大冰醋酸的比例可抑制峰形拖尾,可能是因为SLB的化学结构中含有较多的羟基,可与色谱柱中的硅羟基(吸电子基团)产生作用力。酸性环境抑制了硅羟基的电离,使得硅羟基呈分子状态,从而不易吸引 SLB中的羟基氢。因此,加大酸度可有效消除峰拖尾[12]。SLB是脂溶性物质,当流动相中甲醇比例提高时,洗脱能力增强,使样品能够很快流出,但由于洗脱时间不够,两峰不能很好地分离;反之,当流动相中水的比例提高时,洗脱能力减弱,保留时间延长,两峰分离较好,而水的比例过高则易出现峰拖尾,可能是因为洗脱时间过长。
包封率方法的确定:本试验采用透析法测定包封率,配制的0.5%吐温80水溶液(W/V)作为透析介质,能使不溶于水的SLB充分溶解,起到了增溶效果。考察了不同介质浓度(0.5%,1%,2%)对透析达到平衡时间的影响,发现使用不同浓度的介质,在8 h均能达到平衡,最终选择浓度为0.5%吐温80水溶液作为透析介质。
制备方法的确定:脂质体的制备方法很多,本试验中采用了薄膜分散法、复乳法、逆向蒸发法、乙醇注入法等方法。由于在制备过程中发现,本试验中使用的磷脂和胆固醇微溶于乙醇,虽然通过光学显微镜观察,发现有少量脂质体形成,但不稳定,几小时后就出现了沉淀,于是舍弃了这种方法。前3种方法都能制备成较稳定的脂质体,通过高速剪切机分散,有效地减小了粒径,粒径分布均匀,但包封率都出现不同程度地降低,可能是因为高速剪切过程中产生的能量高,导致脂质体中药物发生渗漏;薄膜分散法制备的多为大多层脂质体(MLV),其他2种方法制备的多为大单室脂质体(LUV)[13],而MLV脂质体层数多,受到高速剪切破坏的程度较小,因此包封率下降程度相对较小。试验过程中还考察了薄膜分散法制备的脂质体氧化指数,结果表明,脂质体的氧化指数达到了药典要求,为进一步体内外试验奠定了基础。
综上所述,应用薄膜分散法制备的脂质体包封率较高,调整粒径后对包封率的影响也较小,因此本试验中将此方法用于制备SLB脂质体,并进一步优化了该方法的处方工艺,为后续研究奠定了基础。
[1]Basiglio CL,Sánchez Pozzi EJ,Mottino AD,et al.Differential effects of silymarin and its active component silibinin on plasma membrane stability and hepatocellular lysis[J].Chemico-biological interactions,2009,179(2):297-303.
[2]刘志刚,李雪玲,翁立冬,等.水飞蓟素药理作用研究进展[J].辽宁中医药大学学报,2012,14(10):91-93.
[3]Burczynski FJ,Wang G,Nguyen D,et al.Silymarin and hepatoprotection[J].Journal of Central South University Medical sciences,2012,37(1):6-10.
[4]Tedesco D,Tava A,Galletti S,et al.Effects of silymarin,a natural hepatoprotector,in periparturient dairy cows[J].Journal of Dairy Science,2004,87(7):2 239-2 247.
[5]El-Samaligy MS,Afifi NN,Mahmoud EA.Increasing bioavailability of silymarin using a buccal liposomal delivery system:preparation and experimental design investigation[J].International Journal of Pharmaceutics,2006,308(1):140-148.
[6]Elmowafy M,Viitala T,Ibrahim HM,et al.Silymarin loaded liposomes for hepatic targeting:In vitro evaluation and HepG2 drug uptake[J].European Journal of Pharmaceutical Sciences,2013,50(2):161-171.
[7]王选东.水飞蓟宾脂质体的制备及物理化学性质研究[D].苏州:苏州大学,2010.
[8]高 飞,王东凯,张春叶,等.乙醇注入法制备水飞蓟宾脂质体及其质量评价[J].中国药剂学杂志,2008,6(6):301-308.
[9]肖衍宇,宋 梅,陈志鹏,等.水飞蓟素前体脂质体的制备和大鼠药代动力学的研究[J].药学学报,2005,40(8):758-763.
[10]徐 冰,张红梅,唐卫东.水飞蓟壳中总黄酮提取工艺优选研究[J].中国药师,2013,16(2):236-238.
[11]吴 琼,程 怡,聂 华.多西他赛长循环脂质体包封率的测定方法的研究[J].时珍国医国药,2012,23(5):1 069-1 071.
[12]王 娜,王海娇,岳明新,等.高效液相色谱常见问题分析与对策[J].辽宁化工,2008,37(4):277-280.
[13]Torchilin V,Weissig V.Liposomes:a practical approach[M].ed 2.Oxford:Oxford University Press,2003:5-18.
Studies on the Preparation Methods of Silybin Liposomes
He Wen1,Hu Cuiping2,Guo Xianxi1
(1.Renmin Hospital of Wuhan University,Wuhan,Hubei,China 430060; 2.School of Pharmaceutical Science,Wuhan University,Wuhan,Hubei,China 430071)
Objective To screen the best method to prepare silybin liposomes.M ethods Silybin liposomes were respectively prepared by film dispersion method,multiple emulsion method,and reverse evaporation method.The morphological characteristic of the liposomes was observed by optical microscope.The filter membrane method was employed to isolate free silybin,and HPLC was used to determine the drug content and the entrapment efficiency of silybin liposomes.The entrapment efficiency and particle size distribution as the indices, the best prepareration method was chosen.Results Before high-speed shearing,the liposomes respectively prepared by the three methods are spheroidal without no difference.The entrapment efficiency of the liposomes respectively prepared by film dispersion method, multiple emulsion method and reverse evaporation method,was respectively(88.67±16)%,(68.88±1.5)% and(59.96±1.2)%; while the encapsulation efficiency was respectively (72.32±7.6)%,(31.68±3.1)% and (37.66±1.4)% after high-speed shearing.The mean diameter of silybin liposomes were(134.8±2.5)nm,(138.5±2.5)nm and (165.0±1.1)nm after high-speed shearing.The polydispersity indeice were 0.235,0.182 and 0.233,respectively.Conclusion The encapsulation efficiency of silybin liposomes prepared by the film dispersion method is the highest,and the effect of decreasing size on the entrapment efficiency is not evident, which can provide experimental foundation for the further study of the liver targeting preparation.
silybin;liposomes;encapsulation efficiency;polydispersity index
R944;TQ461
A
1006-4931(2016)01-0049-04
2015-06-27)
