α-酮酸酯的生物活性及合成研究进展
2016-03-23谢媛媛蒋筱莹
谢媛媛,蒋筱莹
(浙江工业大学 长三角绿色制药协同创新中心,浙江 杭州 310014)
α-酮酸酯的生物活性及合成研究进展
谢媛媛,蒋筱莹
(浙江工业大学 长三角绿色制药协同创新中心,浙江 杭州 310014)
摘要:α-酮酸酯及其衍生物是一种双官能团化合物,结构特殊,是有机合成及生物代谢的重要中间体,具有广泛的生物学活性,被用于各种酶抑制剂及生物碱的合成,同时它也是一类重要的医药合成中间体,在有机合成及药物研发中具有重要意义.为了促进α-酮酸酯及其衍生物的研究与发展,在此总结并综述了该类化合物的生物活性,其生物活性主要体现在对各类酶的抑制作用上,从而能够达到治疗各种疾病的目的.此外,阐述了近年来研究报道的几种简便高效的合成该类化合物的新方法,并对这些方法进行了评价,在该类化合物的合成与发展上具有一定的指导和借鉴意义.
关键词:α-酮酸;α-酮酸酯;生物活性;酶抑制剂;合成
α-酮酸酯及其衍生物是一种结构简单而又特殊的化合物,具有两个羰基,性质活泼不稳定,很少在自然界存在.在生物体内,一般以代谢中间体的形式存在,是合成各种杂环化合物、糖类、蛋白质、核糖、酶抑制剂、酶作用底物及生物碱等的中间体,可作为众多物质的消化前体和合成前体,在药物的合成和研发中应用十分广泛,包括抗肿瘤药、抗高血压药、抗病毒药等等.由于其广泛的生物学活性,具有较好的研究和开发价值,其合成方法也是层出不穷,已成为近几年来生物化学和有机化学领域的研究热点之一.为了促进α-酮酸酯及其衍生物的研究与发展,在此较为系统的综述了α-酮酸酯及其衍生物的生物活性,介绍了近几年来合成该类物质的新方法并对这些方法进行了评价,最后对其发展趋势进行了探讨,阐述了其在药物设计与开发中的意义.
1生物活性
众所周知,酶的活性直接影响到生物体内的代谢能力以及其他的生理机能,从而会导致机体产生一系列的疾病,而α-酮酸酯及其衍生物的生物活性主要体现在对各种酶的抑制作用.
1.1 肾素抑制剂
肾素是一种天冬氨酰蛋白酶,它能催化肝脏分泌进入血浆中的血管紧张素原转变成血管紧张素Ⅰ(10肽),血管紧张素Ⅰ几乎没有活性,它又可以被血管紧张素转换酶水解成血管紧张素Ⅱ(8肽),它是一种强有力的血管收缩剂,能够促进醛固酮的分泌.肾素是肾素-血管紧张素系统的重要组成部分,它的释放是决定血浆中血管紧张素浓度的关键性条件.而阻断肾素-血管紧张素系统对治疗高血压和充血性心力衰竭具有较好的效果,卡托普利就是第一个口服的血管紧张素转换酶抑制剂[1].由此可知:肾素抑制剂和血管紧张素转换酶抑制剂一样可以用来治疗高血压、高血脂[2]等心血管疾病,并且可以替代血管紧张素转换酶抑制剂成为一种新型的药物.
研究表明:在抑制剂结构中插入一些活性酮片段可以有效提高其抑制作用.Patel等[3]在肾素抑制剂中设计插入了3种活性酮片段,即三氟甲基酮、α-酮酸酯和α-1,2-二酮.他们通过Dakin-West反应合成了具有α-酮酸酯结构的抑制剂,其IC50(半数抑制浓度)只有(15±2) nM,该抑制剂结构式为

而经还原的α-羟基酯抑制剂的IC50更低,仅有(4.1±0.3) nM,其结构式为
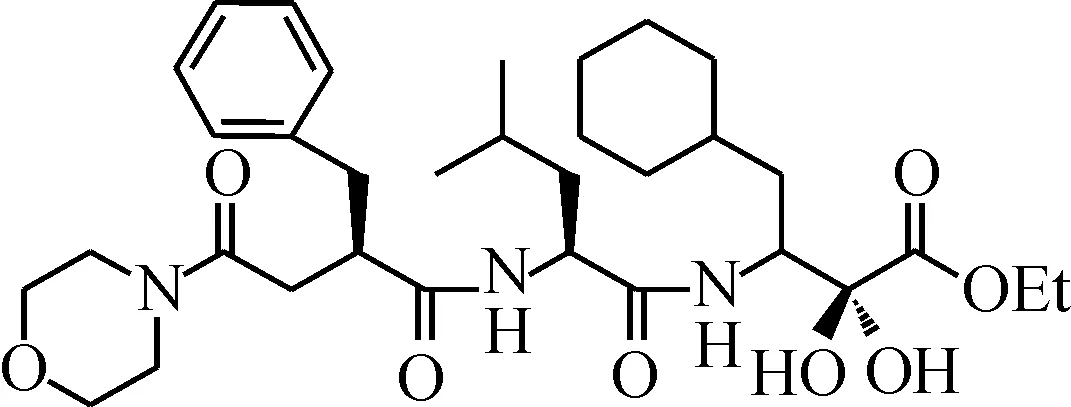
1.2 凝血酶抑制剂
凝血酶是一种丝氨酸蛋白酶,能够表现出促凝和抗凝的性质,它也是血液凝血级联反应中的主要效应蛋白酶.凝血酶由凝血酶原复合物中的非活性凝血酶原在Xa因子(FXa)的作用下通过蛋白裂解的方式产生.凝血酶能够激活血小板,催化纤维蛋白原转化为纤维蛋白,从而促进血块稳定而在血栓性疾病的引发和传播上有着核心作用.多数血栓栓塞疾病都是因为凝血酶的过度刺激作用引起的,因而,凝血酶抑制剂[4]便在治疗该类疾病方面发挥了巨大的作用.
研究表明:一些α-酮酸衍生物具有很好的抗凝血酶活性.Nobuhiro等[5]从海洋海绵生物体中分离提取到两种天然活性环肽类物质Cyclotheonamide A和B,该物质具有很好的抗凝血酶活性,其结构中含有α-酮酰胺片段.该物质结构式为

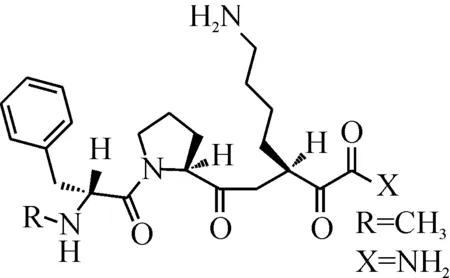
1995年,Brady等[6]研究了大量具α-酮酰胺结构的链状三肽,并对其进行结构修饰,得到了一系列具有较好抗凝血酶活性的衍生物,其中R=CH3,X=NH2时,稳定性最好.其结构式为
1.3 组蛋白去乙酰化酶抑制剂
在染色体结构修饰以及基因表达调控中,组蛋白去乙酰化酶(HDAC)的地位举足轻重.组蛋白乙酰化的作用是能够促进转录因子与DNA结合位点特异性结合,以达到激活基因转录的目的.因此基因的表达结果直接受到组蛋白乙酰化状态的影响.研究发现:许多癌细胞的产生都涉及到了HDAC的过度表达,而组蛋白去乙酰化酶抑制剂则能够通过调控相关蛋白的表达和稳定性,从而诱导细胞凋亡及分化,成为一类新的抗肿瘤药物研究方向.
Wada等[7]发现,具有α-酮酸酯和α-酮酰胺结构的化合物有效强的HDAC抑制作用.他们设计合成了一系列该类物质,其主要结构为

他们对R基团、X基团和n值进行了筛选,并建立了体内肿瘤模型,检测了它们的IC50值(半数抑制浓度).实验结果表明:当R为联苯基团,n=1,X为甲氧基时,具α-酮酸酯结构,IC50=0.062 μM;当R为联苯基团,n=1,X为甲胺基时,具α-酮酰胺结构,IC50=0.11 μM.两者均具有较高的HDAC抑制活性.
1.4 半胱氨酸蛋白酶抑制剂
半胱氨酸蛋白酶包括组织蛋白酶B(CB),H,L等,一般大多数都存在于溶酶体中,它们主要参与细胞吞噬和细胞内多余物质的清除和消化.正常组织中,CB最适pH为酸性,但肿瘤组织中CB却在中性或碱性时活性更高,它会参与肿瘤的浸润转移,促使恶性肿瘤代谢紊乱.
Strojan等[8]研究发现:半胱氨酸蛋白酶及其抑制剂,在癌组织中的浓度远高于癌旁组织中,认为它们可能与肿瘤的浸润性生长过程有关.因此半胱氨酸蛋白酶抑制剂在治疗癌症方面也能发挥良好的作用,而这种抑制剂中同样也有一些具有α-酮酸的结构.
Otto等[9]曾报道了一篇有关半胱氨酸蛋白酶及其抑制剂的综述,其中含有α-酮酸、α-酮酸酯、α-酮酰胺和二酮结构的抑制剂便是一种人工合成的小分子抑制剂,其中α-酮酸抑制剂的抑制效果最好,其次是α-酮酸酯和二取代的α-酮酰胺,它们均具有较好的抑制效果.该类抑制剂还可用于锥虫病的治疗,锥虫病是由克氏维虫引起的寄生虫病,是许多拉丁美洲国家引起心血管疾病的主要原因,而半胱氨酸蛋白酶是寄生虫存活的重要物质.Choe等[10]研究发现了一系列具有α-酮酸、α-酮酸酯和α-酮酰胺结构的抑制剂,它们具有类似的母核结构,分别对其P1',P1,P2,P3进行结构修饰,可以得到IC50值仅为0.466 μM的抑制剂.其母核结构为

1.5 酪氨酸磷酸酶抑制剂
蛋白酪氨酸磷酸酶(PTPases)和激酶能够调节蛋白质的酪氨酸磷酸化水平,是控制细胞内信号转导通路的关键机制之一.PTPases的过度表达会引起许多疾病,如PTP1B对胰岛素信号转导具有负调节作用,使胰岛素受体无法与胰岛素结合,导致II型糖尿病和肥胖症;PTP1B在胃癌细胞中也会过度表达,从而促进胃癌细胞的增殖和发展;该酶还与鼠疫杆菌引起的黑死病有关.因此,研究和开发PTPases抑制剂十分必要.
2003年,Chen等[11]采用将一种未水解的磷酸化酪氨酸类似物结合到蛋白酪氨酸磷酸酶底物上的方法来合成酪氨酸磷酸酶抑制剂,这种类似物中具有α-酮酸、α-羟基酸和甲磺酰胺等结构,他们分别检测了含有这三种结构的抑制剂对鼠疫杆菌的抑制作用,其中含有α-酮酸结构的抑制剂的IC50值最低为(150±15) μM.该抑制剂结构式为

2004年,Chen等[12]又进一步研究了具有α-酮酸结构的酶抑制剂.他们合成了104个具有相同母核但R基团不同的酪氨酸磷酸酶抑制剂,并检测了它们对鼠疫杆菌酶、PTP1B等的抑制作用,PTP1B抑制剂的IC50值最低可达(0.59±0.07) μM.该抑制剂母核结构为
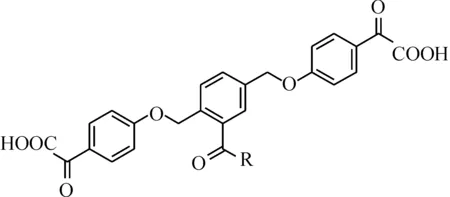
1.6 中性粒细胞弹性蛋白酶抑制剂
中性粒细胞弹性蛋白酶(NE)是一种丝氨酸蛋白酶,由中性粒细胞分泌产生.NE与人类许多疾病的发生息息相关,如机体各种炎症反应、组织损伤重构,呼吸窘迫综合征、肺损伤、肺气肿、肺水肿、心肌炎[13]、动脉粥样化等等.NE能够降解各种胶原蛋白以及组织的细胞外基质,而在炎症反应中,NE会释放过量,促使组织的通透性增加,使炎症恶化.而中性粒细胞弹性蛋白酶抑制剂(NEI)能够有效抑制NE的活性,继而抑制炎症细胞的激活和跨膜迁移,同时也能抑制组织毒性物质的释放,从而对机体发挥多层次的抗炎效应来调节其先天免疫功能[14].
1990年,Peet等[15]合成了含三氟甲基酮和α-酮酸酯结构的活性肽,并比较了它们对大鼠和人类中性粒细胞弹性蛋白酶的抑制作用,发现具有三氟甲基酮和α-酮酸酯结构的活性肽均有高效的抑制作用,其Ki值(抑制剂常数)仅有0.58 nM.其结构式为
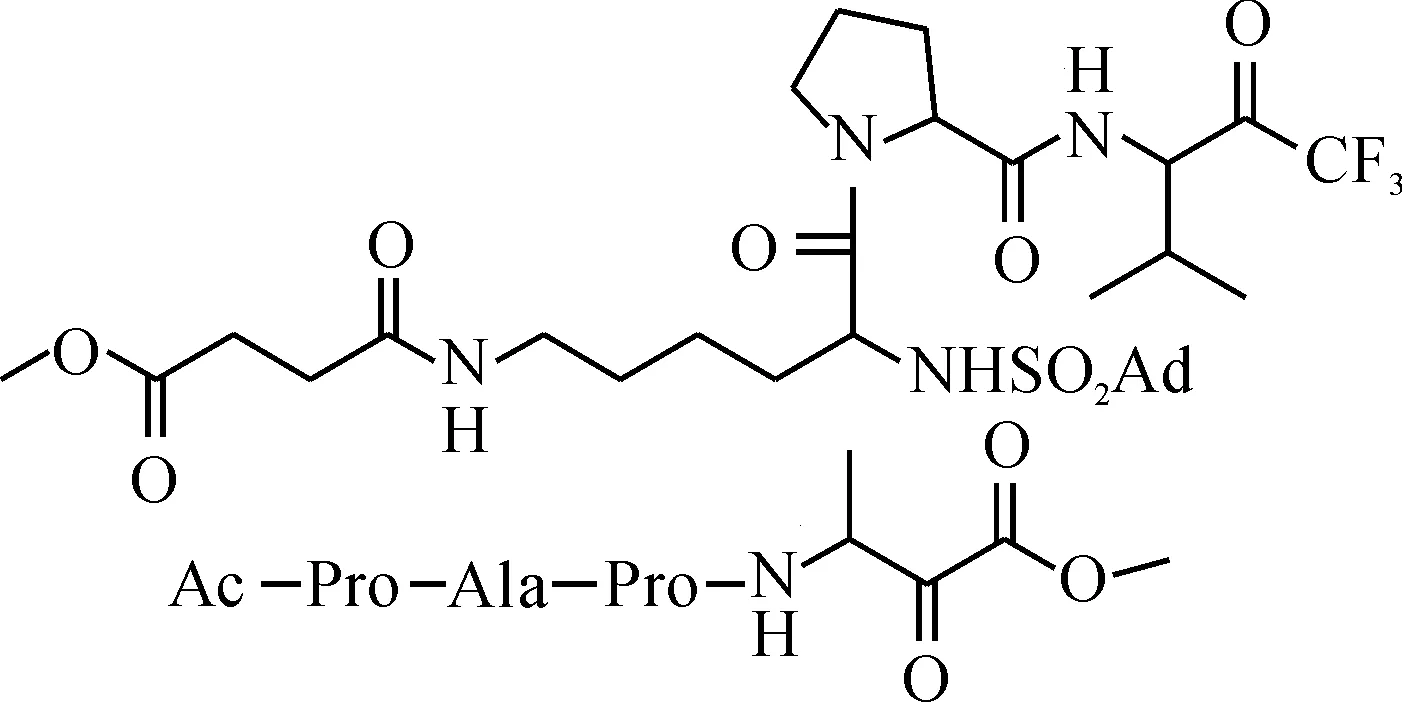
1998年,Burkhart等[16]制备了一种α-酮酸酯的烯醇乙酸盐,它可以作为人类中性粒细胞弹性蛋白酶抑制剂的前药,口服生物利用度高,经代谢后可以生成具有α-酮酸酯结构的物质,抑制效果较好,其Ki值最低为2 nM.该物质结构式为
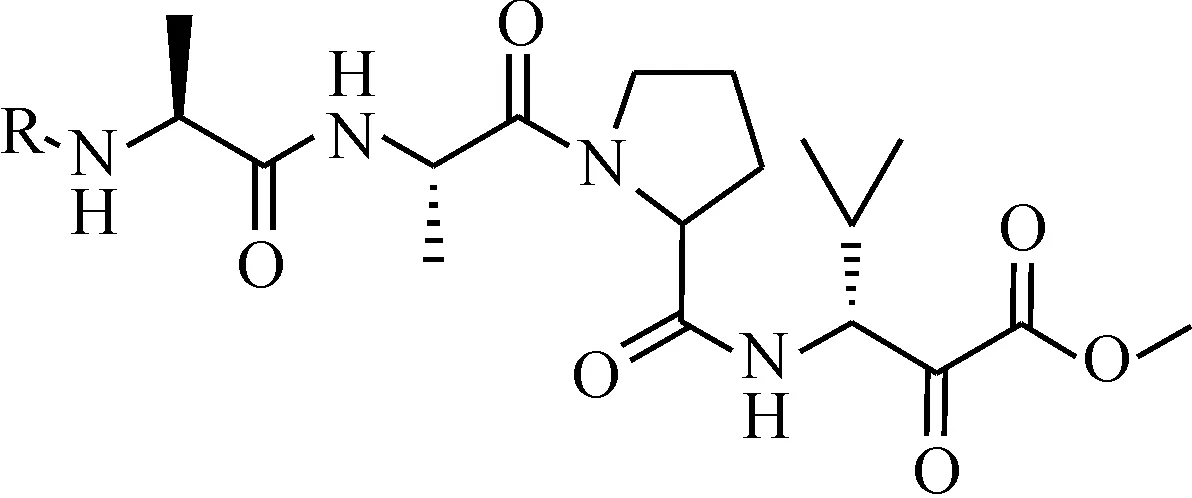
其中:R=4-ClC6H4SO2NHCOC6H4CO或R=CH3OCOCH2CH2CO.
1.7 HCV NS3蛋白酶抑制剂
丙型病毒性肝炎是一种由丙型肝炎病毒(HCV)感染引起的病毒性肝炎.目前,世界上已有2-3亿人正遭受着丙型肝炎病毒的侵害,其新发病例及死亡率都在不断上升,已成为严重的社会和公众卫生问题.因此,寻找安全有效的治疗方法及疫苗是生物医学界重点关注的问题.
近几年来,HCV NS3蛋白酶成为抗HCV药物研究的重要靶点,它直接影响了病毒体的成熟和复制[17].α-酮酸衍生物对HCV NS3蛋白酶也具有一定抑制作用.2002年,Colarusso等[18]研究发现一种具α-酮酸结构的六肽有很好的酶抑制活性,但其口服生物利用度不高,因此他们设计合成了一种具有α-酮酸结构的三肽,并对其进行结构修饰,得到最小IC50值为0.30 μM.该三肽结构式为
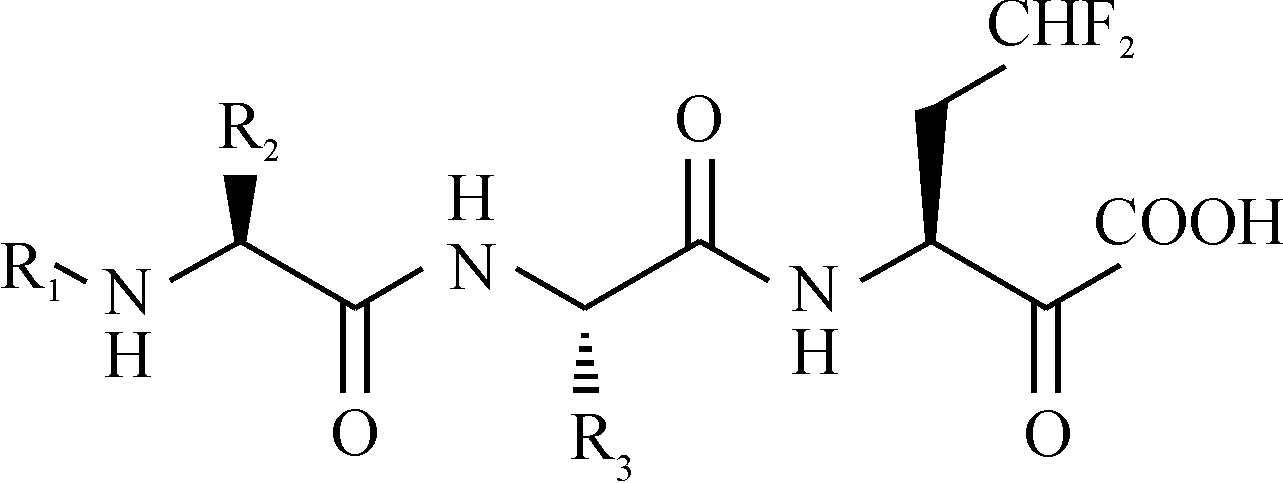
其中:R1=Boc;R2=Glu;R3=DifluoroAbu.
同年,Zizi等[19]也报道了具有与前者类似的α-酮酸结构的三肽,其最低IC50值为0.38 μM.该三肽结构式为

1.8 HIV-1蛋白酶抑制剂
艾滋病主要由I型人类免疫缺陷性病毒(HIV-1)引起,它主要攻击人类免疫系统中的T淋巴细胞,使人体丧失免疫功能.艾滋病是一种跨种族传播的、死亡率很高的疾病,已成为世界第四大致死疾病,对其进行有效治疗已成为医学界最具挑战性的课题.
Kitazaki等[20]研究了一系列HIV-1蛋白酶抑制剂,发现具α-酮酰胺结构的一种六肽有抑制活性,进一步研究发现具α-酮酰胺结构的三肽有更高的抑制活性,成为HIV-1蛋白酶抑制剂研发的新方向.该三肽结构式为

2000年,Sheha等[21]设计并合成了一些具α-酮酰胺结构的二肽和三肽类似物,通过结构修饰,在50 nM浓度水平下,它们的HIV-1蛋白酶抑制活性高达97.7%.该抑制剂结构式为

2合成方法
α-酮酸酯类衍生物的合成方法有很多,主要有格氏试剂法、氧化法、Friedel-Crafts酰基化法、羰基化法、重排法、水解法等等,鉴于该类物质的合成方法已有诸多综述进行过总结[22-23],在此主要介绍近几年来文献报道的新方法,并对其进行评价.
2000年,Nikalje等[24]采用铜盐催化芳基硝基羟醛来合成相应的α-酮酸.该方法产率普遍较高,可达97%,催化剂可进行回收,回收率可高达93%.但其原料不易得,反应温度较高,需90 ℃,反应的选择性也不好,有部分底物会氧化得到相应的醛而并非酸.其反应式为
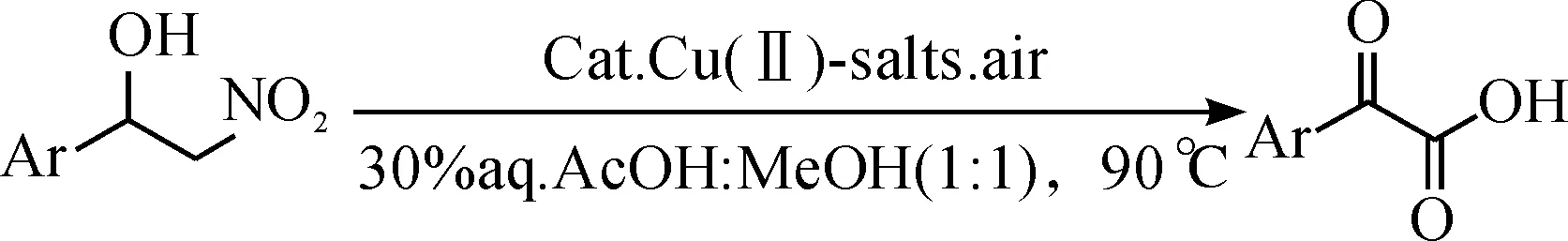
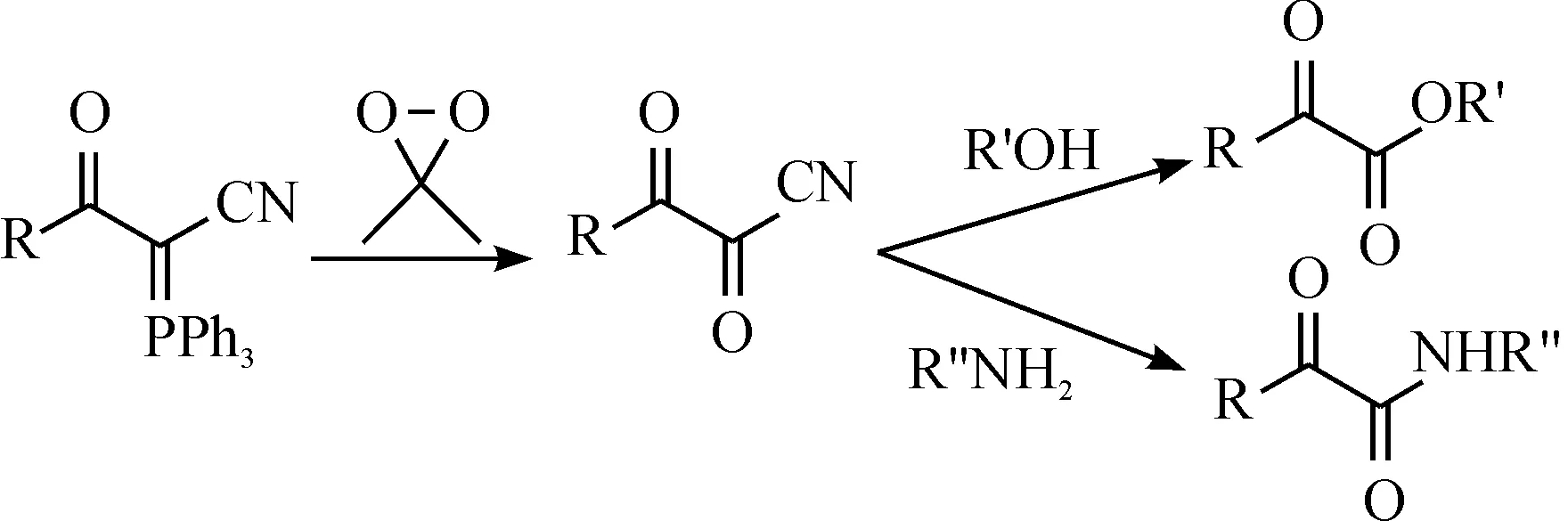
2001年,Wong等[25]用二甲基二环氧乙烷作氧化剂合成α-酮酸酯和α-酮酰胺,反应时间短(一般少于5 min),操作简便,产率可达89%,但其原料不容易制备,需要通过羧酸与磷叶立德反应得到,磷叶立德的制备较繁琐,并且α-酮酰胺的合成需要在-78 ℃下进行,反应条件苛刻,适用性不广.其反应式为
2007年,Shimizu等[26]以氰基甲酸乙酯和芳基硼酸为底物,在铑催化下合成α-酮酸酯,硼酸的加入提高了该反应的产率,其中铑可与芳基硼酸进行循环使用,产率可达87%.其中,从反应机理上推测,亲核试剂有可能进攻氰基甲酸乙酯的氰基和酯基两个位点,但在该反应中,已被证实该反应机理亲核试剂进攻的是氰基而并非酯基.其反应式为
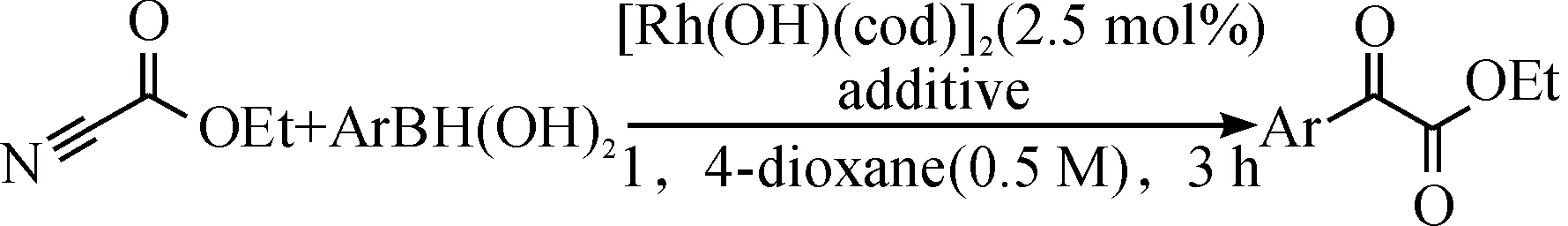
2011年,Tada等[27]在光照和氧气条件下,以48%溴化氢溶液为溶剂,用氧气直接氧化苯乙烷得到α-酮酸酯.该反应经过两个中间体,先是苯乙烷氧化成苯乙酮,接着进行溴代,最后脱去溴得到目标产物.此路线是以苯乙烷为原料,直接得到α-酮酸酯的新方法,但其产率只有64%.其反应式为

2012年,Reddy等[28]用TEMPO和次氯酸钙氧化α-羟基酯得到相应的α-酮酸酯,产率高达99%.该反应并未使用任何金属催化剂,也没有加入酸和碱,其中次氯酸钙的加入促使TEMPO的氧化效果更好,并且使反应体系呈中性,反应条件温和,对环境友好.其反应式为

2013年,Stergion等[29]采用过硫酸氢钾和三氯化铝体系将β-酮酸酯氧化成α-酮酸酯,该反应只需在室温下进行,用水做溶剂,相比于传统的金属催化反应其反应条件更加温和,反应时间短,基本无副产物,产率可达98%.其反应式为

2015年,Xu等[30]在氧气存在下,以三乙胺和甲苯为溶剂,以铜盐为催化剂,催化取代苯乙酮与醇的反应得到相应的α-酮酸酯,铜盐可以进行循环使用,该反应底物适用性较好,产率可达86%.但其用甲苯作溶剂,反应温度较高,在120 ℃以上,反应时间较长,需24 h以上,总的来说,反应条件比较苛刻.其反应式为

3结论
α-酮酸酯及其衍生物是一种结构特殊、性质活泼的化合物,是一类重要的有机合成中间体,具有广泛的生物学活性,在药物研发中,α-酮酸酯及其衍生物可作为生物体内各种酶的抑制剂,从而表现出广泛的药理活性,在抗肿瘤、抗病毒、抗炎症、抗高血压、抗丙型肝炎、抗艾滋病等方面都具有较好的应用前景,由于该类物质具有较好的生物学活性和广泛的应用价值,已成为近年来生物化学和有机化学领域的研究热点之一.由于该类化合物的重要性,其合成方法的研究与发展也是层出不穷,α-酮酸酯类衍生物的合成方法主要有格氏试剂法、Friedel-Crafts酰基化法、双羰基化法、重排法、水解法、氧化法等,近几年来,其合成方法研究较多并且运用较普遍的是氧化法,底物适用性较广,氧化体系多样,不同类型的氧化底物及氧化体系都发展得较为成熟.许多氧化体系被应用于其中,如Cu(Ⅱ),Rh,HBr/O2,TEMPO,Oxone/AlCl3等,反应收率良好.因此,寻找高效、价廉易得、绿色无污染的催化剂和原料,研发出便捷、条件温和、高效、环境友好的合成方法,开发更适用于工业化的路线,具有十分重要的意义.
参考文献:
[1]PETRILLO E W, ONDETTI M A. Angiotensin-converting enzyme inhibitors: medicinal chemistry and biological actions[J].Medicinal research reviews,1982,2:1-38.
[2]钱俊清,戴承恩,李尚谦,等.竹叶黄酮降血脂活性研究[J].浙江工业大学学报,2014,42(5):496-498.
[3]PATEL D V, KATHERINE R G, RYONO D E, et al. Activated ketone based inhibitors of human renin[J]. Journal of medicinal chemistry,1993,36(17):2431-2447.
[4]林陈水,陈微微.分泌型水蛭素Ⅱ基因工程菌的构建[J].浙江工业大学学报,2014,42(1):50-53.
[5]NOBUHIRO F, SHIGEKI M, HISAO M, et al. Cyclotheonamides, potent thrombin inhibitors, from a marine sponge theonella[J]. Journal of the american chemical society,1990,112:7053-7056.
[6]BRADY S F, SISKO J T, STAUFFER K J, et al. Amide and α-keto carbonyl inhibitors of thrombin based on arginine and lysine: synthesis, stability and biological characterization[J]. Bioorganic and medicinal chemistry,1995,3(8):1063-1078.
[7]WADA C K, FREY R R, JI Z Q, et al. α-Keto amides as inhibitors of histone deacetylase[J]. Bioorganic and medicinal chemistry letters,2003,13(19):3331-3335.
[8]STROJAN P, BUDIHNA M, SMID L, et al. Cathepsin b and l and stefin a and b levels as serum tumor markers in squamous cell carcinoma of the head and neck[J]. Neoplasma,2001,48(1):66-71.
[9]OTTO H H, SCHIRMEISTER T. Cysteine proteases and their inhibitors[J]. Chemical reviews,1997,97(1):133-171.
[10]CHOE Y, BRINEN L S, PRICE M S, et al. Development of α-keto-based inhibitors of cruzain, a cysteine protease implicated in chagas disease[J]. Bioorganic and medicinal chemistry,2005,13(6):2141-2156.
[11]CHEN Y T, XIE J, SETO C T. Peptidic α-ketocarboxylic acids and sulfonamides as inhibitors of protein tyrosine phosphatases[J]. Journal of organic chemistry,2003,68(10):4123-4125.
[12]CHEN Y T, SETO C T. Parallel synthesis of a library of bidentate protein tyrosine phosphatase inhibitors based on the α-ketoacid motif[J]. Bioorganic and medicinal chemistry,2004,12:3289-3298.
[13]李乐,尚好,陶厚权.贯叶连翘提取物对扩张型心肌病大鼠血流动力学的影响[J].浙江工业大学学报,2013,41(4):414-417.
[14]张瑞霞,龙尧.中性粒细胞弹性蛋白酶抑制剂在疾病中的作用[J].医学综述,2008,14(6):919-921.
[15]PEET N P, BURKHART J P, ANGELASTRO M R, et al. Synthesis of peptidyl fluoromethyl ketones and peptidyl α-keto esters as inhibitors of porcine pancreatic elastase, human neutrophil elastase, and rat and human neutrophil cathepsin g[J]. Journal of medicinal chemistry,1990,33(1):394-405.
[16]BURKHART J P, MEHDI S, KOEHL J R, et al. Preparation of α-keto ester enol acetates as potential prodrugs of human neutrophil elastase inhibitors[J]. Bioorganic and medicinal chemistry letters,1998,8:63-64.
[17]屈莉红,陈良,王介非.HCV NS3蛋白酶及抑制剂的研究进展[J].Chinese hepatology,2007,12(3):205-205.
[18]COLARUSSO S, GERLACH B, KOCH U, et al. Evolution, synthesis and sar of tripeptide α-ketoacid inhibitors of the hepatitis C virus NS3/NS4 a serine protease[J]. Bioorganic and medicinal chemistry letters,2002,12:705-708.
[19]NIZI E, KOCH U, PONZI S, et al. Capped dipeptide α-ketoacid inhibitors of the HCV NS3 protease[J]. Bioorganic and medicinal chemistry letters,2002,12(22):3325-3328.
[20]KITAZAKI T, ASANO T, KATO K, et al. Synthesis and human immunodeficiency virus (HIV)-1 protease inhibitory activity of tripeptide analogues containing a dioxoethylene moiety[J]. Chemical and pharmaceutical bulletin,1994,42(12):2636-2640.
[21]SHEHA M M, MAHFOUZ N M, HASSAN H Y, et al. Synthesis of di-and tripeptide analogues containing α-ketoamide as a new core structure for inhibition of HIV-1 protease[J]. European journal of organic chemistry,2000,35(10):887-894.
[22]王宇婷,张青枝,张深松.α-酮酸酯的合成研究进展[J].有机化学,1996,16(4):310-322.
[23]尹志刚,李和平,陈玉珍,等.α-酮酸酯合成研究进展[J].桂林理工大学学报,2013,33(4):717-730.
[24]NIKALJAE M D, ALI I S, DEWKAR G K, et al. Synthesis of aryl α-keto-acids via the Cu-catalyzed conversion of aryl nitroaldol products[J]. Tetrahedron letters,2000,41:959-961.
[25]WONG M K, YU C W, YUEN W H, et al. Synthesis of α-keto esters and amides via oxidative cleavage of cyanoketophosphoranes by dimethyldioxirane[J]. Journal of organic chemistry,2001,66:3606-3609.
[26]SHIMIZU H, MURAKAMI M. Synthesis of α-keto esters by the rhodium-catalysed reaction of cyanoformate with arylboronic acids[J]. Chemical communications,2007,27:2855-2857.
[27]TADA N, BAN K, NOBUTA T, et al. Direct synthesis of α-keto esters from ethylbenzenes using 48% aqueous hbr by aerobic visible light photooxidation[J]. Synlett,2011,10:1381-1384.
[28]REDDY S R, STELLA S, CHADHA A. Simplified procedure for tempo-catalyzed oxidation: selective oxidation of alcohols, α-hydroxy esters and amides using tempo and calcium hypochlorite[J]. Synthetic communications,2012,42:3493-3503.
[29]STERGIOU A, BARIOTAKI A, KALAITZAKIS D, et al. Oxone-mediated oxidative cleavage of βketo esters and 1, 3-diketones to αketo esters and 1, 2-diketones in aqueous medium[J]. Journal of organic chemistry,2013,78:7268-7273.
[30]XU X Z, DING W, LIN Y G, et al. Cu-catalyzed aerobic oxidative esterification of acetophenones with alcohols to αketoesters[J]. Organic letters,2015,17:516-519.
(责任编辑:刘岩)
The research progress in bioactivity and synthesis of α-keto esters
XIE Yuanyuan, JIANG Xiaoying
(Collaborative Innovation Center of Yangtze River Delta Region Green Pharmaceutical, Zhejiang University of Technology, Hangzhou 310014, China)
Abstract:α-keto esters and their derivatives are double functional compounds, with a special structure. They are important intermediates of organic synthesis and biological metabolism. They exhibit a broad range of biological activities including antiparasitic, anticancer and anti viral activities. Thus they have been widely used in the synthesis of various enzyme inhibitors and alkaloids, they are also a kind of important pharmaceutical intermediates, and have great significance in organic synthesis and drug development. In order to promote their research and development, this work summarizes their bioactivities, which mainly embody in inhibition of many enzymes and are subsequently applied in treating various diseases. Furthermore, it outlines and evaluates several simple, efficient and representative new synthetic methods which have been reported in resent years, these methods provide a certain guidance and reference significance for the synthesis and development of α-keto esters and their derivatives.
Keywords:α-keto acids; α-keto esters; bioactivity; enzyme inhibitors; synthesis
中图分类号:R914
文献标志码:A
文章编号:1006-4303(2016)01-0078-06
作者简介:谢媛媛(1976—),女,安徽宿州人,教授,博士生导师,主要从事药物及中间体的绿色合成新方法、新技术工艺研究, Email:xyycz@zjut.edu.cn.
基金项目:浙江省钱江人才计划项目(2013R10059)
收稿日期:2015-06-16
