RP-HPLC测定伊赫乌兰-13中的氧化苦参碱
2016-03-21邹继红王洪斌赵春杰赤峰学院医学院内蒙古赤峰04000赤峰市传染病防治医院内蒙古赤峰04000沈阳药科大学药学院辽宁沈阳006
邹继红,王洪斌,赵春杰(.赤峰学院 医学院,内蒙古 赤峰 04000;.赤峰市传染病防治医院,内蒙古 赤峰 04000;.沈阳药科大学 药学院,辽宁 沈阳 006)
RP-HPLC测定伊赫乌兰-13中的氧化苦参碱
邹继红1,王洪斌2,赵春杰3
(1.赤峰学院医学院,内蒙古赤峰024000;2.赤峰市传染病防治医院,内蒙古赤峰024000;3.沈阳药科大学药学院,辽宁沈阳110016)
摘要:目的:建立RP-HPLC测定伊赫乌兰-13中氧化苦参碱含量的方法.方法:采用Shim-pack CLC-ODS柱,流动相为甲醇-0.1%三乙胺=3∶8(磷酸调pH至3.0),检测波长为210nm,流速为1.0mL·min-1.结果:氧化苦参碱的浓度在4.04~40.4μg·mL-1范围内与峰面积呈良好的线性,回归方程为:Y=40.113X+0.2584,(r=0.9997);平均加样回收率为99.1%,RSD= 1.6%(n=9).结论:所用方法简便、快速、准确,适用于伊赫乌兰-13中氧化苦参碱的质量控制.
关键词:RP-HPLC;伊赫乌兰-13;氧化苦参碱;含量测定
蒙药伊赫乌兰-13由土木香、苦参、栀子、茜草、悬钩子木、山柰、诃子、川楝子、枇杷叶、紫草茸、橡子、紫草、金莲花组成,具有清血热之功效,临床上主要用于头痛、血热上盛、目赤、高血压等病症[1].作者查阅相关文献,未见测定方中主药苦参的活性成分氧化苦参碱的含量的相关报道,为了有效控制该制剂的内在质量,作者以氧化苦参碱的含量作为测定指标,采用RP-HPLC测定,方法学验证结果表明方法简便,结果准确,其它组分不干扰氧化苦参碱的测定,可作为伊赫乌兰-13的质量控制方法.
1 仪器与试剂
1.1仪器
FA2104N电子天平;美国Agilent 1200高效液相色谱仪;UV759紫外可见分光光度计.
1.2试剂
氧化苦参碱对照品(批号110780-201408,购自北京中国药品生物制品检定所,含量为99.9%);分析纯试剂磷酸和三乙胺;色谱甲醇;娃哈哈纯净水.蒙药伊赫乌兰-13(由内蒙古民族大学附属医院蒙药制剂室制备,批号:20140805、20141004、20141106);阴性对照品的药材(购自内蒙古赤峰市中蒙医院).
2 方法与结果
2.1色谱条件
Shim-pack CLC-ODS色谱柱(250mm×6.0 mm,内径5μm);柱温:室温;流动相为甲醇-0.1%三乙胺(3∶8,用磷酸调节pH至3.0);检测波长:210nm;流速:1.0mL·min-1;进样体积为20μL.
2.2对照品溶液、供试品溶液和阴性样品溶液的制备
取氧化苦参碱对照品,精密称取5.05mg,置于25mL量瓶中,加流动相溶解,稀释至刻度,制得202μg·mL-1氧化苦参碱的对照品储备液.吸取储备液1.0mL,置于10mL量瓶中,用流动相稀释至刻度,即为20.2μg·mL-1氧化苦参碱的对照品溶液.
取已研细的伊赫乌兰-13细粉4.0g,精密称定,置于250mL具塞锥形瓶中,加入0.1mL氨水,25mL无水乙醇,密塞,超声溶解30min,放冷至室温,用滤纸滤过,滤器与锥形瓶用无水乙醇洗涤4次,每次5mL,将滤液与洗液合并,并于水浴上蒸干,蒸干的残渣用流动相溶解,并定容至10mL.再用0.45μm微孔滤膜滤过,制得供试品溶液.
依据伊赫乌兰-13的处方要求,制备不含苦参碱的样品,按制备供试品溶液同样的方法进行制备,滤过,制得阴性样品溶液.
2.3专属性试验
分别吸取20μL阴性样品溶液、氧化苦参碱对照品溶液和供试品溶液,在“2.1”项的色谱条件下,注入高效液相色谱仪,所得图谱如图1所示.由图可以看出:阴性样品不干扰氧化苦参碱的测定,氧化苦参碱的保留时间约4.3min左右,与其他组分可达到基线分离.
2.4稳定性考察
吸取20μL同一份供试品溶液,分别于室温放置0、1、2、4、6、8、10h时注入高效液相色谱仪,测定氧化苦参碱的峰面积,RSD=1.9%,表明供试品溶液在10h内稳定,满足测定要求.
2.5重复性考察
取同一批伊赫乌兰-13样品(批号20141106),精密称取适量,按“2.2”的方法制备供试品溶液6份,在“2.1”项的色谱条件下,将供试品溶液注入高效液相色谱仪,测定氧化苦参碱的峰面积,计算可得平均含量为0.056mg·g-1,RSD=1. 8%,说明方法的重复性很好.
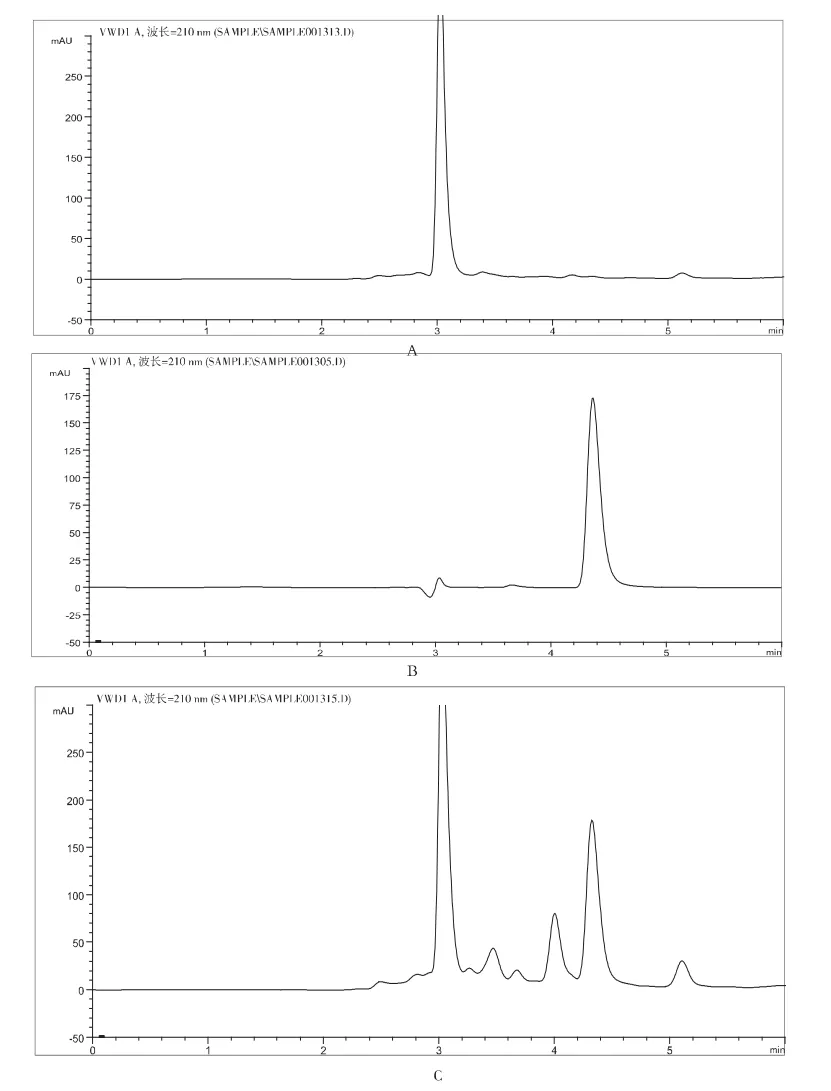
图1 高效液相色谱图
2.6精密度考察
分别吸取20μL供试品溶液和氧化苦参碱对照品溶液,注入高效液相色谱仪,测定氧化苦参碱的峰面积,重复测定6次,样品的RSD=1.5%,对照品的RSD=0.9%,说明仪器的精密度很好.
2.7线性范围考察
在6个50mL量瓶中,分别加入氧化苦参碱对照品储备液1.0、2.0、6.0、8.0、10.0mL,加流动相稀释刻度,得到6个浓度的苦参碱对照品溶液.分别吸取6个对照品溶液各20μL,分别注入高效液相色谱仪,测定氧化苦参碱的峰面积.以峰面积为纵坐标,氧化苦参碱的浓度(μg·mL-1)为横坐标,进行线性回归,回归方程为:Y=40.113X+0.2584,(r=0. 9997).结果表明氧化苦参碱浓度在4.04~40.4μg·mL-1范围内与峰面积有良好的线性关系.
2.8加样回收率试验
分别精密称取9份氧化苦参碱含量已知的同一批(批号20141106,含量为0.056mg·g-1)样品粉末3.0g,依次加入202μg·mL-1的氧化苦参碱对照品储备液0.6、0.8和1.0mL,按“2.2”项下的方法进行处理,吸取20μL,注入高效液相色谱仪,测定氧化苦参碱的峰面积,计算回收率,结果如表1所示.
2.9样品的测定
取3个批号样品(20140805、20141004、20141106),按“2.2”项下方法制备供试品溶液,分别吸取20μL氧化苦参碱对照品溶液和3份供试品溶液,注入高效液相色谱仪,测定氧化苦参碱的峰面积,按外标法计算氧化苦参碱的含量,结果3批样品的平均含量分别为0.054、0.057和0.058 mg·g-1.
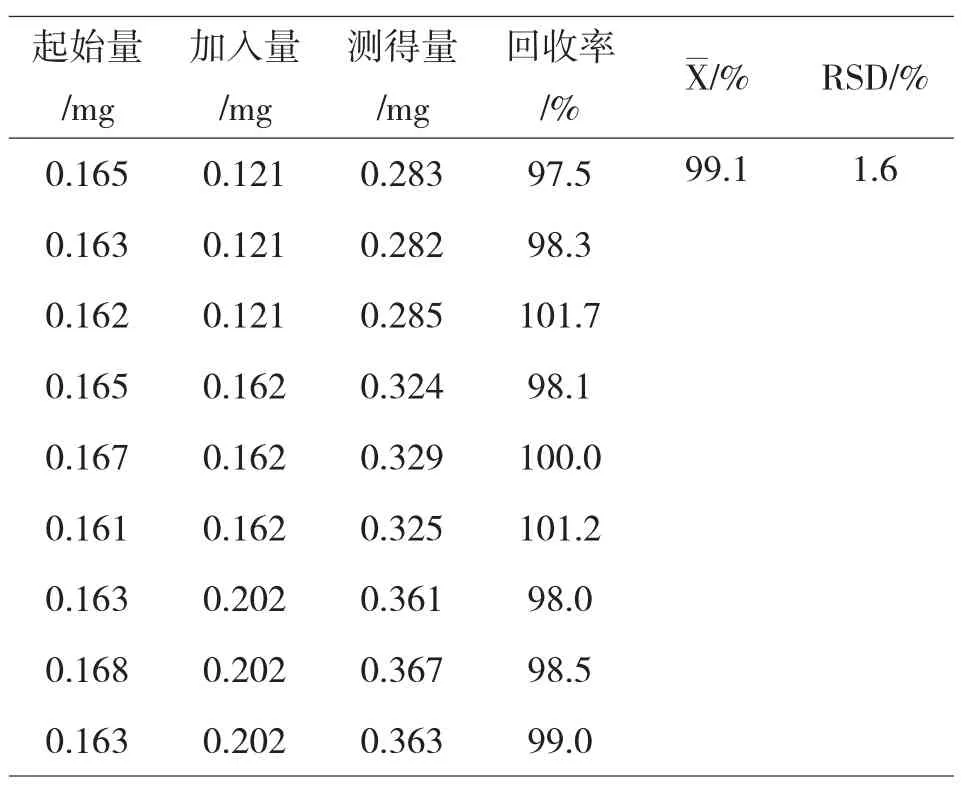
表1 加样回收率结果(n=9)
3 讨论
试验过程中,采用UV-759紫外-可见分光光度计扫描氧化苦参碱的紫外吸收光谱图,最大吸收波长为206nm,而甲醇的截止波长为210nm,导致测量结果偏高,故选取检测波长为210nm,可消除甲醇的干扰,保证氧化苦参碱的色谱峰基线平稳.选择流动相时,作者参考部分相关文献,尝试采用乙腈-无水乙醇-磷酸溶液[2]、乙腈-水[3]、乙腈-磷酸二氢钾-十二烷基硫酸钠-水[4]、磷酸-甲醇[5]作为流动相,发现氧化苦参碱的色谱峰严重拖尾或与其他组分无法完全分离.经过反复多次试验,最后当采用甲醇-0.1%三乙胺(3∶8,磷酸调pH至3.0)时,氧化苦参碱峰的对称因子符合要求,与其他组分的分离度良好.蒸干溶剂后分别采用无水乙醇和流动相溶解残渣,通过反复试验发现流动相溶解的样品中氧化苦参碱的色谱峰与其他组分的色谱峰分离度均≥1.5,且谱图干净,故最终采用流动相溶解残渣.
参考文献:
〔1〕白清云.中国医学百科全书·蒙医学[M].上海:上海科技出版社,1992.260.
〔2〕任永红,冯绍华.HPLC法测定康妇灵片中苦参碱和氧化苦参碱的含量[J].安徽医药,2009,13(2):154-155.
〔3〕梁燕,屈蓉,刘华章.HPLC法测定消炎止痢灵片中苦参碱和氧化苦参碱的含量[J].药学进展,2008,32(11):509-512.
〔4〕刘燕,曲延伟,刘园华.高效液相色谱法测定痔痛安软膏中苦参碱与氧化苦参碱的含量[J].食品与药品,2009,11 (3):38-40.
〔5〕江海,吴三桥,江珊,等.苦参和狼牙刺植株中苦参碱与氧化苦参碱的含量测定[J].湖北农业科学,2009,48(12):3136-3138.
基金项目:内蒙古自治区自然科学基金项目资助(2013MS1217)
收稿日期:2015-09-24
中图分类号:R927.2
文献标识码:A
文章编号:1673-260X(2016)01-0019-02
