白介素-1β增加血脑肿瘤屏障通透性的作用机制
2016-03-21孙月明秦丽娟
王 健,孙月明,秦丽娟
(华北理工大学基础医学院,河北唐山 063000)
白介素-1β增加血脑肿瘤屏障通透性的作用机制
王健,孙月明,秦丽娟
(华北理工大学基础医学院,河北唐山063000)
中国图书分类号: R322.81; R329.24; ; R392. 12; R977. 6
摘要:目的研究白介素-1β( interleukin-1β,IL-1β)对胶质瘤细胞内血管内皮生长因子( vascular endothelial growth factor,VEGF)、脑血管内皮细胞内质膜微囊结构蛋白caveolin-1表达和质膜微囊小凹的影响,初步探讨IL-1β开放血肿瘤屏障的可能机制。方法利用Transwell制备体外血肿瘤屏障模型。Western blot法动态监测IL-1β对胶质瘤细胞内VEGF、脑血管内皮细胞内caveolin-1蛋白表达水平的影响。透射电镜观察脑血管内皮细胞内质膜微囊小凹的数量,荧光素钠渗出实验评估IL-1β对血肿瘤屏障通透性的影响。结果成功建立了体外血肿瘤屏障模型。当IL-1β作用于体外血肿瘤屏障模型后,VEGF蛋白的表达量增加,于60min时达到峰值,至120min时恢复到初始状态。体外血肿瘤屏障通透性亦于IL-1β作用60min时最大。另外,我们的研究结果还发现,IL-1β作用于血肿瘤屏障模型60min时,脑微血管内皮细胞中质膜微囊结构蛋白caveolin-1的蛋白表达水平及质膜微囊小凹的数量达到峰值,其后减少,并于120min时恢复到未给药状态。结论IL-1β增加了血肿瘤屏障的通透性,此作用可能与IL-1β通过VEGF/caveolin-1途径增加了质膜微囊小凹数量有关。
关键词:血管内皮生长因子;白介素-1β;血肿瘤屏障; caveolin-1;胶质瘤;质膜微囊小凹
秦丽娟( 1975-),女,博士,副教授,硕士生导师,研究方向:脑肿瘤防治,通讯作者,E-mail: qinlj20012003@ 163.com。
神经胶质瘤简称胶质瘤,是起源于神经胶质细胞的一种恶性脑肿瘤。目前临床上对神经胶质瘤的治疗大多主张综合治疗,即临床手术后配合放化疗等,以此来延长患者的生存时间,遏制其复发[1-2]。在临床胶质瘤的治疗过程中,由于血肿瘤屏障的存在,化疗药物无法直接进入病灶,即使有少量进入,也会因瘤组织内化疗药物的有效浓度过低而达不到理想的治疗效果。因此,如何使抗肿瘤药物通过血肿瘤屏障进入肿瘤组织,是目前临床胶质瘤治疗亟待解决的问题之一[3]。
1 材料与方法
1.1主要试剂与仪器羊抗大鼠caveolin-1多克隆抗体(英国Abcam公司),羊抗大鼠VEGF多克隆抗体、小鼠抗大鼠β-actin单克隆抗体(美国Santa Cruz公司),C6细胞株和培养基(中国医学科学院基础医学研究所基础医学细胞中心),电泳仪( DYY-TB,北京六一仪器厂),半干式碳板转移电泳槽( DYY-Ⅲ40C,北京六一仪器厂),凝胶成像分析系统( Bio-Rad,美国),生物分子成像仪( Bio-Rad,美国)。
1.2C6细胞培养用含有10%胎牛血清的高糖DMEM培养基培养C6胶质瘤细胞,37℃孵箱内孵育,并通以5%CO2。
1.3原代脑微血管内皮细胞的培养采用出生2 ~3 d的Wistar大鼠4只,75%酒精中浸泡1 min后断头取脑,分离鼠脑,置于预冷的D-Hank’s液中,剔除大血管和脑膜,将皮质剪成1mm3的小块,玻璃匀浆器匀浆后加入15%葡聚糖10 mL,10 000×g离心15 min后弃上清,保留底部“血管段”加入4 mL DMEM(含20% FBS)及1 mLⅡ型胶原酶( 5 g· L-1),37℃水浴震荡孵育10 min,1000 r·min-1离心5min后弃上清,加入较大量DMEM培养液轻柔吹打均匀,接种于已涂布基质的35 mm一次性培养皿中,同时加入( 150~200) mg·L-1的ECGS,置于控温在37℃并通以5%的CO2的培养箱内静置培养,待细胞生长较密集后进行传代培养。
1.4体外血肿瘤屏障模型的制备首先将2.0× 108个·L-1密度的C6胶质瘤细胞接种于Transwell小室的下层,并加入适量的培养基。2 h后翻转小室,加入新鲜培养基。当细胞融合至80%时,将大鼠脑微血管内皮细胞接种至Transwell小室的上室(约1.2×105个细胞),继续共培养4~7d后融合。此后,每2 d更换1次培养基。
1.5体外血肿瘤屏障模型跨膜电阻( TEER)值测定采用Millicell ERS伏特欧姆计检测体外血肿瘤屏障模型的电阻。测量时将Millicell ERS伏特欧姆计模式置于欧姆档,打开电源,将STX01电极插入Transwell,长电极在外部,短电极在内部,电极与培养皿垂直。细胞跨膜电阻值计算公式: TEER = (ΔΩ测定值-ΔΩ空白值)×ΔA。ΔΩ测定值为Transwell小室的上、下室之间电阻值,ΔΩ空白值为未培养细胞但是具有相同体积培养液的空白Transwell小室的上、下室间电阻值,ΔA为Transwell小室的上、下室之间膜的面积。
1.6荧光素钠渗出实验测定血肿瘤屏障的通透性
测定前用无血清的DMEM培养液换液,加入100 mg·L-1荧光素钠和0. 5 μg·L-1的IL-1β于Transwell下室,于不同时间点( 10、30、60、90和120 min)从Transwell下室内取100μL培养液,用荧光分光光度计检测通过血肿瘤屏障模型的荧光素钠量,用荧光强度间接反映血肿瘤屏障通透性。
1.7Western blot法动态检测胶质瘤细胞内VEGF、血管内皮细胞内caveolin-1的蛋白表达水平
体外血肿瘤屏障模型下室给予IL-1β( 0. 5 μg· L-1)后,收集不同时间点的C6胶质瘤细胞和脑微血管内皮细胞,采用Western blot法检测胶质瘤细胞内的VEGF和脑血管内皮细胞内的caveolin-1的蛋白表达水平。PVDF膜置于WB爆光系统中曝光成像。对照组用PBS代替一抗。结果以蛋白表达强度表示,并通过分析各条带IDV值来分析各组蛋白表达的变化。
1.8透射电镜观察质膜微囊小凹数量变化收集对照组和IL-1β作用60min时的脑微血管内皮细胞,用预冷的戊二醛固定,按透射电镜要求制片,常规铅铀双染色,电镜下观察细胞超微结构改变。
1.9统计学处理采用SPSS 11.5软件进行统计学处理。跨膜电阻值、VEGF和caveolin-1的表达水平均以±s表示,多组间样本均数比较采用单因素方差分析。
2 结果
2.1跨膜电阻值变化评估体外血肿瘤屏障模型是否成功建立体外血肿瘤屏障模型成功建立的标准是电阻值达到201Ω·cm2。本实验研究发现,体外屏障模型的TEER值从3 d开始增加,于8 d后趋于平稳,至11 d达到了201Ω·cm2,即成功制备了体外血肿瘤屏障模型( Tab 1)。
2.2血肿瘤屏障的通透性变化IL-1β作用于血肿瘤屏障模型后,荧光素钠渗出量增加,60 min时达最大值( Fig 1)。
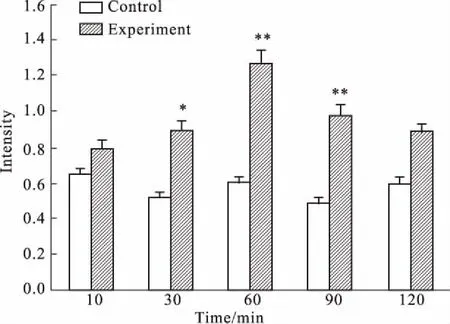
Fig 1 Leakage of sodium fluorescein( n =15)
2.3IL-1β对胶质瘤细胞内VEGF表达的影响
IL-1β作用于体外血肿瘤屏障模型后,C6细胞内VEGF的表达开始增加,至IL-1β作用60min时表达量最多,其后减少( Fig 2)。
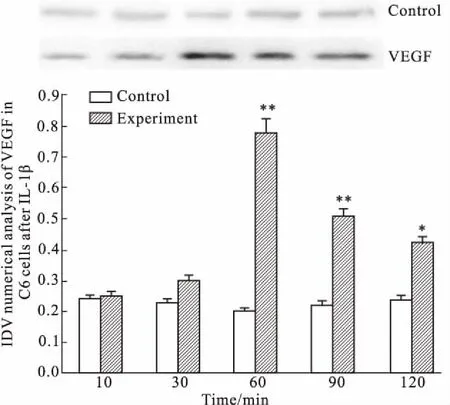
Fig 2 Effect of IL-1β on expression of VEGF in glioma cells( n =15)
Tab 1 TEER changes of blood tumor barrier model in vitro(±s,Ω·cm2,n =10)
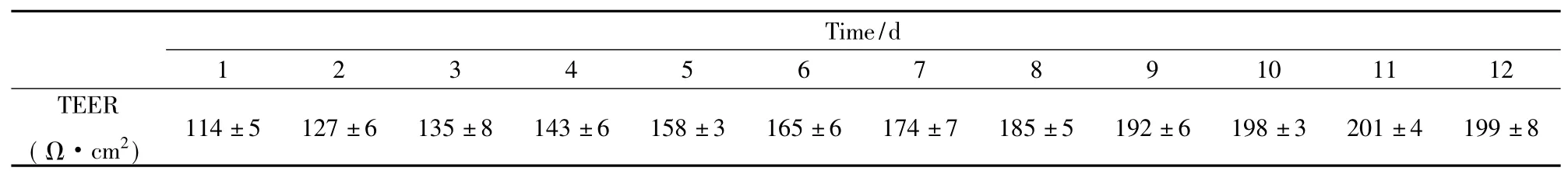
Tab 1 TEER changes of blood tumor barrier model in vitro(±s,Ω·cm2,n =10)
Time/d 1_______ _____2_______ ______________________________________________________________________________________ ______3_4_5_6_7_8_9_10_11_12 TEER _(Ω·cm2)____________________________________________________________________________________________________________ _114±5 127±6 135±8 143±6 158±3 165±6 174±7 185±5 192±6 198±3 201±4 199±8
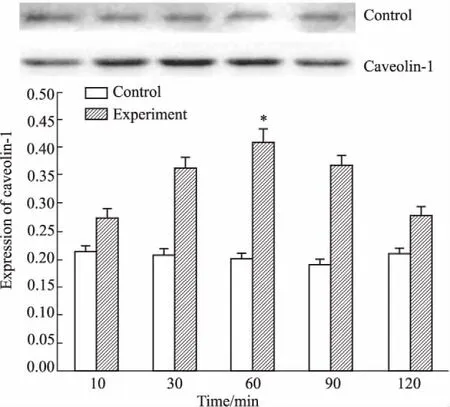
Fig 3 Effect of IL-1β on expression of caveolin-1 in brain microvascular endothelial cells( n =15)
2.5透射电镜观察质膜微囊小凹数量变化经IL-1β处理60min的脑微血管内皮细胞,其质膜微囊小凹数量较对照组明显增多( Fig 4)。
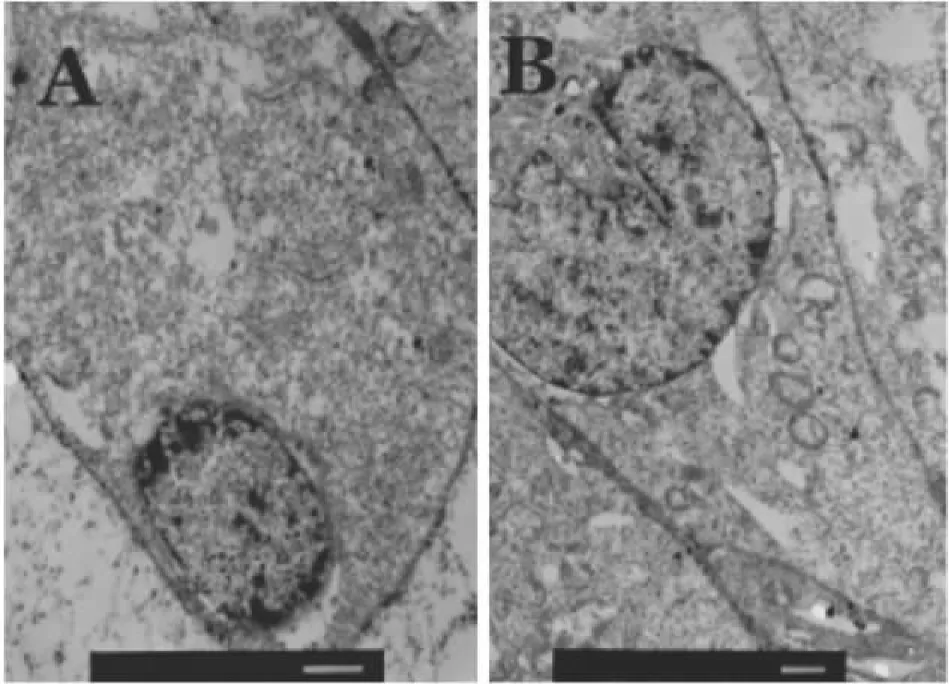
Fig 4 Changes of number of plasma membrane vesicles(×12 000)
3 讨论
IL是由多种细胞产生并作用于白细胞或免疫细胞之间的一种细胞因子。它的主要作用是激活与调节免疫细胞,引起炎症介质释放,活化T细胞,刺激B细胞的增殖与分化,并在炎症反应中起到致热源作用[4]。IL-1是一种分子多肽,有IL-1a及IL-1β两种亚型,分子质量皆为17. 5 ku。IL-1a由159个氨基酸组成,IL-1β含153个氨基酸。虽然两者是由不同的基因分别编码而成,但IL-1α和IL-1β具有同样的亲和力,都可以与相同的细胞表面受体相结合,发挥相同的生物学作用。
有研究证实: IL-1β可以引起动物可逆性的血肿瘤屏障损伤,在IL-1β过表达时,还可引起中性粒细胞浸润和中性粒细胞依赖性的血肿瘤屏障通透性增加。在本实验中,我们检测了IL-1β作用于血肿瘤屏障后荧光素钠渗出情况变化,发现IL-1β能够增加体外血肿瘤屏障模型的通透性,于60 min时变化最为明显。我们前期的实验研究结果也表明IL-1β与血肿瘤屏障的通透性增加有关,但其具体的分子作用机制尚不十分清楚[5]。
有研究发现,IL-1β的主要作用部位是血管内皮细胞[6-7]。而VEGF在血管内细胞的增殖、迁移和体内血管的形成过程中发挥着非常重要的作用[8-12]。我们的实验研究结果显示,IL-1β可以引起胶质瘤细胞内VEGF的表达增多,且于IL-1β作用于血肿瘤屏障模型60min时达高峰,其后减少,此变化趋势与IL-1β增加血肿瘤屏障通透性的时态变化相一致,因此我们推测,VEGF可能介导了IL-1β增加血肿瘤屏障通透性的过程。
血肿瘤屏障通透性的增加主要通过两条途径来实现,即跨细胞途径和细胞旁途径。本实验主要从跨细胞途径即吞饮小泡的形成方面来研究VEGF对IL-1β增加血肿瘤屏障通透性的影响。Caveola与标记蛋白caveolins一起合称为Caveolae,广泛存在于不同类型的细胞中。Caveolae最初在透射电镜中显示为“小孔”,而Yamada在1955年首次用细胞内caveolae来描述膀胱内皮细胞内发现的50~100nm胞质膜的内陷[13]。几年后Palade也在血管内皮细胞中发现了这种结构,并称为胞质小囊泡[14]。Caveolae是质膜上形成囊状内陷结构的主要因素[15],是caveolae发挥跨细胞内吞作用的关键因子[16]。为此,本研究采用免疫蛋白印迹法检测了IL-1β作用于脑血管内皮细胞后caveolin-1蛋白表达的变化,发现IL-1β能够上调质膜微囊标志蛋白caveolin-1的表达水平和质膜微囊小泡的数量,且于IL-1β作用后60min时最多,这与IL-1β引起的VEGF表达变化和血肿瘤屏障通透性变化的时相相一致,提示IL-1β可能是通过胶质瘤细胞释放VEGF,VEGF再作用于邻近的脑微血管内皮细胞来上调质膜微囊标志蛋白caveolin-1的表达水平,进而增加质膜微囊小凹的数量,从而增加了血肿瘤屏障的通透性。
在VEGF影响IL-1β增加血肿瘤屏障通透性的过程中,可能还有其他因子或信号通路参与其中,这是我们今后需要进一步探讨的问题。
米九也曾给他出过主意:应该把营业部的所有人带到寺庙里去,对着释迦牟尼佛赌咒发誓没有偷盗。当时他也不是没想过,可营业部里好几个都是汉族,而且自己虽然娶了个藏族老婆,可对赌咒发誓的事也不大相信。他后来还跟登子提过此事,登子也和他一个观点,觉得谁也不会在佛主前承认自己偷了东西。
(致谢:本研究是在华北理工大学基础医学实验中心完成,感谢实验中心为本研究提供实验平台和技术支持,感谢实验中心所有老师的指导。)
参考文献
[1]Harford-Wright E,Lewis K M,Vink R.Towards drug discovery for braintumours: interaction of kinins and tumours at the blood brain barrier interface[J].Recent Pat CNS Drug Discov,2011,6( 1) : 31 -40.
[2]Thompson E M,Frenkel E P,Neuwelt E A.The paradoxical effect of bevacizumab in the therapy of malignant gliomas[J].Neurology,2011,76( 1) : 87-93.
[3]秦丽娟,谷艳婷,王艳蕾,等.白介素-1β增加血脑肿瘤屏障通透性的作用机制[J].中国药理学通报,2013,29( 9) : 1248-51.
[3]Qin L J,Gu Y T,Wang Y L,et al.Adenosine receptor mediated effect and mechanism of tumor necrosis factor-α opening bloodtumor barrier[J].Chin Pharmacol Bull,2013,29( 9) : 1248-51.
[4]Isanejad A,Saraf Z H,Mahdavi M,et al.The effect of endurance training and downhill running on the expression of IL-1β,IL-6,and TNF-α and HSP72 in rat skeletal muscle.Cytokine[J].Cytokine,2015,73( 2) : 302-8.
[5]秦丽娟,薛一雪,谷艳婷,等.白介素-1β在缓激肽开放血脑屏障过程中的作用及其机制[J].中国药理学通报,2012,28( 1) : 58-61.
[5]Qin L J,Xue Y X,Gu Y T,et al.Effect and mechanisms of interleukin -1β in process of opening the blood -brain barrier by bradykinin[J].Chin Pharmacol Bull,2012,28( 1) : 58-61.
[6]Allan S M,Rothwell N J.Cytokines and acute neurodegeneration [J].Nat Rev Neurosci,2001,2( 10) : 734-44.
[7]Yamada E.The fine structure of the gall bladder epithelium of the mouse[J].J Biophys Biochem Cytol,1955,1( 5) : 445-58.
[8]Davies D C.Blood-brain barrier breakdown in septic encephalopathy and brain tumors[J].J Anat,2002,200( 6) : 639-46.
[9]Faehling M,Kroll J,Föhrk J,et al.Essential role of calcium in vascular endothelial growth factor A-induced signaling: mechanism of the antiangiogenic effect of carboxyamidotriazole[J].FASEB J,2002,16( 13) : 1805-7.
[10]Argaw A T,Asp L,Zhang J,et al.Astrocyte-derived VEGF-A drives blood-brain barrier disruption in CNS inflammatory disease [J].Clin Invest,2012,122( 7) : 2454-68.
[11]Wei M,Li H,Huang H,et al.Increased expression of EMMPRIN and VEGF in the rat brain after gamma irradiation[J].J Korean Med Sci,2012,27( 3) : 291-9.
[12]Kim J,Jung Y.Different expressions of AQP1,AQP4,eNOS and VEGF proteins in ischemic versus non-ischemic cerebropathy in rats: potential roles of AQP1 and eNOS in hydrocephalic and vasogenic edema formation[J].Anat Cell Biol,2011,44( 4) : 295-303.
[13]Cox D J,Pilkington G J,Lantos P L.The fine structure of blood vessels in ethylnitro sourea-induced tumours of the rat nervous system: with special reference to the breakdown of the blood-brain barrier[J].Exp Pathol,1976,57( 4) : 419-30.
[14]Vaidyanathan R,Vega A L,Song C,et al.The interaction of caveolin 3 protein with the potassium inward rectifier channel Kir2.1: physiology and pathology related to long qt syndrome 9 ( LQT9) [J].J Biol Chem,2013,288( 24) : 17472-80.
[15]Ariotti N,Parton R G.SnapShot: caveolae,caveolins,and cavins [J].Cell,2013,154( 3) : 704.
[16]Karamysheva A F.Mechanisms of angiogenesis[J].Biochemistry,2008,73( 7) : 751-62.
Mechanism of IL-1β enhance Blood-Brain Tumor Barrier permeability
WANG Jian,SUN Yue-ming,QIN Li-juan
( School of Basic Medical Sciences,North China University of Science and Technology,Tangshan Hebei 063000,China)
Abstract:AimTo study the effect of IL-1β on protein expression of vascular endothelial growth factor in glioma cells and plasma membrane microcapsule structure protein caveolin-1 and plasma membrane vesicles in brain microvascular endothelial cells,and preliminarity discuss the possible mechanism of IL-1β opening blood tumor barrier.Methods The tumor barrier model was established by transwell in vitro.The effect of IL-1β on the expression of VEGF in glioma cells and caveolin-1 in brain microvascular endothelial cells was dynamically monitored by Western blot.TEM was used to observe the number of plasma membrane vesicles of brain microvascular endothelial cells.Sodium fluorescein leakage test was used to assess the permeability of blood tumor barrier after IL-1β.ResultsThe tumor barrier model was successfully established by transwell in vitro.When IL-1β treated the model of blood tumor barrier,the expression of VEGF increased,and reached the peak at 60min,and recovered to the initial state at 120min.The permeability of the blood tumor barrier model was the highest at 60min.In addition,our results also found that,the protein expression of plasma membrane microcapsule structure protein caveolin-1 and number of plasma membrane vesicles in brain microcapsule endothelial cells reached peak at 60 min,subsequently reduced and returned to non drug state at 120min.ConclusionIL-1β increases blood tumor barrier permeability,which may be related to IL-1β increasing the number of plasma membrane vesicles through VEGF/caveolin-1 pathway.
Key words:VEGF; IL-1β; blood tumor barrier; caveolin-1; glioma; plasma membrane vesicles
作者简介:王健( 1989-),男,硕士,研究方向:脑肿瘤防治;
基金项目:国家自然科学基金资助项目( No 81101912) ;河北省中医药管理局中医药类科研项目( No 2014195) ;河北省卫生厅科学研究基金项目( No 20150491) ;河北省科技计划项目( No 152777189)
收稿日期:2015-09-25,修回日期: 2015-11-25
文献标志码:A
文章编号:1001-1978( 2016) 01-0094-04
doi:10.3969/j.issn.1001-1978.2016.01.020